甘肃山楂与山里红总黄酮的提取及含量测定方法研究
2018-06-23马媛媛
张 旭,张 蕾,马媛媛
(1、甘肃省兽药饲料监察所,兰州 730030 2、兰州大学第一附属医院,兰州 730030)
山楂收录于《中华人民共和国兽药典》2015年版二部,是蔷薇科山楂属植物山里红(CrataeguspinnatifidaBge.var.major N. E. Br.)或山楂(CrataeguspinnatifidaBge.)的干燥成熟果实,具有消食化积,行气散瘀之功效[1]。另有山楂叶的记载,其叶片亦具有活血化瘀,理气通脉、化浊降脂之功效[2]。山楂中含有黄酮类、有机酸类等多种成分[3-4],不同样品间各成分含量相差较大[5]。目前已从中分离得到了金丝桃苷、槲皮素、牡荆素、芦丁等多种成分[6]。同时山楂也作为一种饲料添加剂广泛应用在畜牧业中,发挥着提高饲料蛋白质、脂肪的消化率,降低饲料消耗,防治疾病,提高成活率,促进动物生长发育的作用[7],从而提高经济效益。因此,山楂总黄酮的研究开发具有重要的经济和社会效益,山楂在兽药饲料中的开发与利用应备受关注。
在我国该属植物种类繁多且分布广泛,《甘肃中草药资源志》[8]中记载的原植物有山楂、山里红、甘肃山楂、华中山楂四种。试验对甘肃山楂与山里红果实和叶片中总黄酮的提取及含量测定方法进行了研究,以期为甘肃省该属植物的综合开发利用提供实验基础。
1 材 料
1.1 仪器 METTLER AE240电子天平,METTLER AE110电子天平,BX8200HP超声波清洗器,Evolution 300 LC紫外-可见分光光度计,旋转蒸发仪,粉碎机。
1.2 试剂与药材 氢氧化钠,亚硝酸钠,硝酸铝,乙醇,均为分析纯,纯化水。芦丁对照品(中国药品生物制品检定所提供,100080-200707),山里红果和叶药材(购于兰州黄河药市),甘肃山楂果和叶(采于榆中官滩沟),以上两种材料均由兰州大学马志刚教授鉴定,以山里红为例进行方法验证实验。
2 方法与结果
2.1 总黄酮的含量测定
2.1.1 样品与对照品溶液的制备 精密称取山里红果实粉末1.0 g,以20倍量60%乙醇回流1 h,抽滤,滤液转移至50 mL容量瓶中,用60%乙醇定容至刻度,摇匀,即为样品溶液。
精密称取芦丁对照品20.0 mg,置于50 mL容量瓶中,用乙醇溶解,超声助溶,放冷,定容至刻度,摇匀,即为对照品溶液。
2.1.2 标准曲线的制备
2.1.2.1 测定最大吸收波长 将处理好的样品溶液过滤,精密量取续滤液1 mL至25 mL容量瓶中,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min;加10%硝酸铝溶液1 mL,摇匀,放置6 min;加4%氢氧化钠溶液10 mL,加乙醇定容至刻度,摇匀,进行显色处理。放置15 min后,以乙醇为空白,在480~570 nm处进行扫描。
芦丁标准溶液亦按以上步骤进行显色、扫描。由图1可知,芦丁标准溶液和样品溶液吸收曲线形状相同,且均在507 nm处有最大吸收,故实验选取507 nm作为测定波长。结果见图1。

(1)芦丁吸光光谱曲线; (2)山里红吸收光谱曲线(1) Absorption spectrum curve of rutin (2) Absorption spectrum curve of Crataegus pinnatifida图1 吸收光谱图Fig 1 Absorption spectrogram
2.1.2.2 线性关系考察 精密量取上述芦丁对照品溶液0、0.5、1.0、2.0、3.0、4.0、5.0 mL分别置于25 mL容量瓶中,按2.1.2.1所述方法,进行显色,静置15 min后,以乙醇为空白,在507 nm的波长处测定吸光度,以吸光度(y)为纵坐标,浓度(x)为横坐标,绘制标准曲线,得回归方程为:y=12.607x-0.0055,R2=0.9996,在质量浓度为0.0082~0.0820 mg/mL范围内,芦丁质量浓度与吸光度呈良好的线性关系。结果见图2。
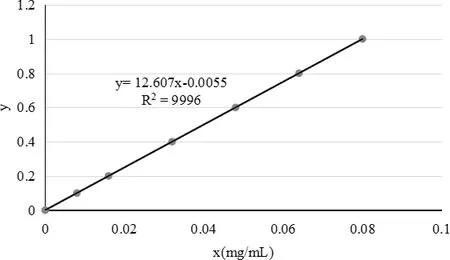
图2 标准曲线图Fig 2 Standard curve diagram
2.1.3 总黄酮工艺优化
2.1.3.1 总黄酮含量测定 精密称取1.0 g山里红果实粉末,置于圆底烧瓶中,用一定量的乙醇回流提取一段时间后,抽滤,旋转蒸发;用乙醇定容至50 mL容量瓶中,摇匀,作为待测液;取0.5 mL待测液按2.1.2.1所述方法,进行显色,静置15 min后,以乙醇为空白,在507 nm的波长处测定吸光度。测3次,取平均值。根据回归方程,用吸光度计算出被测液中黄酮含量。
式中:V为提取液定容体积/mL;B为吸取测定体积/mL;C为线性方程计算出的质量浓度/(mg/mL);D为测定时定容体积/mL;m为称取的样品质量/g。
2.1.3.2 单因素试验
2.1.3.2.1 乙醇浓度对黄酮提取量的影响 精密称取5份山里红果实粉末样品各1.0 g置于100 mL圆底烧瓶中,分别加入30 mL乙醇溶液作为溶剂,控制乙醇浓度分别为50%、60%、70%、80%、90%,提取2 h。抽滤,旋转蒸发,用乙醇定容至50 mL。从中取1 mL按4.2.1.2.1所述方法显色,在波长507 nm处测定提取液吸光度,计算总黄酮提取率。结果见图3。
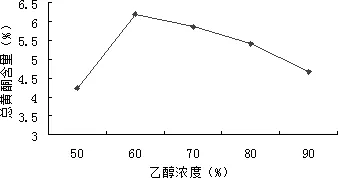
图3 乙醇浓度影响Fig 3 Effect of ethanol concentration
由图可知,随着乙醇浓度的增大,山里红果实粉末总黄酮的提取率先增大后减小,这可能是因为乙醇浓度的增加会使一些醇溶性杂质的溶出量增加,这些杂质与黄酮类化合物竞争乙醇,从而导致溶出的黄酮类化合物减少。实验结果表明,60%乙醇作为提取浓度时总黄酮提取率最高。因此,选定60%、70%、80%作为正交实验中乙醇浓度的三个水平。
2.1.3.2.2 料液比 精密称取5份粉碎的山里红果实粉末样品各1.0 g,置于500 mL圆底烧瓶中,分别用60%乙醇溶液作为溶剂,控制料液比为1∶10、1∶20、1∶30、1∶40、1∶50,提取2 h。抽滤,旋转蒸发,用60%乙醇定容至50 mL。从中取1 mL按2.1.2.1所述方法显色,在波长507 nm处测定提取液吸光度,计算总黄酮提取率。结果见图4。
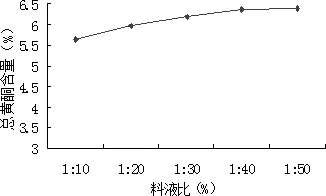
图4 料液比的影响Fig 4 Effect of Solid-liquid ratio
由图可知,随着料液比的减小,山里红果实总黄酮的提取率增大,但料液比达到1∶40后,提取率趋于稳定,此时黄酮类化合物已基本提取完全。且考虑到乙醇浓度过高会增加生产成本,因此,选定1∶20、1∶30、1∶40作为正交实验中料液比的三个水平。
2.1.3.2.3 提取时间 精密称取5份山里红果实粉末样品各1.0 g,置于500 mL圆底烧瓶中,分别加入30 mL60%乙醇溶液作为溶剂,控制提取时间为1、2、3、4 h。抽滤,旋转蒸发,用60%乙醇定容至50 mL。从中取1 mL按2.1.2.1所述方法显色,在波长507 nm处测定提取液吸光度,计算总黄酮提取率。结果见图5。
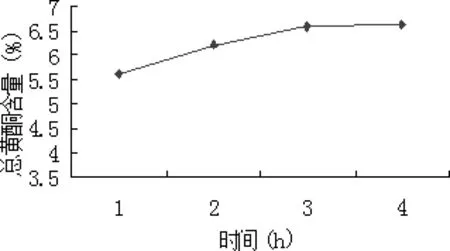
图5 提取时间的影响Fig 5 Effect of extracting time
由图5可知,随着提取时间的延长,提取得到的总黄酮逐渐增加,3 h后提取率增加缓慢。为了提高提取效率和缩短生产周期。选定1、2、3 h作为正交实验中乙醇体积分数的三个水平。
通过上述实验,对乙醇体积分数(50%、60%、70%、80%、90%)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、提取时间(1、2、3、4 h)等影响因素进行分析,拟定影响山里红果实总黄酮提取率的四个因素即A(乙醇浓度)、B(料液比)、 C(提取时间)、D(提取次数)为优选因素,每个因素三个水平进行L9(34)正交试验,以确定山里红果实总黄酮的最佳提取条件。
2.1.3.3 正交优化试验 选取乙醇体积分数(A)、料液比(B)、提取时间(C)、提取次数(D)进行4因素3水平正交试验,L9(34)试验设计与结果见表1、2。
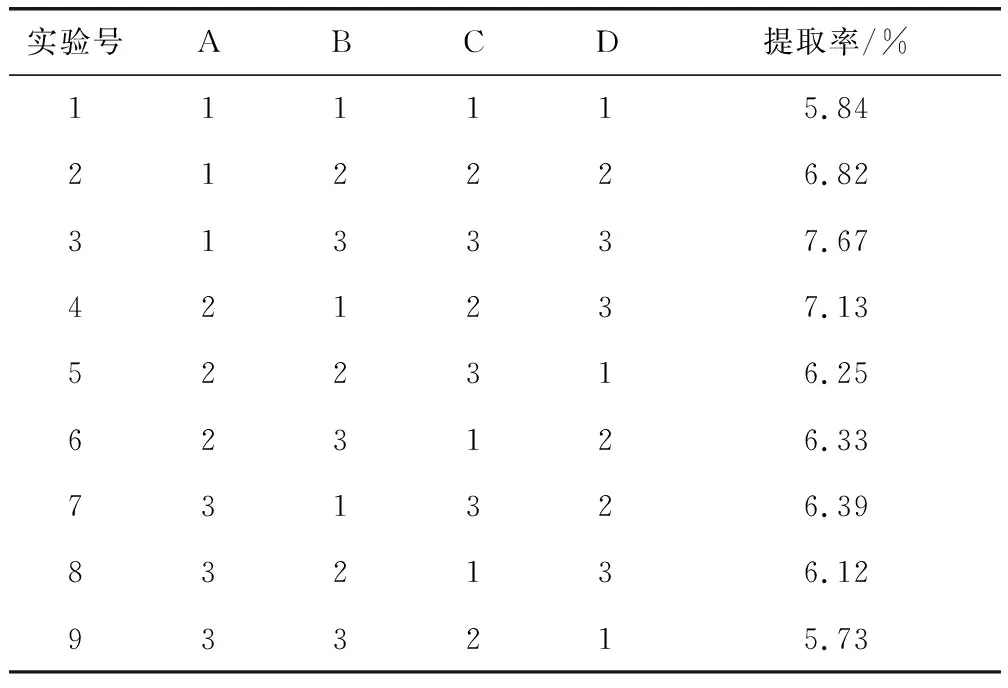
表1 正交试验结果Tab 1 Results of orthogonal test
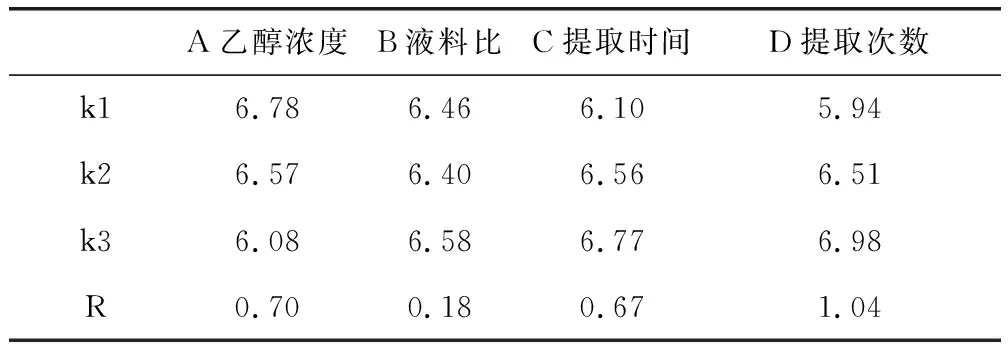
表2 山里红果实总黄酮提取正交试验因素水平表Tab 2 Orthogonal factor level table for total flavonoidsextraction of C.kansuensis fruit
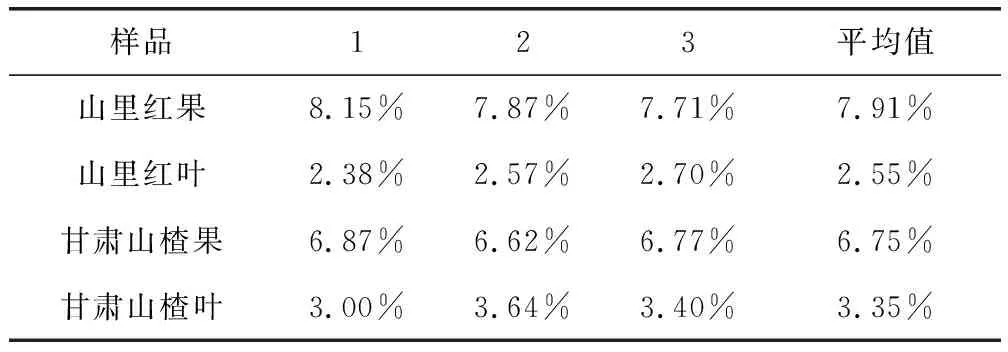
表3 山里红和甘肃山楂的果实和叶片中总黄酮的含量(n=3)Tab 3 The content of Flavonoids in fruit or leaf ofC.kansuensis and Crataegus pinnatifida(n=3)
由表2中的R极差分析可以得出,各因素影响的主次关系为D>A>C>B。山里红总黄酮的最佳提取条件为A1B3C3D3,即乙醇体积分数60%、料液比1∶40、提取时间3 h、提取次数3次。按A1B3C3D3组合平行进行3次试验,得到山里红和甘肃山楂的果实和叶片中的总黄酮提取率平均值,见表3。
由表3可见,山里红果和甘肃山楂果中总黄酮的平均含量分别为7.91%和6.75%,叶中的平均含量分别为2.55%和3.35%。
2.1.3.4 方法学验证
2.1.3.4.1 精密度实验 取2 mL芦丁对照品溶液(0.41 mg/mL)置于25 mL容量瓶中,显色后,在507 nm波长处测定其吸光度,连续测定6次。计算RSD=0.01%,RSD<5%,表明精密度良好。结果见表4。

表4 精密度实验结果Tab 4 Results of the precision experiment
2.1.3.4.2 稳定性实验 按优选出的方法制备山里红果实粉末的供试品溶液,按2.1.2项下方法显色,室温下分别放置 0、2、4、8、24、48 h 后,在507 nm波长处测定其吸收度。计算得其RSD分别为1.68%,RSD<5%,说明供试品在两天内稳定。结果见表5。

表5 稳定性实验结果Tab 5 Results of the stability Experiment
2.1.3.4.3 重现性实验 取5份山里红果实粉末,精密称定,按优选出的方法制备供试品溶液,按2.1.2项下方法显色,507 nm波长处测定其吸光度。计算含量,计算RSD=3.03%,RSD<5%,说明优选方案的重现性良好。计算浓度时使用之前的标准曲线:y=12.607x-0.0055,结果见表6。
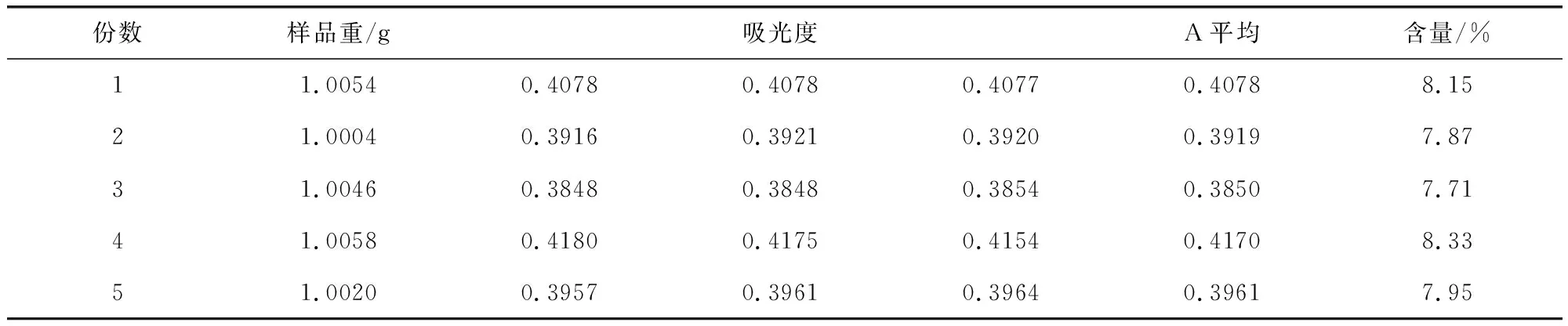
表6 重现性实验结果Tab 6 Results of the reproducibility Experiment
2.1.3.4.4 加样回收试验 取9份2.1.3.4.3项中的样品各0.5 mL,分别置于25 mL容量瓶中,平均分为三组,各组分别精密加入对应的芦丁标准品溶液(0.41 mg/mL),进行加样回收率测定。测定量是由测得的吸光度根据标准曲线换算得到的含量。计算得,加样回收率RSD=3.42%,回收率较高,偏差较小,说明该方法准确度较高。结果见表7。
加样回收率=(测定量-已知量)/加入量×100%
已知量:取重现性实验所得的浓度1.5761 mg/mL来计算,即为V样·C样=0.7881 mg
3 讨 论
实验验证各因素影响的主次关系为提取次数(D)>乙醇体积分数(A)>提取时间(C)>料液比(B),即乙醇体积分数为60%、料液比为1∶40、提取时间为3 h、提取次数为3次是最佳提取条件。因此,最终确定甘肃山楂与山里红总黄酮含量的测定方法为:精密称取1.0000 g山里红果实粉末,置于圆底烧瓶中,用60%乙醇为溶剂,按料液比为1∶40回流提取3 h,抽滤,旋转蒸发;用60%乙醇定容至50 mL容量瓶中,摇匀,过滤,精密量取续滤液1 mL至25 mL量瓶中,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min;加10%硝酸铝溶液1 mL,摇匀,放置6 min;加4%氢氧化钠溶液10 mL,加60%乙醇定容至刻度,摇匀,进行显色处理。放置15 min后,以乙醇为空白,在507 nm的波长处测定吸光度。该方法的精密度、重现性良好,加样回收率高,偏差较小,准确度较高。

表7 加样回收实验结果Tab 7 Results of the recovery Experiment
山里红和山楂在甘肃主要是人工栽培,且产量较山东、山西等大产区要少,而甘肃山楂在甘肃具有丰富的野生资源,却鲜为利用[9]。
山楂属植物全身是宝,山楂叶在《中国药典》中有收录,而在《中国兽药典》中未有收录,山楂叶在兽药、饲料添加剂中的利用有待进一步开发。
据文献报道,山楂总黄酮中3个主要有效成分分别为芦丁、金丝桃苷、牡荆素。其中芦丁为主要成分,因此作者只对芦丁进行了含量测定的研究,而其他两种成分有待进一步研究分析。
参考文献:
[1] 中国兽药典委员会. 中华人民共和国兽药典2015年版(二部)[S].
Commission of Chinese Veterinary Pharmacopoeia.Veterinary pharmacopoeia of Pecple's Republic of China volume II 2015 editon[S].
[2] 国家药典委员会.中华人民共和国药典2015年版(一部)[S].
Commission of Chinese Pharmacopoeia. Pharmacopoeia of Pecple's Republic of China volume I 2015 editon[S].
[3] 罗嘉琪,许 滨,陈 雨,等. 山楂药材中八种降血脂有效成分的提取与HPLC含量测定[J].广东化工,2017,44(4):17.
Luo J Q,Xu B,Chen Y,etal.Extraction and HPLC Determination of eight Hypolipidaemic Constituents in Crateagus[J].Guangdong Chemical Industry.2017,44(4):17.
[4] 杨 华,张知贵,李小慧. 山楂叶总黄酮对高脂血症大鼠血脂和血液流变性的影响[J].中国实验方剂学杂志,2012,18(12):257.
Yang H,Zhang Z G,Li X H. Effects of Total Flavonoids of Crataegus pinnatifida Leaves on Blood Lipids and Hemorrheology of Hyperlipidemia Rats[J].Chinese Jouenal of Experimental Traditional Medical Formulae,2012,18(12):257.
[5] 杜义龙.基于HPLC指纹图谱对承德山楂叶和山里红叶的比较研究[D].承德:承德医学院,2013.
Du Y L.Comparative study on ChengDe Crataegus and Crataegus pinnatifida Based on HPLC Fingerprint[D]. ChengDe: ChengdeMedical College,2013.
[6] 王光忠,肖 锦,闫 磊,等. 高效液相色谱法测定山楂总黄酮提取物中芦丁和金丝桃苷的含量[J].湖北中医学院学报,2009,30b(3):32-34.
Wang G Z,Xiao J,Yan L,etal.Determination of Rutin and Hyperoside in Extract from Crataegus pinnatifida Bge. by HPLC[J].Journal of Hubei College of Traditional Chinese Medicine.2009,30b(3):32-34.
[7] 白水莉,刘大林. 山楂在饲料中的开发与利用[J].中国畜牧兽医,2007,34(11):27.
Bai S L,Liu D L.The Development and Utilization of Crataegus pinnatifida in Feed[J].China Animal Husbandry and Veterinary Medicine.2007,34(11):27.
[8] 赵汝能. 甘肃中草药资源志[M].兰州:甘肃科学技术出版社,2004.
Zhao R N. GanSu Herbal Medicine Resources[M].LanZhou:Gansu Science and Technology Press,2004.
[9] 杨伟丽,马媛媛,顾秀琰. 甘肃山楂属植物资源及综合利用价值分析[J].卫生职业教育,2015,33(1):130-132.
Yang W L,Ma Y Y,Gu X Y. Analysis of Resources and Comprehensive Utilization Value of Crataegus L. in Gansu province[J].Health Vocational Education, 2015,33(1):130-132.
