两种棘球绦虫的水通道蛋白基因克隆及功能特性的比较
2018-06-21,,,,,
, ,, ,,
棘球蚴病(echinococcosis)也称包虫病(hydatid disease),主要是由棘球绦虫的幼虫棘球蚴 (或称包虫)寄生于人体或食草动物脏器所引起的人兽共患寄生虫病。在目前已知的几种棘球绦虫中对人危害较严重的是细粒棘球绦虫(Echinococcusgranulosus)和多房棘球绦虫(Echinococcusmultilocularis),其分别引起囊型包虫病(cystic echinococcosis, CE)和泡型包虫病(alveolar echinococcosis, AE)。人是棘球绦虫的中间宿主,人误食棘球绦虫虫卵污染的蔬菜或水后,虫卵在十二指肠内孵出六钩蚴,六钩蚴可穿过肠壁进入门静脉系统,进而迁移到全身各器官发育为棘球蚴,最终发育成为单个包囊(单房棘球蚴,也称棘球蚴)或由无数个小囊泡相互连接聚集而成的囊泡状团块(多房棘球蚴,也称泡球蚴)。CE流行范围较AE广泛,但AE的致病性比CE更为严重,因可呈浸润性生长,素有“恶性包虫病”或“虫癌”之称,如果不采取有效的治疗措施,10年死亡率达90%以上[1]。
手术切除是治疗包虫病的首选方法,但大多数患者就诊时已经到了中晚期,只能选择药物治疗[2-4]。目前,治疗包虫病的主要药物为阿苯达唑和甲苯咪唑,由于包虫囊壁较厚,药物的通透性差,长期服用有很大的副作用,同时也会产生耐药性[5-7]。因此,探寻棘球蚴病治疗新靶点是当前研究的热点。
水通道蛋白(aquaporin, AQP),又叫水孔蛋白或亲水孔蛋白,是普遍存在于生物体细胞膜上的一类能促进水、甘油、尿素等小分子溶剂运输的膜通道蛋白,属于主要内在蛋白(major intrinsic protein, MIP)超家族[8]。根据功能及结构特性,AQPs可分为专一性水通道蛋白亚族(只允许水分子通过)和水-甘油水通道蛋白亚族(除了水分子,还允许甘油、尿素等小分子通过)[9]。水通道蛋白多肽链的N和C末端位于细胞质膜的胞质侧[10],具有6个跨膜螺旋,由A~E5个环连接,B环和E环上的NPA基序在不同AQPs中高度保守,是AQPs通透水分子的结构基础[11]。AQPs不仅对寄生虫维持和调节渗透压具有重要作用,还参与寄生虫营养物质转运以及代谢产物排出等生理过程,研究发现寄生虫AQPs还可以参与抗寄生虫药物的运输[12-14]。
棘球蚴与泡球蚴分别是单房棘球蚴与多房棘球蚴的简称。单房棘球蚴主要由囊壁和囊内容物组成(包括囊液、原头蚴、囊砂等)。单房棘球蚴囊壁分内、外两层,外层为角皮层,内层为生发层(亦称胚层,具有旺盛的增殖能力),囊液为无色透明或淡黄色的水样液体。多房棘球蚴与单房棘球蚴有所不同,形态上由许多小的囊泡组成,而且总体上多房棘球蚴囊液比单房棘球蚴的少。目前的问题是,不管哪种棘球蚴,其囊液的来源与生成机制一直是个谜,有研究表明,棘球蚴囊液通过生发层细胞膜的渗透水通透系数远远大于其简单扩散通过细胞膜的扩散通透系数[15],但一直缺乏对此结果进行深入的原因分析。因此,本研究提出的假说是棘球蚴囊壁生发层细胞膜AQPs在囊液形成过程中发挥重要作用。
研究表明细粒棘球绦虫基因组存在7个编码AQPs的基因,包括EgAQP (accession number: EgrG_000125500)、EgAQP1 (accession number: EgrG_000125400)、EgAQP3 (accession number: EGR_03137)、EgAQP4 (accession number: EgrG_000125550)、EgAQPFA-CHIP (accession number: Egr_04161)、EgAQPAnG (accession number: Egr_04162)和EgAQP9 (accession number: EgrG_001190800);多房棘球绦虫基因组存在6个编码AQPs的基因,包括EmAQP (accession number: EmuJ_000125500)、2个EmAQP9 (accession number: EmuJ_001190800和EmuJ_000153200)、2个EmAQP4 (accession number: EmuJ_000125600和EmuJ_000124900)和EmAQP1 (accession number: EmuJ_000125400)[16],但对于AQPs在棘球蚴囊壁生发层上的表达及其与囊液形成关系的研究都未见报道。本研究利用RT-PCR扩增棘球蚴AQPs基因,并在非洲爪蟾卵母细胞中进行异源表达以验证其水通道功能,通过对细粒棘球绦虫和多房棘球绦虫AQPs的基因克隆及功能进行比较,为阐明棘球蚴、泡球蚴囊液的形成过程以及筛选棘球蚴病新的药物治疗靶点提供理论依据。
1 材料与方法
1.1寄生虫及实验动物 感染细粒棘球蚴的羊肝采集自新疆某屠宰场,通过冷链快递方式运至本实验室。无菌收集原头蚴,用含有1%青-链霉素的无菌PBS反复清洗至能清晰观察到原头节自然下沉为止。清洗后的原头蚴悬液经0.4%台盼蓝染色后显微镜下观察其活力,活力>90%时用于动物接种。从重庆医科大学实验动物中心购买6~8周龄,健康雌性BLAB/c小鼠,体质量18~22 g,每只小鼠经腹腔注射接种4 000个原头蚴,于接种后3个月,解剖小鼠,收集囊泡,用于提取总RNA。感染泡球蚴的SD大鼠由成都医学院病原生物学教研室王昕教授惠赠,严格无菌操作解剖大鼠,收集囊泡,用于提取总RNA。
1.2棘球蚴囊泡总RNA提取及cDNA合成 取100 mg棘球蚴囊泡装入无酶1.5 mL EP管,用经DEPC (diethyl pyrocarbonate,焦碳酸二乙酯) 水处理的灭菌剪刀剪碎,加入1 mL Trizol,冰上匀浆,用于提取总RNA。总RNA提取按RNeasy Mini Kit试剂盒说明书(康维世纪,北京)进行。经1%琼脂糖凝胶电泳检测总RNA的完整性并用Nano Drop ND-2000分光光度计测定浓度及OD260nm/OD280nm值。以各样品1 mg总RNA为模板,利用PrimeScriptTMRT reagent kit with gDNA Eraser(TaKaRa,大连)反转录试剂盒合成cDNA第一链,-80 ℃保存备用。
1.3棘球蚴AQPs引物合成及基因克隆 根据细粒棘球绦虫和多房棘球绦虫AQPs基因组序列信息,采用Primer premier5.0软件设计RT-PCR特异性引物,引物序列及相关信息见表1。引物均由上海生工生物工程有限公司合成。
表1 棘球绦虫AQPs基因扩增所用引物序列及相关信息
Tab.1 Primer sequences and relative information of AQPs from Echinococcus

NameAccession numberPrimer sequences(5′ to 3′)Size of products(bp)EmAQPEmuJ_000125500F: CCGAATTCATGTTCTTGGAGGATTTGCC738R: CGC TCG AGTTTTCCACCAGTTTCTTCGGEmAQP1EmuJ_000125400F: CGG AAT TCATGCCCGGTCCTGGAGTAA657R: CGCTCGAGGCTTCTGCGTTGCTCACTCEmAQP4EmuJ_000125600F: CGGAATTCATGATCACCTTTCCTTACTTCC777R: CCC TCG AGCGCTTTGTGGGCTTTTGTATTTEmAQP4EmuJ_000124900F: CGGAATTCATGAAGAAGCCATCCTGC786R: CCC TCG AGGACACCCACATCTTCTTGEmAQP9EmuJ_001190800F: CGG AAT TCATGAAACACATCACCGA981R: CCC TCG AGAACATCTGATTCATCTCCEmAQP9EmuJ_000153200F: CGG AAT TCATGTCAGTGAGCCAAAA882R: CCC TCG AGCTTTGCCTCGCTTAAATEgAQPEgrG_000125500F: CCGAATTC ATGTTCTTGGAGGATTTGCC738R: CCC TCG AGC TCCACCAGTTTCTTCGGAGEgAQP1EgrG_000125400F: CCGAATTC ATGCCCGGTCCTGGAGTAA657R: CCC TCG AGC GCTCACTTCGCTCATCCGAEgAQP3EGR_03137F: CGG AAT TCA TGT CAG TGA GCC AAA ATA ATA ACC978R: CCC TCG AGC TTT GCC TCG CTT AAA TCEgAQP4EgrG_000125550F: CGGAATTCATGACTAAGAATCCGGTGCC801R: CCCTCGAGTCAGCTGTTCCCCAAGTCGTCAEgAQPFA-CHIPEgr_04161F: CCGAATTCATGCCGCACAGGTACCAC1050R: CCC TCG AGGCTTCTGCTAACAGACEgAQPAnGEgr_04162F: CGG AAT TCA TGT TCT TGG AGG ATT TGC CAT G717R: CCC TCG AGC TCG TCT GAT TTC GTG GEgAQP9EgrG_001190800F: CCGAATTC ATGTCAGTGAGCCAA978R: CCC TCG AGC CTTTGCCTCGCTTAA
以棘球蚴囊泡cDNA为模板,用AQPs特异性引物进行PCR扩增,扩增体系为25 μL,各反应成分分别为10×PCR buffer 2.5 μL,dNTP 0.5 μL,MgCl21.5 μL,上、下游引物各0.5 μL (10 μmol/L),cDNA 1.0 μL,ExTaq DNA polymerase 0.25 μL (2.5 U/μL),ddH2O 18.25 μL。反应条件为:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min 30 s,30个循环;72 ℃ 10 min。PCR产物(5 μL)经1%琼脂糖凝胶电泳检测,选择片段大小与预期相符的PCR产物进行切胶回收,用凝胶回收试剂盒(康为世纪,北京)纯化后,克隆到pMD19-T质粒(命名为pMD19-T-AQPs),用热激法转化大肠杆菌DH5α感受态细胞,挑取阳性菌落进行PCR鉴定,并送宝生物(大连)生物工程有限公司进行测序验证。
1.4AQPs体外转录载体的构建及体外转录模板的制备 pMD19-T-AQPs质粒经限制性内切酶EcoRI和xhoI双酶切后,连接到经限制性内切酶EcoRI和xhoI双酶切后的pCS-107质粒(该质粒含有爪蟾β-珠蛋白5′和3′非编码区,由清华大学陶庆华教授惠赠),构建AQPs体外转录载体pCS-107-AQPs。
体外转录载体pCS-107-AQPs经限制性内切酶AscI酶切,使之线性化,利用体外转录试剂盒mMESSAGE mMACHINE High Yield Capped RNA Transcription Kit (Ambion, cat#AM1340)合成cRNA(capped RNAs)。
1.5非洲爪蟾卵母细胞显微注射及透水系数检测 实验用的非洲爪蟾(Xenopuslaevis)由清华大学陶庆华教授实验室提供,取1只成熟雌性爪蟾(未取卵),麻醉后在卵巢位置纵向切开1个小口,用尖头镊子取出部分卵叶组织,放入装有卵母细胞培养液的培养皿中。在显微镜下用尖头镊子剥离卵母细胞滤泡膜,选择V或VI期卵母细胞进行显微注射,每颗卵母细胞注射50 nL AQPs cRNA(实验组)或DEPC水(对照组),每个基因注射20颗卵母细胞。
经显微注射后的卵母细胞在含有1%青-链霉素的ND96溶液中培养48 h(培养温度为18 ℃)后,转入经双蒸水进行1∶5稀释的ND96溶液中,立即于摄像显微镜下拍照,测定时环境温度为室温,每2.5 min捕捉1张细胞体积变化的图,记录最初30 min的细胞体积变化情况。透水系数(water permeability,Pf)按下列公式计算:Pf=V0[d(V/V0)/dt]/[S0×Vw(Osmin-Osmout)],其中Osmin为细胞内渗透压,Osmout为细胞外渗透压,初始体积V0为9×10-4cm3,水分子的偏摩尔体积Vw为18 cm3/mL,初始细胞表面积S0为0.045 cm2[17],体积按下列公式计算:V=(4/3)×S×(S/π)1/2(S为细胞表面积)。
1.6序列分析及比较 利用TMHMM Server v.2.0软件(http://www.cbs.dtu.dk/services/TMHMM/)分析棘球绦虫AQPs的跨膜结构域;利用Clustal omega软件(https://www.ebi.ac.uk/Tools/msa/clustalo/)对棘球绦虫AQPs和人AQPs进行多序列比对。
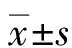
2 结 果
2.1棘球绦虫AQPs基因的扩增 细粒棘球绦虫基因组存在7个AQPs编码基因,但本研究以细粒棘球蚴囊泡mRNA为模板,利用AQPs特异性引物进行RT-PCR时,只有EgAQP3、EgAQP4和EgAQP9的扩增产物大小与预期一致,PCR产物分别为978 bp、801 bp和978 bp(图1A);而EgAQPAnG和EgAQP的扩增产物大小与预期不一致。遗憾的是未能扩增出EgAQPFA-CHIP和EgAQP1基因。将AQPs的测序结果与NCBI蛋白质数据库里的序列进行Blastx比对,结果表明扩增到的EgAQP4、EgAQP3和EgAQP9序列与NCBI中相应序列的一致性为100%;而EgAQP与细粒棘球绦虫LETM1 and EF hand domain containing protein 1 (accession number: CDS16482)的序列一致性为98%、EgAQPAnG与多房棘球绦虫表达蛋白(accession number: CDS35447)的序列一致性为62%。经Blastn比对,EgAQP3和EgAQP9的序列一致性为99%,表明EgAQP3和EgAQP9可能由同一个基因编码。
多房棘球绦虫基因组存在6个AQPs编码基因,但本研究只扩增到EmAQP4(accession number: EmuJ_000124900)和EmAQP9(accession number: EmuJ_001190800)2个基因,PCR产物分别为786 bp和981 bp(图1B)。将EmAQP4和EmAQP9的测序结果与NCBI蛋白质数据库里的序列进行Blastx比对,结果表明扩增到的EmAQP4和EmAQP9序列与NCBI中相应序列的一致性为100%。
因此,本研究在非洲爪蟾卵母细胞中验证EgAQP4、EgAQP9、EmAQP4和EmAQP9的水通道功能。
A:泳道1、3、5:DNA Ladder2000,泳道2:EgAQP3,泳道4:EgAQ4,泳道6:EgAQP9;B:泳道1、3:DNA Ladder2000,泳道2:EmAQP4,泳道4:EmAQP9。图1 细粒棘球绦虫和多房棘球绦虫AQPs基因的PCR扩增产物电泳结果Fig.1 PCR products of AQPs of E. granulosus and E. multilocularis
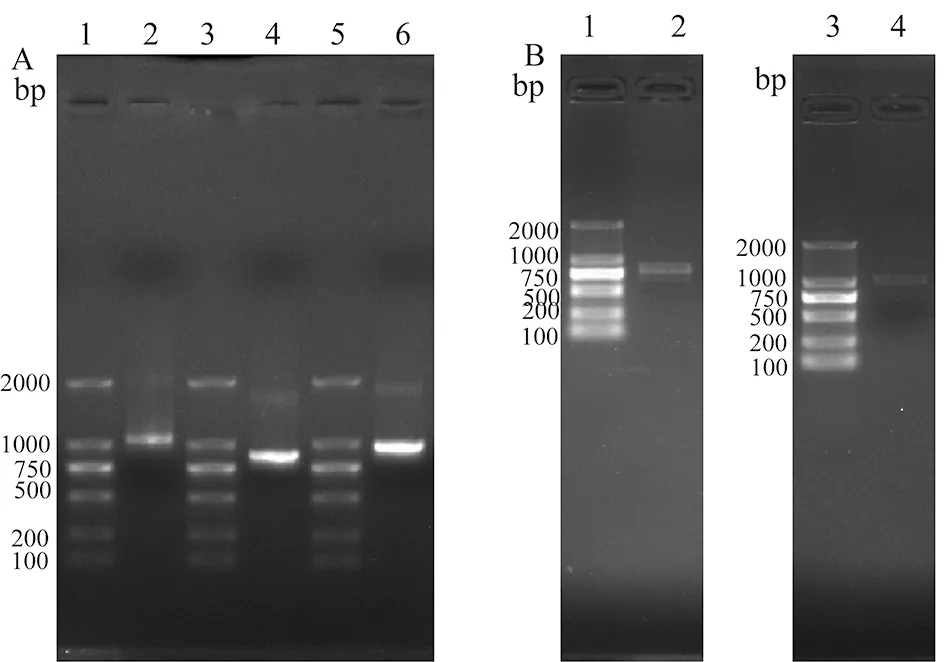
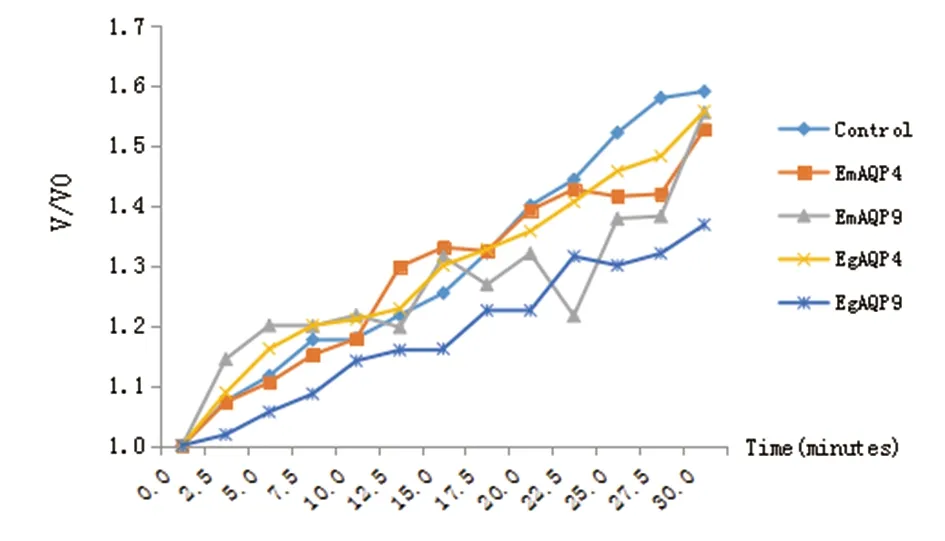
2.2注射棘球绦虫AQPs cRNA卵母细胞的透水系数检测 如图2所示,注射棘球绦虫AQPs cRNA的卵母细胞与注射DEPC水的卵母细胞的体积变化率(V/V0)差别无统计学意义(F=1.143,P>0.05)。注射EgAQP4、EgAQP9、EmAQP4和EmAQP9 cRNA的卵母细胞透水系数分别为3.60±0.42×10-8cm/s、3.29±0.33×10-8cm/s、3.57±0.43×10-8cm/s和3.53±0.32×10-8cm/s (n=20),对照组注射DEPC水的卵母细胞的透水系数为(3.62±0.52×10-8cm/s,n=20),各组差别无统计学意义(F=1.416,P>0.05)。
其中V为任一时刻体积、V0为初始体积。图2 注射了EgAQP4、EgAQP9、EmAQP4、EmAQP9基因cRNA及DEPC水的非洲爪蟾卵母细胞体积变化率(V/V0)Fig.2 Swelling rate of X. laevis oocytes (V/V0) injected with cRNA encoding EgAQP4, EgAQP9, EmAQP4, EmAQP9 or DEPC water control
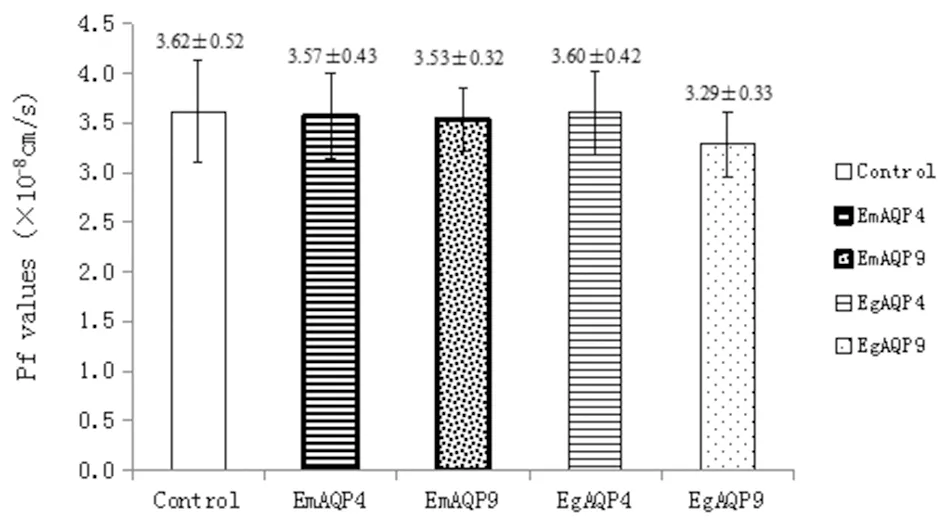
图3 注射了EgAQP4、EgAQP9、EmAQP4、EmAQP9基因cRNA的卵母细胞透水系数 (Pf)值Fig.3 Osmotic water permeability coefficient (Pf) of oocytes injected with cRNA encoding EgAQP4, EgAQP9, EmAQP4, EmAQP9 or DEPC water control
2.3跨膜结构域预测及多序列比对 水通道蛋白的6个跨膜螺旋参与构成通道管,跨膜结构域预测结果表明,EgAQP4和EmAQP4具有4个跨膜结构域,N和C末端均位于细胞质膜的胞质侧(图4A),而EgAQP9和EmAQP9具有5个跨膜结构域,N末端位于胞外侧,C末端位于胞质侧(图4B)。
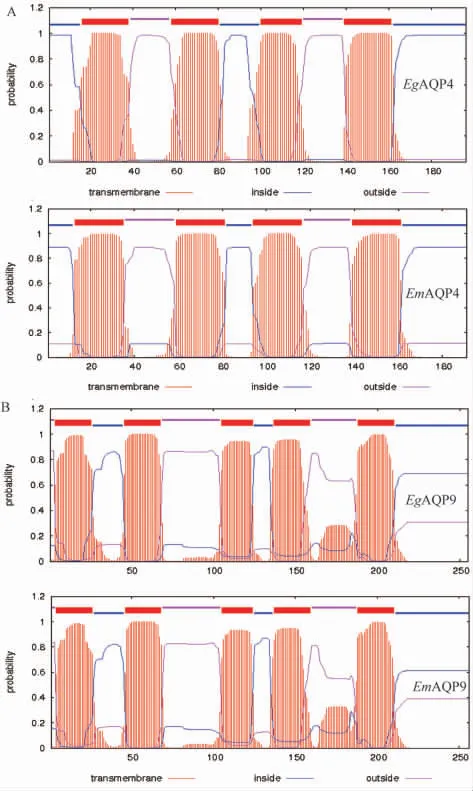
A:EgAQP4和EmAQP4具有4个跨膜结构域;B:EgAQP9和EmAQP9具有5个跨膜结构域。图4 细粒棘球绦虫和多房棘球绦虫AQPs跨膜结构域预测结果Fig.4 Prediction of transmembrane regions of AQPs of E. granulosus and E. multilocularis
人AQP1和AQP9具有水通道蛋白家族共同的结构特征,即氨基酸序列中含有2个高度保守的NPA基序,二级结构含6个跨膜结构域,蛋白的N末端和C末端都在胞质侧。NPA基序被认为是水通道蛋白通透水分子的结构基础,棘球绦虫AQPs与人AQPs的多序列比对结果表明,NPA基序在棘球绦虫AQPs中并不保守,EgAQP4和EmAQP4的NPA基序分别为NPM和NPT,而EgAQP9和EmAQP9具有两个保守的NPA基序(图5)。
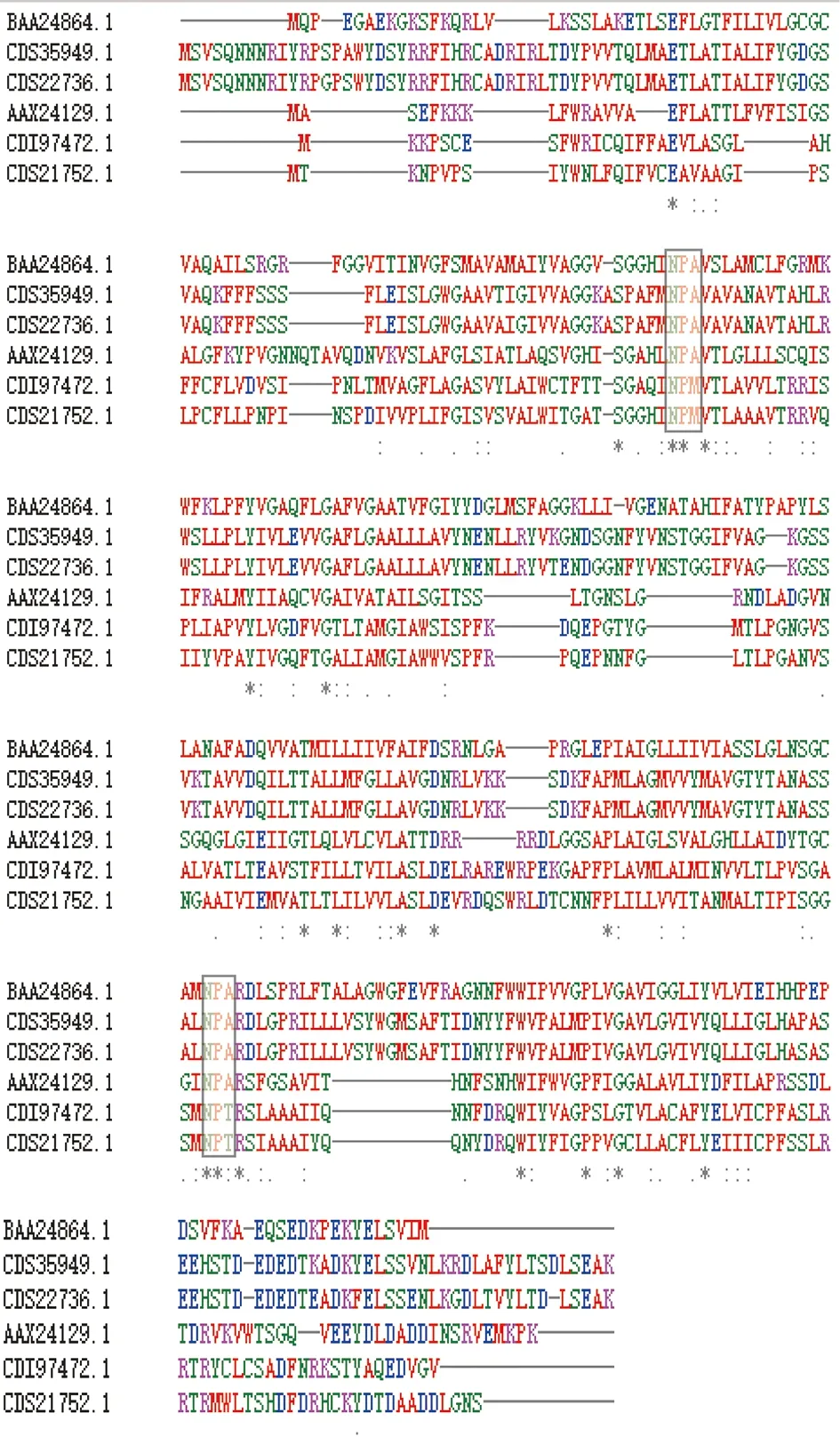
各蛋白登录号如下:CDS35949.1(EmAQP9)、CDI97472.1(EmAQP4)、CDS21752.1(EgAQP4)、CDS22736.1(EgAQP9)、AAX24129.1(人AQP1)、BAA24864.1(人AQP9);NPA基序用方框标示。图5 棘球绦虫AQPs与人AQPs多序列比对结果Fig.5 Multiple sequence alignment of AQPs of Echinococcus and human AQPs
3 讨 论
包虫病是我国需要重点防治的寄生虫病之一[18],在新疆、青海、甘肃、宁夏等省区同时有CE和AE两种类型的包虫病,严重威胁这些省区群众的健康和生命安全。尽管我国开展了包虫病防治活动,也取得了一定的成效,但该病仍没有得到有效控制[19],因此寻找有效的防治措施对预防、控制和治疗该病具有重要的意义。目前,通过基因组学和蛋白质组学等方法,寻找寄生虫发生发育过程中特异性的药物治疗靶点,是包虫病研究的热点[20]。有关棘球蚴病及棘球蚴的生物学特性研究已有不少,但棘球蚴生长过程中囊液的来源及生成机制一直是个谜。通过对棘球蚴囊壁生发层细胞膜上水通道研究不但有助于更科学地理解棘球蚴囊液的形成过程,更可为棘球蚴病的药物治疗提供新的靶点。
由于细粒棘球蚴在小鼠体内发育为不育囊[21],而多房棘球蚴囊泡内原头蚴的数目极少,因此本研究所提取的囊泡mRNA实际上就是囊壁生发层细胞的mRNA。本研究以囊壁生发层细胞mRNA为模板,对细粒棘球蚴和多房棘球蚴共13个AQPs基因进行RT-PCR,成功克隆了EgAQP4、EgAQP9、EmAQP4和EmAQP9四个基因。将这4个AQPs基因的测序结果与NCBI蛋白质数据库里的序列进行Blastx比对,结果表明扩增得到的EgAQP4、EgAQP9、EmAQP4和EmAQP9序列与NCBI中相应序列的一致性为100%。
由于非洲爪蟾卵母细胞具有细胞体积大,mRNA翻译能力强且质膜水通透性低等特点,使该系统成为目前检测寄生虫水通道蛋白功能最常用的检测系统。利用该检测系统证实了多种寄生虫AQP的水通道蛋白功能,例如后睾吸虫[22]、隐杆线虫[23]、大片形吸虫[24]、利什曼原虫[25]以及恶性疟原虫[26]。利用非洲爪蟾卵母细胞验证水通道蛋白功能的过程如下:将水通道蛋白的cRNA注射入非洲爪蟾卵母细胞中,在等渗溶液中培养2~3 d,让蛋白质得以合成。再将细胞转入低渗溶液内,在显微照相仪器下观察记录细胞体积的变化。通过与对照卵母细胞比较透水系数和发生破裂的时间,推测水通道蛋白功能活性。本研究以非洲爪蟾卵母细胞为表达系统将EgAQP4、EgAQP9、EmAQP4和EmAQP9的cRNA注射入非洲爪蟾卵母细胞中,以验证它们的水通道功能。本研究的试验结果表明注射棘球绦虫AQPs cRNA的卵母细胞与注射DEPC水的卵母细胞体积变化率及透水系数差别均无统计学意义。
经典的水通道蛋白具有6个跨膜螺旋和2个保守的NPA基序,N和C末端位于细胞质膜的胞质侧。水通道蛋白的6个跨膜螺旋参与构成通道管,跨膜结构域预测结果表明,EgAQP4和EmAQP4虽然N和C末端均位于胞质侧,但跨膜结构域数目为四个;EgAQP9和EmAQP9 N末端位于胞外侧、C末端位于胞质侧,跨膜结构域数目为五个。NPA基序被认为是水通道蛋白通透水分子的结构基础,棘球绦虫AQPs与人AQPs的多序列比对结果表明,NPA基序在棘球绦虫AQPs中并不保守,EgAQP4和EmAQP4的NPA基序分别为NPM和NPT,而EgAQP9和EmAQP9具有两个保守的NPA基序。结合跨膜结构域预测及多序列比对结果,本研究所扩增到的四个AQPs均不具有6个跨膜螺旋,而且EgAQP4和EmAQP4虽然N和C末端均位于胞质侧,但NPA基序被替换为NPM和NPT;EgAQP9和EmAQP9虽然具有两个保守的NPA基序,但N末端位于胞外侧、C末端位于胞质侧,棘球蚴AQPs的这些结构差异可能是其在非洲爪蟾卵母细胞中未表现水通道蛋白的原因。
基因克隆及卵母细胞功能验证实验结果表明,尽管棘球绦虫基因组中存在编码AQPs的基因,但这些AQPs基因不具有水通道功能,这可能正与棘球蚴的囊液形成机制相关。棘球绦虫囊液形成的过程可能是囊壁部分生发层细胞坏死后发生溶解液化,由此形成的水份不能通过生发层细胞膜上的AQPs进入生发层细胞而致使生发层细胞肿胀坏死,囊泡能在中间宿主体内长期存活、长大。单房棘球蚴常为单个囊,体积较大,囊壁生发层面积大,生发层细胞数量多,生发层细胞坏死液化后形成的水较多;而多房棘球蚴由无数个小囊泡相互连接聚集而成,囊泡体积小,单个囊泡生发层面积小,生发层细胞数量少,生发层细胞坏死液化后形成的水较少。这可能是单房棘球蚴的体积比泡球蚴大,囊液比泡球蚴多的原因之一。
综上所述,尽管细粒棘球绦虫和多房棘球绦虫基因组中总共有13个编码AQPs的基因,但本研究通过RT-PCR仅成功克隆了EgAQP4、EgAQP9、EmAQP4和EmAQP9四个基因,这四个AQPs基因在非洲爪蟾卵母细胞中不具有水通道的功能。跨膜结构域预测及多序列比对结果表明,与经典的水通道蛋白相比,EgAQP4和EmAQP4虽然N和C末端均位于胞质侧,但跨膜结构域数目为四个,NPA基序替换为NPM和NPT;而EgAQP9和EmAQP9虽然具有两个保守的NPA基序,但跨膜结构域数目为五个,N末端位于胞外侧、C末端位于胞质侧。本研究所扩增到的四个AQPs结构与经典水通道蛋白结构有所差异,可能是其在非洲爪蟾卵母细胞中未表现水通道蛋白的原因。该结果可能正好说明了囊内的水份不能通过AQPs进入生发层细胞而致使细胞肿胀坏死,囊液中的水份亦不能通过AQP的通道作用从生发层细胞流至囊外,囊液累积致使包囊或囊泡体积长大。本研究结果为科学的理解棘球蚴囊液的形成过程提供了理论依据,如果能寻找到有效激活AQPs基因的药物则可以为筛选治疗棘球蚴病药物靶点提供新思路。
(感谢清华大学的陶庆华教授和朱薛辰博士,在他们提供的实验室及技术指导下本研究的爪蟾卵母细胞内基因表达实验才得以顺利完成。感谢成都医学院王昕教授提供感染多房棘球绦虫的大鼠。感谢新疆医科大学的吕国栋教授对本实验提供的帮助。)
[1] Wang Q, Huang Y, Huang L, et al. Review of risk factors for human echinococcosis prevalence on the Qinghai-Tibet Plateau, China: a prospective for control options[J]. Infect Dis Poverty, 2014, 3(1): 3. DOI: 10.1186/2049-9957-3-3
[2] Sezgin O, Altintas E, Saritas U, et al. Hepatic alveolar echinococcosis: clinical and radiologic features and endoscopic management[J]. J Clin Gastroenterol, 2005, 39(2): 160-167. DOI:10.1097/01.mcg.0000150242.72499.22
[3] Hemphill A, Mueller J. Alveolar and cystic echinococcosis: towards novel chemotherapeutical treatment options[J]. J Helminthol, 2009, 83(2): 99-111. DOI: 10.1017/S0022149-X0928936X
[4] Kern P. Clinical features and treatment of alveolar echinococcosis[J]. Curr Opin Infect Dis, 2010, 23(5): 505-512. DOI: 10.1097/QCO.0b013e32833d7516
[5] 张宏伟, 彭心宇. 中西药联合阿苯达唑治疗棘球蚴病研究进展[J]. 中国病原生物学杂志, 2009, 4(9): 705-708.
[6] Reuter S, Jensen B, Buttenschoen K, et al. Benzimidazoles in the treatment of alveolar echinococcosis: a comparative study and review of the literature[J]. J Antimicrob Chemother, 2000, 46(3): 451-456. DOI: 10.1093/jac/46.3.451
[7] 余森海. 棘球蚴病防治研究的国际现状和对我们的启示[J]. 中国寄生虫学与寄生虫病杂志, 2008, 26(4): 241-244.
[8] 隋海心, 任罡. 水分子通道蛋白的结构与功能[J]. 化学进展, 2004, 16(2): 145-152.
[9] Abascal F, Irisarri L, Zardoya R. Diversity and evolution of membrane intrinsic proteins[J]. Biochim Biophys Acta, 2014, 1840(5): 1468-1481. DOI: 10.1016/j.bbagen.2013.12.001
[10] Wang Y, Tajkhorshid E. Molecular mechanisms of conduction and selectivity in aquaporin water channels[J]. J Nutr, 2007, 137(6 suppl 1): 1509-1515
[11] Ishibashi K. Aquaporin subfamily with unusual NPA boxes[J]. Biochim Biophys Acta, 2006, 1758(8): 989-993. DOI: 10.1016/j.bbamem.2006.02.024
[12] Gomes D, Agasse A, Thiebaud P, et al. Aquaporins are multifunctional water and solute transporters highly divergent in living organisms[J]. Biochim Biophys Acta, 2009, 1788(6): 1213-1228. DOI: 10.1016/j.bbamem.2009.03.009
[13] Beitz E. Aquaporin water and solute channels from malaria parasites and other pathogenic protozoa[J]. Chem Med Chem, 2006, 1(6): 587-592. DOI: 10.1002.cmdc.200500105
[14] Song J, Mak E, Wu BH, et al. Parasite aquaporins: Current developments in drug facilitation and resistance[J]. Biochim Biophysica Acta, 2014, 1840(5): 1566-1573. DOI: 10.1016/j.bbagen.2013.10.014
[15] Reisin IL, Pavisicdefal C. Membrane permeability of secondary hydatid cysts ofEchinococcusgranulosus. Determination of the water diffusional and osmotic permeability cofficients through a syncytial membrane[J]. Mol Biochem Parasitol, 1984, 12(1):101-116. DOI: 10.1016/0166-6851(84)90048-3
[16] Zheng HJ, Zhang WB, Zhang L, et al. The genome of the hydatid tapewormEchinococcusgranulosus[J]. Nat Genet, 2013, 45(10): 1168-1175. DOI: 10.1038/ng.2757
[17] Zhang RB, Verkman AS. Water and urea permeability properties ofXenopusoocytes: expression of mRNA from toad urinary bladder[J]. Am J Physiol, 1991, 260 (1): 26-34. DOI: 10.1152/ajpcell.1991.260.1.C26
[18] Torgerson PR, Keller K, Magnotta M, et al. The global burden of alveolar echinococcosis[J]. PLoS Negl Trop Dis, 2010, 4(6): e722-e722. DOI: 10.1371/journal.pntd.0000722
[19] 叶尔江·苏里唐, 江莉, 柴君杰. 我国棘球蚴病防治研究进展[J]. 中国寄生虫学与寄生虫病学杂志, 2000, 18 (13): 179-181.
[20] 温浩, 吐尔干艾力·阿吉, 邵英梅, 等. 棘球蚴病防治成就及面临的挑战[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33 (6): 466-471.
[21] 李红卫, 袁芳, 李燕兵, 等. 昆明种小鼠棘球蚴病感染动物模型的建立[J]. 宁夏医科大学学报, 2011, 33(5): 411-413.
[22] Geadkaew A, Bulow JV, Beitz E, et al. Bi-functionality ofOpisthorchisviverriniaquaporins[J]. Biochimie, 2015, 108: 149-159. DOI: 10.1016/j.biochi.2014.11.013
[23] Huang CG, Lamitina T, Agre P, et al. Functional analysis of the aquaporin gene family inCaenorhabditiselegans[J]. Am J Physiol Cell Physiol, 2007, 292 (5): C1867-C1873. DOI: 10.1152/ajpcell.00514.2006
[24] Geadkaew A, Von BJ, Beitz E, et al. Functional analysis of novel aquaporins fromFasciolagigantica[J]. Mol Biochem Parasitol, 2011, 175(2): 144-153. DOI: 10.1016/j.molbiopara.2010.10.010
[25] Figarella K, Uzcategui NL, Zhou Y, et al. Biochemical characterization ofLeishmaniamajor aquaglyceroporin LmAQP1: possible role in volume regulation and osmotaxis[J]. Mol Microbiol, 2007, 65(4): 1006-1017. DOI: 10.1111/j.1365-2958.2007.05845x
[26] Hedfalk K, Pettersson N, Oberg f, et al. Production, characterization and crystallization of thePlasmodiumfalciparumaquaporin[J]. Protein Expr Purif, 2008, 59(1): 69-78. DOI: 10.1016/j.pep.2008.01.004
