成人重症腺病毒肺炎临床研究
2018-06-21卓安山曹玉书段蕴铀韩志海
陈 韦,卓安山,曹玉书,段蕴铀,韩志海
一般认为,呼吸道腺病毒感染常见于婴幼儿[1-2],免疫功能正常的成人出现腺病毒呼吸道感染的几率较小,尤其重症感染的发生率较低[3]。但是,近年呼吸道腺病毒感染进展成肺炎甚至重症肺炎的病例逐渐增多,且有死亡病例出现。2014年华东地区某部发生7型腺病毒感染聚集性发病,通过分析其中24例重症腺病毒肺炎和42例轻症腺病毒肺炎患者的临床表现,总结诊治经验,报告如下。
1 资料和方法
1.1 研究对象 回顾分析2014年2—3月华东地区某部24例成人重症腺病毒肺炎和42例轻症腺病毒肺炎患者的临床、影像学特点以及药物治疗、随访情况,对比分析重症组和轻症组的咳嗽症状评分、影像学特征、生化指标、危重症评分、住院时间及并发症。所有患者均为男性,年龄17~45岁,均无慢性基础疾病。咽拭子和痰的病原学检查排除肺结核、细菌性肺炎。
1.2 重症腺病毒肺炎诊断标准 根据《腺病毒感染诊疗指南》,符合肺炎诊断标准,同时具有以下任何一项者诊断为重症腺病毒肺炎:①持续高热(体温>39 ℃)超过5 d,且伴有频繁而剧烈刺激性咳嗽;②心率>100/min和(或)呼吸频率>30/min;③影像学表现肺部阴影进展快速,累及范围超过1个肺叶;④动脉血氧分压(partial pressure of oxygen,PaO2)<70 mmHg,和(或)血氧饱和度<90%,鼻导管吸氧或面罩吸氧不能改善PaO2[4]。
1.3 咳嗽症状评估及危重症评分 咳嗽症状评估根据咳嗽症状积分表,分为0~3共4级(见表1)。

表1 咳嗽症状积分表
危重症评分采用国际通用的急性生理与慢性健康评分系统。
1.4 治疗方案 所有患者给予持续氧疗、补液、不同剂量糖皮质激素(甲基琥珀酸泼尼松龙,初始剂量80~1 000 mg/d)抗炎、利巴韦林抗病毒以及加用丙种球蛋白对症、支持和保护性治疗。
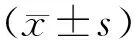
2 结果
2.1 2组患者临床特征 66例患者发病年龄(20.05±6.52)岁,均有发热,中高热为主,热峰38.8~41.2 ℃,多见稽留热、弛张热,其中持续发热时间<1周15例,1~2周36例,2~3周11例,3~4周2例,>4周2例。所有患者均伴有咳嗽,多为阵发性咳嗽,干咳为主,咳痰者常见白色粘痰,气短45例,喘息42例,呼吸困难14例,口唇或四肢远端紫绀24例,精神反应差15例,抽搐2例,咯血2例,腹泻12例,纳差48例,水肿6例,少尿6例,肺部湿啰音42例,干啰音30例,窦性心动过速40例。重症组与轻症组比较发热持续时间和热峰差异无统计学意义(P>0.05),住院时间、危重症评分、并发症种类、累及肺叶数比较差异有统计学意义(P<0.05)见表2。
2.2 2组患者并发症 呼吸衰竭28例,气胸5例,胸腔积液8例,肺不张8例,肝功能异常22例,心肌指标异常2例,急性肾功能异常3例,电解质紊乱38例。

表2 重症组与轻症组临床特征比较
注:与轻症组比较,*P<0.05
2.3 2组患者辅助检查结果
2.3.1 病原学检查 66例患者病毒检测RT-PCR结果均为7型腺病毒,且其余常见病毒抗原(流感A型病毒、流感B型病毒、呼吸道合胞病毒、鼻病毒、柯萨奇病毒)均为阴性,同时痰液抗酸染色、细菌、真菌培养和支原体、衣原体PCR也为阴性。
2.3.2 实验室检查 白细胞计数<4×109/L 22例,>10×109/L 15例;中性粒细胞百分比>65% 25例。C反应蛋白>8 mg/L 38例,PaO2(mmHg)/FIO2(%)<200 45例,其中PaO2(mmHg)/FIO2(%)<100 15例,PaO2<50 mmHg 24例,PaCO2>50 mmHg 18例,Lac>2 mmol/L 28例,低血钾25例,低血钠22例,酸碱失衡28例,丙氨酸氨基转移酶(alanine transaminase,ALT)>40 U/L 12例,门冬氨酸氨基转移酶(aspartate aminotransferase,AST)>40 U/L 15例,乳酸脱氢酶(lactate dehydrogenase,LDH)升高10例,白蛋白(albumin,ALB)降低12例,心肌酶升高4例,肌酐及尿素氮升高7例。重症组LDH、AST水平与轻症组比较显著升高(P<0.05),P/F比值、ALB、血小板数量重症组水平显著降低(P<0.05),其他指标无显著性差异,见表3。

表3 重症组与轻症组生化指标比较
注:与轻症组比较,*P<0.05
2.3.3 胸部CT表现 66名患者均行胸部CT检查,早期影像学CT可见沿支气管束分布的小斑片状渗出影。随病情进展,小斑片状阴影融合,表现为多发片状中等致密实变影,边缘模糊,多沿叶、段分布,其中CT表现以双肺病变为主的41例,右肺病变为主的8例,左肺病变为主的17例。实变影中可见支气管充气征18例,部分肺野呈毛玻璃影及索条影29例,节段性肺不张8例,气胸5例,纵隔气肿1例,皮下气肿1例,胸腔积液8例,胸膜增厚3例,伴有马赛克征象者12例(见图1)。
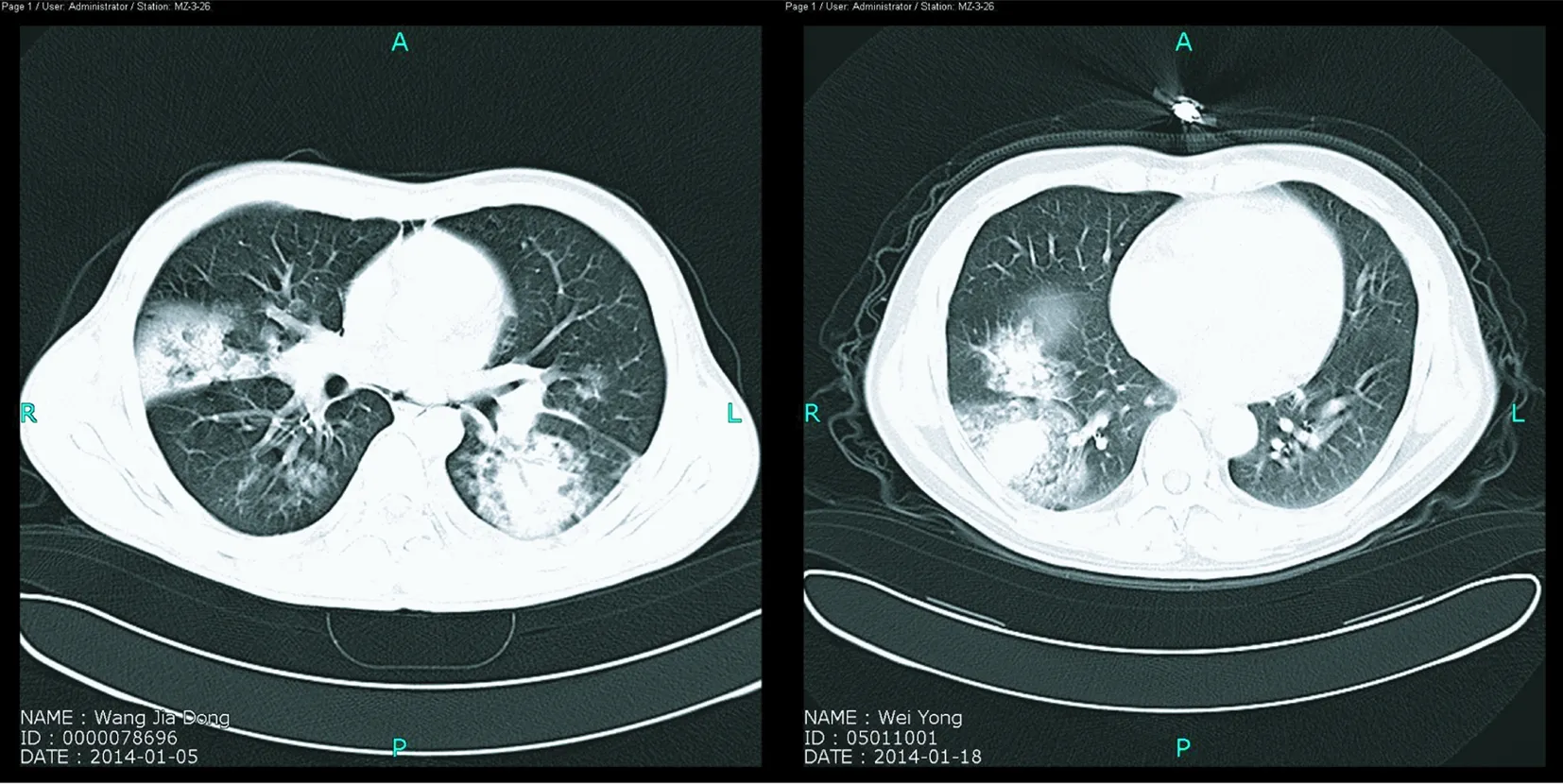
左图双肺多发片状中等致密实变影,内可见支气管充气征,沿支气管分布;右图右侧高密度实变,边缘模糊可见毛玻璃影
2.3.4 胸部CT表现与临床特征相关性 66例腺病毒肺炎胸部CT表现与临床特征相关性分析见表4。
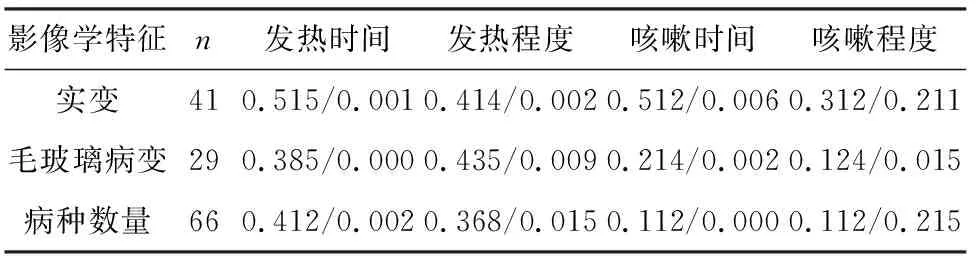
表4 66例患者CT影像学表现与临床特征相关性(r值/P值)
2.4 2组患者预后情况 66例患者全部治愈,住院时间(15.97±9.14)d。在1年内均定期复诊并复查CT,出现股骨头无菌性坏死12例,继发肺部慢性条索样病变6例,早期支气管扩张1例,可疑闭塞性细支气管炎1例。
3 讨论
腺病毒是从手术切除的扁桃体组织分离培养得到的一种DNA病毒。腺病毒常引起人呼吸道、胃肠道、眼睛和膀胱等部位感染,并可造成世界范围暴发流行,在大规模流行过程中病死率较高。各个年龄段人群均能被腺病毒感染,在免疫功能低下的患者常可引起严重甚至致死性感染。Berciauda等[5]报道腺病毒肺炎的好发年龄以2岁以下的婴幼儿为主。以往免疫功能正常的成人感染病例尤其重症感染鲜有报道[6]。本组病例均为免疫功能正常成人,经RT-PCR检测确诊为7型腺病毒感染,其中重症感染占36.36%,提示呼吸道腺病毒感染出现新的临床特征和趋势。
呼吸道腺病毒感染早期的临床表现缺乏特异性,多以发热、咳嗽、气促等症状起病,与其他呼吸道感染性疾病鉴别困难,需借助有效病原学检测方法[7]。本研究66例患者,腺病毒肺炎患者体温峰值较高,多在39~41 ℃,发热时程较长,1周以上达59例,占89.40%,以稽留热及弛张热为主,多伴有精神萎靡、乏力、纳差等表现,病情可在短期内迅速进展,临床出现明显的喘息、气短、紫绀、呼吸困难及干、湿啰音等呼吸系统症状体征,肺外并发症亦不罕见,影像学累及范围也可迅速扩展。尽早行病原学检测是早期诊断腺病毒肺炎的主要手段。
Guo等[8]提出,腺病毒肺炎的肺部影像学主要表现双肺实变影、斑片影及毛玻璃影像等。本研究发现,重症腺病毒肺炎以双肺多发节段实变影为主,实变以支气管束、肺亚段为中心,密度较高,边缘模糊,当病灶累及多个肺叶时实变范围可融合成片,内多可见支气管充气征,部分病例周围伴有间质损害甚至以间实质改变为主,也可伴有肺不张、气胸及胸腔积液,随病情加重逐渐出现肺部马赛克征象、远端通气比例失调、细支气管壁增厚及早期支气管扩张表现,治疗不及时或病情严重可进展为慢性肺病损害或闭塞性毛细支气管炎。相对于胸片,肺CT对评估肺间质改变、肺实变、胸腔积液、胸膜增厚等肺部损伤更细致[9],因此建议所有可疑腺病毒肺炎患者行胸部CT检查。
本研究发现,重症腺病毒肺炎患者出现的肺内并发症包括呼吸衰竭、胸腔积液、气胸、肺不张,肺外并发症包括电解质紊乱、脓毒症休克、心肌损害、肝功能损害、中毒性脑病等。呼吸道症状重,受累肺叶数及肺内外并发症种类数多的患者病情进展较快,较早出现脏器功能衰竭。重症组的LDH、AST水平比轻症组显著升高,重症组的血小板数量、血清ALB水平比轻症组显著降低。因此,推测早期的LDH、AST、血清ALB水平、血小板数量可能可以作为腺病毒肺炎预后的早期预测指标。重症肺炎通常因为肺部原发病灶导致全身炎性反应综合征或脓毒血症进而引起肺外脏器功能障碍[10]。本研究显示,重症组患者P/F比值显著低于轻症组,而肺叶受累数量显著高于轻症组,进一步观察,轻症组患者消化系统、循环系统、神经系统并发症随着病情控制逐渐恢复。因此,临床上要重视肺内病变严重、合并急性肺损伤及脓毒症的患者,此类患者常进展至严重脏器功能衰竭,而腺病毒肺炎其他的肺外系统并发症随着病情控制会逐渐恢复。
重症腺病毒肺炎病死率高,抗病毒方面无针对性治疗[11],有研究提示早期床旁持续血液净化治疗可能有助于改善病情[12]。另外丙种球蛋白能够中和抗体,调节免疫,促进疾病恢复,病情初期使用有一定疗效,推荐用量400 mg/(kg·d)连用3~5 d或1 g/(kg·d)连用2 d。关于糖皮质激素使用,目前仍存在争议,静脉短期使用大剂量糖皮质激素疗法对于改善中毒症状及减少肺部渗出有益,早期激素治疗可能能够阻断肺纤维化或闭塞性细支气管炎疾病的进程。Lai等[13]报道腺病毒肺炎病死率高达22%,生存者有23%遗留不同程度的后遗症,包括呼吸系统后遗症和神经系统后遗症。腺病毒肺炎常遗留的呼吸系统后遗症多见闭塞性细支气管炎、单侧透明肺、支气管扩张、间质纤维化等。本研究无死亡病例,考虑与所有患者免疫功能正常,以及早期大剂量应用糖皮质激素治疗相关。随访患者66例,股骨头无菌性坏死12例,无其他肺外系统后遗症,呼吸系统后遗症包括闭塞性细支气管炎1例,慢性肺部病变6例,早期支气管扩张1例,后遗症发生率为30.30%。重症腺病毒肺炎以及其药物治疗方案的后遗症发生率较高,影响患者生活质量,值得进一步关注。
腺病毒肺炎不同的CT影像学特征与临床表现具有相关性[14]。一般发病2~3 d后出现CT影像学改变,肺炎早期为斑片状病灶,大叶性实变常伴有严重发热和咳嗽症状,热程长。不同形态的病灶之间变化快,重症患者短期内病灶即可出现显著变化。影像变化的范围和程度与发热和咳嗽的程度有不同水平的相关性,反映了此类患者的影像异常和症状严重程度具有一定的一致性和同步性,也反映器质性病灶对发热和咳嗽2大呼吸系统主要症状影响的比重。咳嗽是腺病毒肺炎较为突出的症状,咳嗽评分同样与病灶大小、病灶性质正相关,也是反映病情的重要症状。相对于咳嗽症状,发热持续时间是反应CT病灶改变主要的相关因素,对病情判断更为重要。病灶数量与发热时间正相关,与发热、咳嗽程度之间相关性差,表明病灶数量随发热时间延长而增加,而早期的多发病灶并非病情严重的标志。毛玻璃影是病毒性肺炎较具特征性的影像征象,也是腺病毒肺炎病灶早期的表现之一,而叶段性的大片病灶见于新发病灶和重症患者病情进展阶段。以毛玻璃影为主的病例相对病程短,症状更重,毛玻璃影大小与发热程度正相关,如紧密随访可发现毛玻璃病变常迅速实变,提示毛玻璃病变反映病情严重程度,标志着肺部病变的进展。
目前,免疫功能正常的成人重症腺病毒肺炎的临床诊治仍处于经验积累的起步阶段,缺乏有效的治疗手段,经验性治疗方案例如床旁持续血液净化、大剂量糖皮质激素、免疫球蛋白等多数应用于疾病晚期[15],不可避免导致并发症或后遗症[16]。因此,重视疾病临床事件和临床变化趋势,建立量化的病情评估系统,有助于重症腺病毒病毒性肺炎的早期识别、早期治疗,对重症腺病毒肺炎的防治具有重要意义。
【参考文献】
[1]Nasreen S,Luby SP,Brooks WA,et al.Population-based incidence of severe acute respiratory virus infections among children aged <5 years in rural Bangladesh, June-October 2010[J].PLoS One,2014,9(2):e89978.
[2]郑申健,胡俊,汪珍珍,等.重度腺病毒肺炎患儿预后不良相关危险因素[J].中国感染控制杂志,2016,15(8):587-591.
[3]Khan S,Keller S,Sritharan N,et al.A rare case of adenovirus pneumonia resulting in severe ARDS in an immunocompetent adult[J].Chest,2016,150(4):432A.
[4]全军传染病专业委员会、新突发传染病中西医临床救治课题组.腺病毒感染诊疗指南[J].解放军医学杂志,2013,38(7):529-534.
[5]Berciauda S,Raynec F,Kassabb S,et al.Adenovirus infections in Bordeaux University Hospital 2008-2010:clinical and viro-logical features[J].J Clin Virol,2012,54(4):302-307.
[6]Romero-Gómez MP,López López R,González Montes R,et al.Immunochromatographic test for detection of adenovirus from respiratory samples:is it a real solution for pediatric emergency department?[J].J Virol Methods,2014,195:236-239.
[7]Tsou TP,Tan BF,Chang HY,et al.Community outbreak of adenovirus,Taiwan,2011[J].Emerg Infect Dis,2012,18(11):1825-1832.
[8]Guo W,Wang J,Sheng M,et al.Radiological findings in 210 paediatric patients with viral pneumonia:a retrospective case study[J].Br J Radiol,2012,85(1018):1385-1389.
[9]Tan XQ,Zhao X,Lee VJ,et al.Respiratory viral pathogens among Singapore military servicemen 2009-2012:epidemiology and clinical characteristics[J].BMC Infect Dis,2014,14:204.
[10]Dia N,Richard V,Kiori D,et al.Respiratory viruses associated with patients older than 50 years presenting with ILI in Senegal, 2009 to 2011[J].BMC Infect Dis,2014,14:189.
[11]Lu QB,Tong YG,Wo Y,et al.Epidemiology of human adenovirus and molecular characterization of human adenovirus 55 in China,2009-2012[J].Influenza Other Respir Viruses,2014,8(3):302-308.
[12]黄晗,卢红霞,宋春兰.IVIG治疗儿童重症腺病毒肺炎的临床疗效和并发症观察[J].临床肺科杂志,2016,21(2):271-273.
[13]Lai CY,Lee CJ,Lu CY,et al.Adenovirus serotype 3 and 7 infection with acute respiratory failure in children in Taiwan,2010-2011[J].PLoS One,2013,8(1):e53614.
[14]Demian PN,Horton KC,Kajon A,et al.Molecular identification of adenoviruses associated with respiratory infection in Egypt from 2003 to 2010[J].BMC Infect Dis,2014,14:50.
[15]Capasso C,Garofalo M,Hirvinen M,et al.The evolution of adenoviral vectors through genetic and chemical surface modifications[J].Viruses,2014,6(2):832-855.
[16]Wurzel DF,Mackay IM,Marchant JM,et al.Adenovirus species C is associated with chronic suppurative lung diseases in children[J].Clin Infect Dis,2014,59(1):34-40.
