血清NY-ESO-1自身抗体在乳腺癌中的诊断价值
2018-06-21谢长乐罗育豪黄旭纯许镒洧
谢长乐,罗育豪,黄旭纯,许镒洧
世界范围内,乳腺癌是女性最常见的恶性肿瘤,由于恶性程度高、肿瘤增殖迅速等原因,乳腺癌的死亡率仍然居高不下,而且乳腺癌的发病年龄有年轻化的趋势[1]。传统的乳腺癌检查方法,包括乳房X线检查、超声、磁共振等,用于早期筛查乳腺癌并不十分有效[2-3]。例如,乳房X线检查有很高的假阳性结果,并且在一些女性群体的诊断敏感度不够高[4]。当前,我们迫切需要寻找新的乳腺癌生物标志物,可以更加简单、有效、非侵入性地发现早期乳腺癌。NY-ESO-1是癌-睾丸抗原(cancer-testis antigen,CTA)亚家族之一,本研究分析了NY-ESO-1自身抗体在乳腺癌患者血清中的水平,评价其作为乳腺癌早期诊断分子标志物的可行性。
1 资料与方法
1.1 一般资料 收集2012年10月—2013年6月汕头大学医学院附属肿瘤医院乳腺癌患者125例和乳腺良性肿瘤患者33例。入组条件:未接受任何抗癌治疗,并经过组织病理学检查确诊。125例乳腺癌患者均为女性,年龄40~72岁,中位年龄51岁。33例乳腺良性肿瘤患者均为女性,年龄31~68岁,中位年龄46岁。正常对照为116例年龄与乳腺癌组匹配的女性体检者并被证实为无任何肿瘤疾患,年龄41~70岁,中位年龄50岁。所有受试者空腹静脉采血3 mL,1 250×g离心10 min,分离血清并于-80 ℃保存备用。本研究经汕头大学医学院附属肿瘤医院伦理委员会批准,患者知情同意。
1.2 主要仪器和试剂 酶标仪(美国赛默飞公司),96孔酶标板(江苏海门浩天生物器材厂),NY-ESO-1重组蛋白和兔抗NY-ESO-1多克隆抗体(舟山同生生物科技公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗人IgG或羊抗兔IgG(美国Santa Cruz公司),3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)(厦门英科新创公司)。
1.3 NY-ESO-1自身抗体的检测 采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测乳腺癌患者、乳腺良性肿瘤患者和正常对照者血清中NY-ESO-1自身抗体。将NY-ESO-1重组蛋白用磷酸盐缓冲液(phosphate buffer saline,PBS)稀释到终浓度0.1 μg/mL,包被96孔板4 ℃过夜。弃去孔内溶液,用含吐温-20的PBS(PBST)洗板3次。每孔加入200 μL封闭液(PBST+1%牛血清白蛋白),37 ℃孵育1 h,弃去孔内溶液,用PBST洗板3次。加入1∶110稀释的血清样品和质控样品(取自50例乳腺癌患者的混合血清),封闭液作为阴性对照,兔抗NY-ESO-1多克隆抗体作为阳性对照,每孔100 μL,每个样本、阴性对照和阳性对照均做2平行孔,37 ℃孵育1 h,弃去孔内溶液,用PBST洗板3次;加入1∶10 000稀释的HRP羊抗人IgG或羊抗兔IgG,37 ℃孵育1 h,弃去孔内溶液,用PBST洗板5次;每孔加入TMB-过氧化氢显色液100 μL,置于37 ℃避光显色15 min;加入终止液50 μL,酶标仪以测定波长为450 nm,校正波长为630 nm时检测各样品的A值(即A450 nm~A630 nm)。116例正常对照血清光密度(optical density,OD)值的均数加上2个标准差为判断临界值(Cut-off值),大于等于此值为阳性,小于此值为阴性。
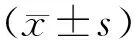
2 结果
2.1 乳腺癌患者、乳腺良性肿瘤患者和健康体检者血清NY-ESO-1自身抗体的水平 与正常对照组(0.092±0.067)相比,血清NY-ESO-1自身抗体的平均滴度水平在乳腺癌组(0.223±0.217)和乳腺良性肿瘤组(0.132±0.080)均显著升高,差异有统计学意义(Z=-6.842,P<0.0001;Z=-2.791,P=0.005,图1)。乳腺癌组患者血清NY-ESO-1自身抗体的平均滴度高于乳腺良性肿瘤组,差异有统计学意义(Z=-2.284,P=0.022,图1)。
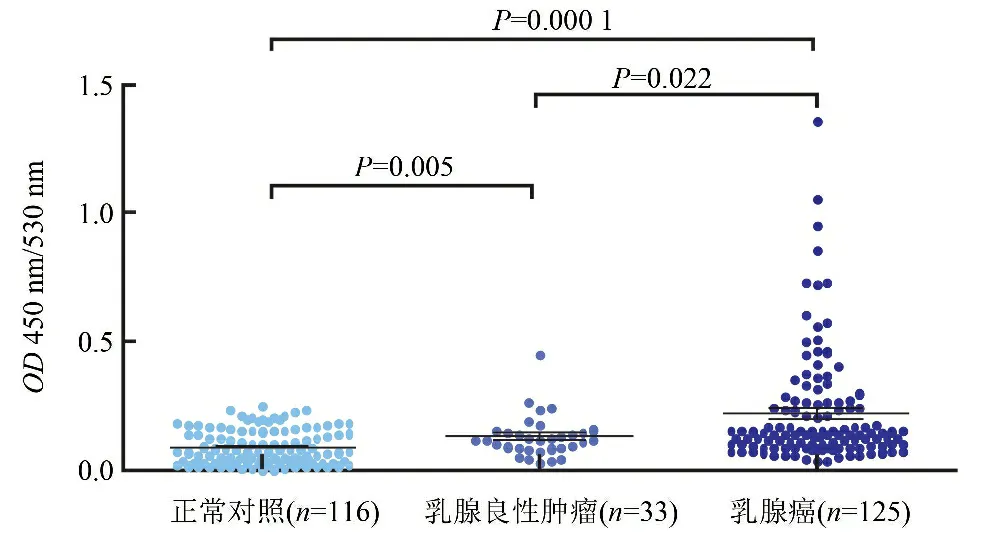
图1 NY-ESO-1自身抗体在正常对照、乳腺良性肿瘤和乳腺癌患者血清中的水平
2.2 NY-ESO-1自身抗体检测乳腺癌的诊断价值 ROC曲线分析显示,与健康体检者比较,NY-ESO-1自身抗体对乳腺癌的诊断AUC值为0.575(95%置信区间:0.695~0.816)。根据Cut-off值的判断标准,NY-ESO-1自身抗体对乳腺癌的诊断Cut-off值为0.226。此时,检测NY-ESO-1自身抗体的敏感度为31.2%,特异度为96.6%。当以相同Cut-off值时,NY-ESO-1自身抗体区分乳腺癌和乳腺良性肿瘤的AUC值为0.629(95%置信区间:0.531~0.728),敏感度为31.2%,特异度为87.9%。图2。
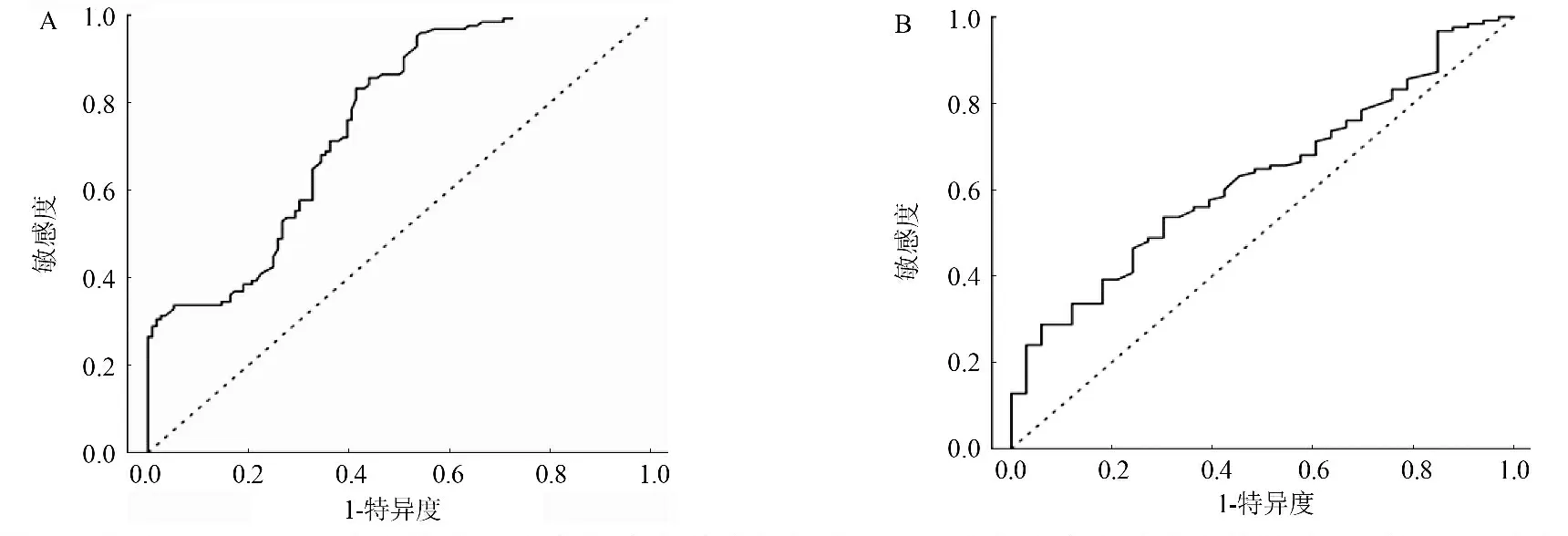
图2 血清NY-ESO-1自身抗体区分乳腺癌和健康体检者(A)以及乳腺癌和乳腺良性肿瘤(B)的ROC曲线
3 讨论
利用血清学检测发现早期乳腺癌具有简单、方便等优势,但是临床上常用肿瘤标志物指标,如CA153、癌胚抗原等,其灵敏度和特异度均低。因此发现新的高灵敏度、高特异度的血清学筛查指标具有重要的临床意义。近年来的研究表明,针对肿瘤相关抗原的自身抗体是非常有前景的肿瘤早期诊断分子标志物,其在血液中稳定、检测方便,并且在肿瘤早期阶段、甚至是在没有临床症状的癌前病变阶段就可以被检测出。如今,通过各种检测技术,包括重组克隆表达抗原的血清学鉴定、血清蛋白质组分析技术、噬菌体展示技术、蛋白芯片等,至少2 000种以上的肿瘤自身抗体被鉴定[5]。多种自身抗体标志物被证实与乳腺癌早期检测存在相关性,其中研究最广泛的是针对p53、c-myc、Her2、Muc1和survivin等的自身抗体[6]。然而,由于这些乳腺癌自身抗体或自身抗体组合并没有足够的敏感度和特异度,因此没能进一步在临床上应用。由此可见,寻找更具代表性、高敏感度和特异度的乳腺癌自身抗体是十分重要的。
CTA作为一组肿瘤抗原,通常只在人类生殖细胞中有表达,但也被证实在多种肿瘤中有表达。CTA已被证实为多种恶性肿瘤的潜在诊断标记和治疗靶点[7]。作为最主要的CTA,NY-ESO-1最初是在针对食管癌的重组克隆表达抗原血清学鉴定中被发现的。在表达NY-ESO-1的肿瘤患者,NY-ESO-1能够引起体液和细胞免疫反应[8]。研究表明,大约10%~50%的肿瘤患者中NY-ESO-1能够诱导产生自身抗体反应[9-10]。我们先前的研究表明,NY-ESO-1自身抗体在食管癌和鼻咽癌患者血清中水平升高[11-13],提示NY-ESO-1自身抗体可能在多种肿瘤患者血清中高表达。Chapman等[14]研究发现,NY-ESO-1自身抗体诊断乳腺癌的敏感度为26%,特异度为94%。Oshima等[15]检测了365例乳腺癌和74例正常对照者血清中NY-ESO-1自身抗体的水平,结果发现NY-ESO-1自身抗体在乳腺癌患者血清中水平升高。本研究中,我们采用ELISA试验检测了125例乳腺癌患者、33例乳腺良性肿瘤患者和116例健康体检者血清中NY-ESO-1自身抗体,结果发现NY-ESO-1自身抗体不仅可以区分乳腺癌和健康体检者,还能够区分良恶性乳腺肿瘤,研究结果与其他学者的结果较一致,进一步证实了NY-ESO-1自身抗体对乳腺癌具有一定的诊断价值。
总之,本研究发现NY-ESO-1自身抗体在乳腺癌的诊断中具有较好的价值,而且具有无创、无放射风险,如果联合其他自身抗体,进一步提高敏感度,无疑将具有临床推广的可能性。考虑到研究样本量小以及缺乏多中心验证等不足之处,今后仍需进行高质量的病例对照研究,以进一步证实NY-ESO-1自身抗体在早期诊断乳腺癌中的作用。
【参考文献】
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Bleyer A,Welch HG.Effect of three decades of screening mammography on breast-cancer incidence[J].N Engl J Med,2012,367(21):1998-2005.
[3]Smetherman DH.Screening, imaging,and image-guided biopsy techniques for breast cancer[J].Surg Clin North Am,2013,93(2):309-327.
[4]Coolen A,Leunen K,Menten J,et al.False-negative tests in breast cancer management[J].Neth J Med,2011,69(7):324-329.
[5]Macdonald IK,Parsy-Kowalska CB,Chapman CJ.Autoantibodies:opportunities for early cancer detection[J].Trends Cancer,2017,3(3):198-213.
[6]Piura E,Piura B.Autoantibodies to tailor-made panels of tumor-associated antigens in breast carcinoma[J].J Oncol,2011,2011:982425.
[7]Robbins PF,Morgan RA,Feldman SA,et al.Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reac-tive with NY-ESO-1[J].J Clin Oncol,2011,29(7):917-924.
[8]Jäger E,Nagata Y,Gnjatic S,et al.Monitoring CD8 T cell responses to NY-ESO-1:correlation of humoral and cellular immune responses[J].Proc Natl Acad Sci USA,2000,97(9):4760-4765.
[9]Gnjatic S,Nishikawa H,Jungbluth AA,et al.NY-ESO-1:review of an immunogenic tumor antigen[J].Adv Cancer Res,2006,95:1-30.
[10]Yang J,Jiao S,Kang J,et al.Application of serum NY-ESO-1 antibody assay for early SCLC diagnosis[J].Int J Clin Exp Pathol,2015,8(11):14959-14964.
[11]Xu YW,Peng YH,Chen B,et al.Autoantibodies as potential biomarkers for the early detection of esophageal squamous cell carcinoma[J].Am J Gastroenterol,2014,109(1):36-45.
[12]Peng YH,Xu YW,Huang LS,et al.Autoantibody signatures combined with epstein-barr virus capsid antigen-IgA as a biomarker panel for the detection of nasopharyngeal carcinoma[J].Cancer Prev Res (Phila),2015,8(8):729-736.
[13]Peng YH,Xu YW,Qiu SQ,et al.Combination of autoantibodies against NY-ESO-1 and viral capsid antigen immunoglobulin A for improved detection of nasopharyngeal carcinoma[J].Oncol Lett,2014,8(3):1096-1102.
[14]Chapman C,Murray A,Chakrabarti J,et al.Autoantibodies in breast cancer:their use as an aid to early diagnosis[J].Ann Oncol,2007,18(5):868-873.
[15]Oshima Y,Shimada H,Yajima S,et al.NY-ESO-1 autoantibody as a tumor-specific biomarker for esophageal cancer:screening in 1969 patients with various cancers[J].J Gastroenterol,2016,51(1):30-34.
