茶叶中挥发性成分对映异构体研究进展
2018-06-19吕海鹏
穆 兵,吕海鹏,朱 荫,*,林 智,*
(1.中国农业科学院茶叶研究所,农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081)
茶叶作为世界上三大无酒精饮料之一,因其具有芬芳馥郁的香气,含有茶多酚、氨基酸等营养物质,并具有抗氧化、防辐射、抗菌及防癌等多种保健功能,受到了各国人民的广泛喜爱。茶叶香气也称为挥发性香气组分,在茶叶中的绝对含量很少,一般只占干物质质量的0.01%~0.05%[1],却对成品茶的香气品质有着巨大的影响,是茶叶感官评价中重要的指标之一。茶叶香气由多种复杂的挥发性化合物构成,不同种类和数量的化合物构成了茶叶的不同香型,其中许多重要挥发性成分都含有立体中心,存在镜面对称而香气特性迥异的对映异构体。挥发性化合物的对映异构体的组成比例及含量在不同食品及植物中的挥发性成分中有很大的差异,甚至同一类食品或植物的不同品种来源、加工方式也会对化合物的立体构型比例产生巨大影响。如研究表明芳樟醇、芳樟醇氧化物及茉莉酸甲酯等手性挥发性成分在不同种类、品种的茶叶中对映异构体比例及含量差异显著[2-3];Wong等[4]对澳洲白千层精油中萜烯类化合物对映异构体分布的研究表明,产于澳洲本土的白千层精油两种特征挥发性成分α-松油醇和4-萜品醇的对映异构体组成具有高度一致性,其比例分别为(68.5±0.2)%(+)∶(31.5±0.2)%(-)和(74.2±1.4)%(+)∶(25.8±1.4)%(-),而非澳洲产地的样品则不具备此特征。根据以上特性,挥发性化合物的对映异构体分析已被成功应用于植物或食品的产地溯源、风味食品的真伪辨析等方面。本文总结了近年来国内外关于茶叶、植物或食品中挥发性成分对映异构体的研究,对手性挥发性成分研究采用的分析方法进行综述,并展望了今后茶叶中挥发性手性化合物对映异构体的研究趋势及应用前景。
1 茶叶中常见的重要挥发性成分对映异构体
茶叶香气是衡量茶叶品质的重要因素,一直以来都是茶叶化学领域的研究重点。茶叶香气由成百上千种挥发性化合物构成,其组成和含量在不同茶类中有明显差异。迄今为止,已经从各种茶类中分离鉴定出700多种香气物质[5],主要包括醇类、醛类、酮类、酯类、酸类、酚类、杂环化合物等十余类化合物[6]。其中从绿茶中鉴定出来的香气成分有300多种[7],而红茶和乌龙茶中鉴定出来的香气成分达到了400 种以上[8]。
从主要碳链和母核来看,茶叶中挥发性成分基本组成可以分为脂肪类衍生物、芳香类衍生物、萜类衍生物及含氮、氧、硫化合物[9-10]。其中单萜、倍半萜及酯类化合物等挥发性成分往往具有较低的香气阈值和宜人的香气,对成茶香气品质产生重要的影响[11-12],如在多数茶叶中具有最高含量的芳樟醇、芳樟醇氧化物、香茅醇、橙花叔醇、α-紫罗兰酮、α-松油醇、α-柠檬烯、水芹烯、4-萜品醇及茉莉酸甲酯等(图1)。
这些常见的挥发性化合物都具有1 个或多个立体中心,存在镜面对称的对映异构体,也称为手性化合物。手性化合物的对映异构体之间有许多相同的理化性质,如熔点、溶解度等;但在旋光性、气味特征等性质上有着极大的差异[13]。已有研究表明,手性挥发性成分的不同立体构型具有不同的香气特征,甚至香气阈值也不同:如S-(+)-芳樟醇具有甜香、花香以及类似橙叶的香气特征,香气阈值为7.4 μg/kg[14],R-(-)-芳樟醇具有木香和类似薰衣草的香气特征,香气阈值为0.8 μg/kg[15];左旋香茅醇具有幽雅玫瑰香,而右旋香茅醇具有甜玫瑰香[16];S-(-)α-紫罗兰酮具有类似木材的香气,阈值为20~40 μg/kg,R-(+)-α-紫罗兰酮具有紫罗兰芬芳,阈值为0.5~5.0 μg/kg,而它们的消旋体则具有强烈的甜花香气味[17];S-(+)-柠檬烯呈现柠檬香气,而R-(+)-柠檬烯则具有松脂气味[18]。由此可见,挥发性化合物的立体构型对香气品质的影响很大,它们不同组成比例引发的致香效果也有所差异,而且这种差异极可能在较大程度上对茶叶香气的形成产生影响。然而,由于茶叶香气的对映异构体研究仍处于初步阶段,目前对映异构体比例对茶叶香气的具体影响鲜有系统文献报道。
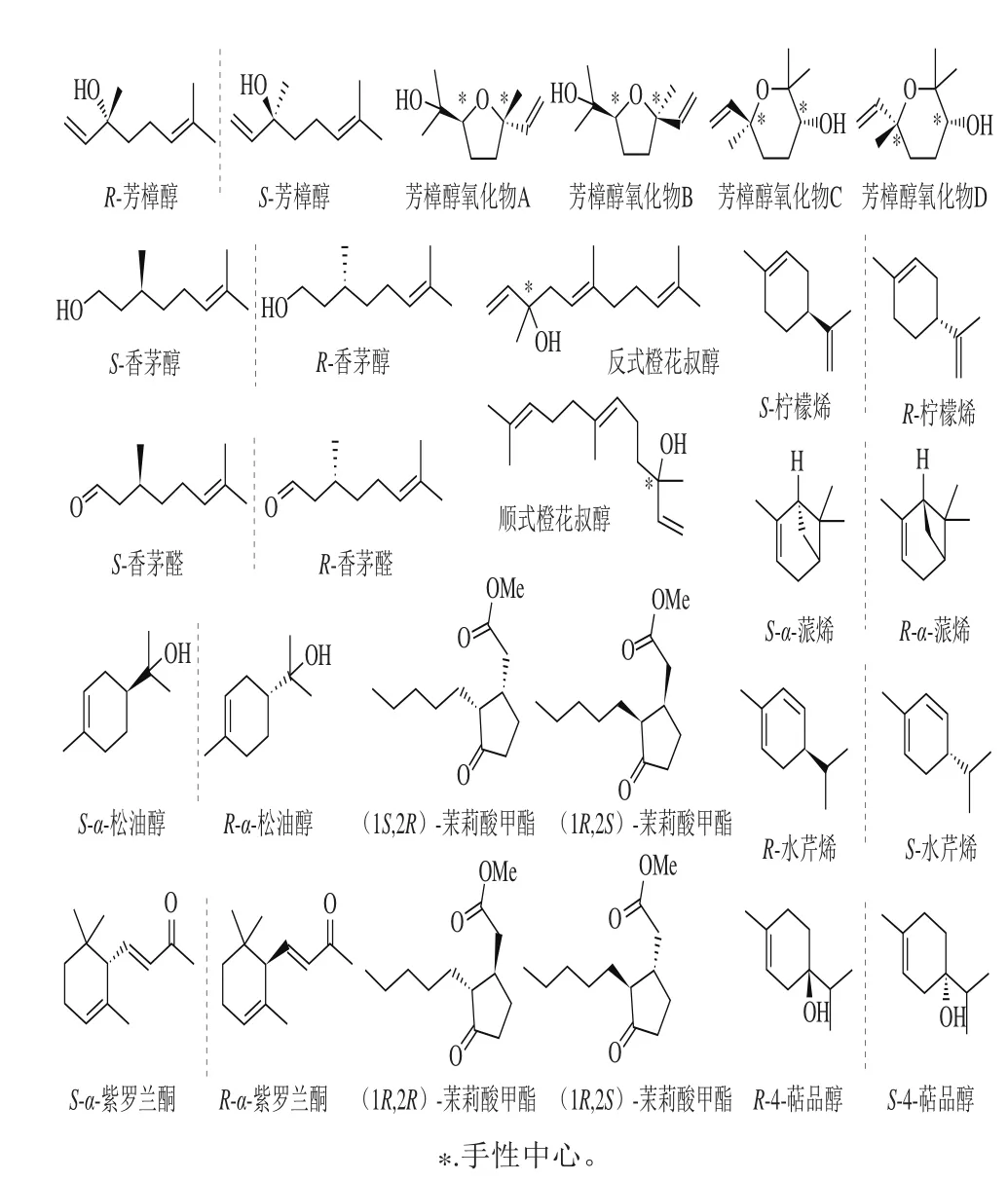
图1 茶叶中部分挥发性成分的对映异构体Fig. 1 Enantiomers of some volatile components in tea
2 挥发性成分对映异构体研究现状
2.1 茶叶中挥发性成分的对映异构体研究进展
以往科研工作者对茶叶香气进行了大量的研究,研究内容主要集中在茶叶中挥发性化合物形成机理、影响因素[19]和挥发性化合物的顺反结构上,如具有青草香气的顺-3-己烯醇,又称青叶醇,在茶叶加工过程中由于沸点较低而挥发至痕量,同时由于异构化作用,形成具有清香的反式青叶醇,使鲜叶的气味转化为茶叶的清香[8,20]。然而,有关茶叶中挥发性化合物更深层次的对映结构研究还鲜有报道,究其原因,一方面茶叶中挥发性化合物繁多复杂,性质各异,与手性固定相的作用效果也各不相同,很难在一个色谱体系内将众多手性化合物分离;另一方面,茶叶中其他挥发性化合物的含量相对较低,有些甚至无法达到检测限,影响了分析效果。因此,茶叶中挥发性化合物的对映异构体研究具有一定的挑战性,亟需有效的手性分析方法来实现茶叶中多种香气化合物的对映异构体分离,从而为更深层次研究挥发性成分各对映异构体比例及含量对茶叶香气品质的具体影响提供技术支撑。
Wang Dongmei等[21]采用手性气相色谱技术首次将乌龙茶和红茶香气成分中的芳樟醇及芳樟醇氧化物的对映异构体分离,分析结果表明不同茶样相应的对映异构体过量(enantiomeric excess,ee)值存在较大差异,甚至主导的立体构型也不相同:取自中国的乌龙茶样品黄金桂和铁观音的ee值分别为45.2%和52.6%,说明其香气中芳樟醇的主要存在形式为S-(+)-芳樟醇;取自斯里兰卡的红茶样品Clone 2025和Clone DT-1的ee值分别为-19.8%和-6.4%,说明其香气中芳樟醇的主要存在形式为R-(-)-芳樟醇。1996年,该研究组又成功分离了乌龙茶中茉莉酸甲酯的两对对映异构体[3],研究表明黄金桂与铁观音茶样中同时存在顺式及反式茉莉酸甲酯,但均仅检测到两对对映异构体中的单一构型:(1R,2S)-及(1R,2R)-茉莉酸甲酯。
Kuroda等[22]调查了茉莉花茶的气味对神经活动和情绪状态的影响,研究发现,茉莉花茶中提取出来的主要香气成分芳樟醇,同时存在R/S两种不同的立体构型,且在相同的浓度下,R-(-)-芳樟醇能促使心率显著降低,有助于消除消极情绪(缓解紧张焦虑、沮丧、愤怒敌意等),同时提高积极情绪状态;而S-(+)-芳樟醇相比之下则产生相反的作用,增加负面消极情绪并降低积极情绪状态。
2015年,本研究组杨停等[23]在研究工作中成功采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-气相色谱法(gas chromatography,GC)检测出了不同类别、品种及处理方式的茶叶中芳樟醇对映异构体间的比例关系。分析结果显示仅红茶及部分绿茶中含有R-(-)-芳樟醇,大部分茶叶中仅存在S-(+)-芳樟醇。定量结果表明,在绿茶、红茶、白茶、乌龙茶和黑茶五大茶类中,白茶芳樟醇的含量最高,黑茶最低;同时,还研究了14 个茶树品种(龙井43、黄观音、悦茗香、宁州2号、福云6号、政和大白、毛蟹、鄂茶1号、槠叶齐、尖波黄、锡茶5号、高芽齐、凫早2号、皖农95)中芳樟醇手性异构体的比例及含量,结果表明仅悦茗香、宁州2号、槠叶齐、高芽齐和皖农95 5 个品种的茶鲜叶中存在R-(-)-型芳樟醇,且所有品种的茶鲜叶在加工后芳樟醇的含量均大幅度降低;研究了‘英红九号’茶树品种在加工过程中芳樟醇含量的变化规律[24],发现R、S-芳樟醇的含量变化趋势基本一致,即在鲜叶到揉捻过程中含量逐渐上升,发酵后急剧降低,干燥后含量轻微有所回升,推测可能与糖苷酶水解及芳樟醇的挥发特性有关。
邵晨阳[25]、Zhu Yin[26]等采用HS-SPME/手性气相色谱-质谱联用技术(enantioselective GC-mass spectrometry,Es-GC-MS)首次建立了茶叶中12 种重要挥发性萜类化合物(α-蒎烯、柠檬烯、芳樟醇、芳樟醇氧化物A~D、4-萜品醇、α-松油醇、α-紫罗兰酮及茶螺烷A~B)对映异构体的精确定量分析方法,检测出了它们在国内外代表性绿茶、红茶、乌龙茶、白茶及黑茶中的相应对映异构体比例及含量。研究表明,S-柠檬烯、S-芳樟醇、(2S,5S)-芳樟醇氧化物A、(2S,5R)-芳樟醇氧化物B、R-4-萜品醇、(2S,5R)-芳樟醇氧化物C、(2S,5S)-芳樟醇氧化物D、S-α-松油醇及R-α-紫罗兰酮为大部分茶样中相应萜类化合物的主导构型,而部分茶样(如印尼白茶、大叶种红茶)中的挥发性萜类化合物有迥异的立体构型分布特征。此外,多元统计分析结果表明,大叶种和小叶种红茶中萜类化合物对映异构体的含量存在显著性差异,且通过建立偏最小二乘法判别分析模型可分别对绿茶、白茶及黑茶进行良好的聚类。
2.2 茶叶中挥发性成分对映异构体在其他食品中的研究进展
相比之下,茶叶中挥发性成分的手性分析在植物香气[15,27-28]及食品香气化学[29-32]领域已经得到了广泛研究并取得了突飞猛进的进展。Cagliero等[33]建立了一种快速全分析系统,通过HS-SPME/Es-GC-MS结合主成分及多层聚类分析2 种多元统计分析法检测了α-紫罗兰酮、芳樟醇、橙花叔醇、2-甲基丁酸乙酯、2-甲基丁酸和γ-内酯在草莓味食品及饮料中的对映异构体分布情况,研究结果表明该系统在食品及饮料的真伪鉴别上有着广阔的应用前景。Bisht等[34]利用Es-GC技术研究了从印度天然牛至中分离得到的精油的化学组成,发现化合物主要可以分为两类:一是属于百里酚/香芹生物合成途径主导的化合物,二是以萜烯为主导的化合物,如具有高含量的芳樟醇和乙酸冰片酯。其中,R-(-)-芳樟醇和S-(+)-芳樟醇、R-(-)-4-萜品醇和S-(+)-4-萜品醇、R-(-)-α-萜品醇和S-(+)-α-萜品醇等化合物的对映异构体比例在所有样本中具有高度的一致性,可被应用于印度牛至的真伪判定以及产地溯源等方面。Barba等[35]利用HS-SPME与中心切割多维气相色谱技术(multidimensional GC,MDGC)测定了市场购买的3 种不同白葡萄酒中2,3-丁二醇和芳樟醇的ee值,发现2,3-丁二醇的立体异构分布在样品之间没有差异,均为100%;芳樟醇的对映体形式则以不同的比例存在,3 种酒分别为47%、100%和78%,以R-(-)-芳樟醇为主。Bonnländer等[36]采用同时蒸馏萃取法及搅拌棒吸附萃取法对生咖啡和焙烘后的咖啡香气中的手性化合物进行分析,发现后处理方式对芳樟醇的对映异构体比例的影响显著,即冲泡后的咖啡香气中的芳樟醇几乎为消旋体,而干燥处理后的咖啡香气中以S-芳樟醇为主。Luan Fang等[37]通过MDGC技术对葡萄浆果中芳樟醇、呋喃型及吡喃芳樟醇氧化物、脱氢芳樟醇、香茅醇等代谢产物的立体构型进行分析;研究结果显示,呋喃芳樟醇氧化物分别是通过芳樟醇氧化物糖苷前体的水解反应以及芳樟醇的氧化、重排反应两个不同的反应途径产生;此外,还发现了脱氢芳樟醇氧化物在葡萄浆果中的主要立体构型是3S型。
α-紫罗兰酮由于其独特的芳香属性[38]早在20世纪60年代就引起了食品界研究者们的广泛关注,在覆盆子[39]、红茶[40]、紫罗兰花[41]、胡萝卜[42]的香气成分中均鉴定出R-α-紫罗兰酮;另外,在唇形科植物精油[43]、豆蔻精油[44]、柑橘精油[45-46]、水果味食物精油[33]、白棘枝[47]等中可检测到芳樟醇、α-紫罗兰酮、萜品醇、α-蒎烯、α-柠檬烯、水芹烯、4-萜品醇、α-二去氢菖蒲烯等挥发性成分的对映异构体。
值得关注的是,大量研究表明,食品或植物的类别、品种及产地等对挥发性成分对映异构体的比例及含量的影响十分显著,甚至主导的立体构型也可能截然相反。根据以上特性,挥发性成分的对映异构体分析技术已被初步应用于植物的产地判别、风味食品的真伪辨析及常规认证上。Špánik等[48]将手性挥发性成分对映异构体的比例应用于蜂蜜溯源上,指出手性对映异构体比例的不同与蜂蜜的植物学产地有关:芳樟醇对映体可以用来鉴别油菜蜜和其他蜜;丁香醛可以用来鉴定橙花蜜与洋槐蜜;4-萜品醇可以用来鉴别葵花蜜。Verzera等[49]通过大量实验对不同储藏条件下不同产地的橙花蜜中芳樟醇及其氧化物的对映体的比例进行了测定,结果表明即使橙花蜜中大部分挥发性成分出现大范围的变化时,芳樟醇及其氧化物的对映异构体比例依然保持稳定,其受生产周期、条件作用、包装、储存等影响很小。由于蜂蜜挥发性成分的对映体分布直接来自花朵,根据上述特性,可将芳樟醇及芳樟醇氧化物的比例运用于快速鉴别花卉真实性来源。Pažitná等[50]在研究杜松酒时发现了260多种挥发性化合物,其中芳樟醇、α-萜品醇、4-松油醇、芳樟醇氧化物、α-蒎烯和马鞭草烯酮等对映异构体得到了手性分离,由于不同产地的杜松酒在芳樟醇和芳樟醇氧化物对映异构体的比例上存在显著差异(如斯洛伐克和英国之间),因此可作为产地鉴别的关键参数。Mosandl[51]将手性毛细管GC和在线同位素比值MS法运用于风味食品和精油成分的质量认证上,取得了良好的效果。
3 挥发性成分对映异构体分析方法研究进展
目前挥发性成分对映异构体的分析主要采用GC技术,主流的GC方法包括:GC-MS、MDGC、全二维GC技术(GC×GC)3 种。
3.1 GC-MS技术
GC-MS是一种高效的分离、分析技术,在工业、农业、国防、科学研究中都有广泛应用。由于采用气体作为流动相,样品在气相中传递速度快,因此样品组分在流动相和固定相之间可以瞬间达到平衡。且可选作固定相的物质很多,因此GC法是一个分析速度快、分离效率高的分离分析方法。近年来采用高灵敏选择性检测器,使得它又具有分析灵敏度高、应用范围广等优点。手性GC-MS分析法采用具有手性固定相(通常为改性环糊精衍生物)的毛细管气相色谱柱[52-53],在操作上与常规GC-MS无异,其原理是通过手性固定相与化合物的强弱不一的相互作用将相应对映异构体分离。但由于手性化合物在高温下容易发生消旋化,将对手性分离效果产生较大影响,因此手性GC-MS分析方法的最高温度往往不超过200 ℃。挥发性化合物的手性分离研究中常见的手性固定相及其分离效果如表1所示。

表1 常见的手性固定相及其分离效果Table 1 Common chiral stationary phases and separation efficacy
3.2 MDGC技术
由于茶叶的香气成分繁多复杂,采用普通的一维GC获得的谱图干扰比较严重,往往难以对感兴趣的手性组分进行准确的定性与定量。采用多维GC方法,用非手性柱对香气成分进行预分离,仅将感兴趣的手性组分切割后,进入手性分析柱进一步分离,这样既消除了其他组分的干扰,又避免了高沸点组分进入手性柱对其造成污染,由此可见,多维GC将是复杂基体中手性组分定性分析与定量测定的理想方法[54]。早在20世纪80年代,国外研究小组就已经将多维GC应用于对映异构体的分离上[55-56],近几年该技术在植物或食品化学领域得到了广泛的应用。Bonaccorsi等[57]利用MDGC技术分离出了柑桔精油中的挥发性化合物,可实现α-侧柏烯、α-蒎烯、莰烯、β-蒎烯、香桧烯、α-水芹烯、β-水芹烯、柠檬烯、樟脑、芳樟醇、香茅醛、乙酸芳樟酯、4-萜品醇、α-松油醇14 种化合物的手性分离;同时还指出柑桔等多种植物具有特征性的对映异构体分布,如研究表明α-侧柏烯、α-蒎烯、β-蒎烯、香桧烯、樟脑、芳樟醇、4-萜品醇、乙酸芳樟酯等化合物在不同季节的佛手柑精油中均保持稳定的对映异构体比例关系,而α-松油醇随着季节的变化(冬→春→夏→秋)从L构型逐渐转化至D构型,这一特征现象给佛手柑精油的季节判定研究提供了新思路。Yuan Fang等[58]通过香气萃取稀释分析(aroma extract dilution analysis,AEDA)、定量比较和手性MDGC-MS分析研究了新鲜和储存后陈化的柠檬风味茶饮料的香气特征,新鲜样品的AEDA分析显示,3-甲基丁醛、异戊醇、β-大马酮、β-紫罗兰酮、2-苯乙醇、4-羟基-2,5-二甲基-3(2H)-呋喃酮和香草醛的风味稀释因子(flavor dilution factors,FD)值较高,可能是重要的香气贡献物质。芳樟醇的FD值在陈化样品中显著降低,由新鲜样品中的64降低到4(另一份样品为8),MDGC-MS手性分析显示芳樟醇的总量在储存后几乎没有变化,但是对于新鲜和陈化的样品,对映体比率不同,推测降低的主要原因是R-(-)-芳樟醇向S-(+)-芳樟醇的转化。
目前MDGC是手性挥发性成分研究的主流分析手段,本综述中所介绍的植物及食品中挥发性成分的手性分析大部分是采用该方法,均取得了较好的实验结果。
3.3 GC×GC技术
GC×GC技术与手性分析技术结合的研究报道目前还较少见[59-61],与MDGC工作原理相反的是,第一根色谱柱通常选用手性长柱,通过程序升温法将精油中的化合物依据沸点高低及对映异构体在手性固定相中的吸附能力强弱进行分离;第二根色谱柱往往采用极性柱(短柱),依据化合物极性进行分离,最终将众多手性化合物逐一分离开来。由于GC×GC的灵敏度和峰容量有着绝对的优势,且所有组分都参与第二维色谱柱的分离,因此尤其适用于复杂体系中痕量组分的定性定量分析。Shellie等[61]采用GC×GC技术成功分离出澳洲白千层精油中19 种手性萜类化合物,包括α-侧柏烯、α-蒎烯、香桧烯、β-蒎烯、月桂烯、α-水芹烯、α-萜品烯、对伞花烃、柠檬烯、1,8-桉叶素、γ-松油醇、反式桧烯水合物、异松油烯、顺式桧烯水合物、芳樟醇、顺式4-异丙基-1-甲基环己-2-烯醇、反式-4-异丙基-1-甲基环己-2-烯醇、4-萜品醇、α-松油醇。目前采用GC×GC技术分离手性挥发性成分的报道还相对较少,主要是因为分析成本较为昂贵,且工作量大,受其他组分干扰的可能性也较大。
3.4 3 种分析技术的比较
3 种分析手段都有各自的优点及可能的局限性。GC-MS技术在检测分析领域得到了广泛的应用,但随着化学科学的不断进步,分析要求也日益提升,GC-MS的缺点逐渐暴露,其中包括灵敏度较低、峰容量较小和检测时间过长等,限制了手性分析研究的发展。尽管如此,从经济性和操作性等方面来说,GC-MS依然起着重要的作用。
MDGC技术的灵活性高,可以选择感兴趣的组分进行手性拆分,然而只能在某一相对狭窄的预先检测所确定的时间段内进行低效二次分离,成百上千次中心切割分离效果可能只相当于GC×GC的一次进样,分离出的手性萜类化合物存在与一维GC类似的峰重叠现象,同样无法实现目标物的精确定性定量。更重要的是,复杂分离体系中化合物沸点、极性各异,出峰保留时间相差极大,若要实现多种萜类化合物的手性分析,需进行多次中心切割,操作过于繁琐复杂。
虽然在同一个挥发性化合物的手性分离效果上,GC-MS、MDGC及GC×GC分析结果相差较小,但是GC×GC技术在灵敏度和峰容量上有着绝对的优势,第二维极性色谱柱可将第一维非极性的手性色谱柱无法分离的组分充分分离。因此通过GC×GC可将目标化合物与茶叶或植物香气成分中的其他复杂化学成分完全分离,避免了“峰重叠”现象;也可检测到一维GC无法检测到的香气阈值低但痕量的挥发性化合物。然而,目前GC×GC技术分析成本较为昂贵,而且由于可分离化合物过多,目标化合物可能受其他组分的干扰较大,分析工作量也较大,因此目前还未得到广泛应用。
3 种分析方法都有各自的优势和不足,在实际样品的分析中应依照具体的分析目标及要求来考察与确定。值得注意的是,以往的文献报道中虽都有3 种分析方法的应用,但在后两者的检测器选择上较多地选用氢火焰离子化检测器。然而,对于处在复杂化学体系中的目标物而言,即使有标准品进行保留时间对照,但仍极可能存在由于物质沸点、结构、极性等过于相似带来的鉴定失误现象,也往往导致目标化合物的定量分析偏差较大。因此在今后的研究中,检测器的选择也应该是挥发性成分对映异构体分析方法关注的重点,选择具有高灵敏度及分辨率的质谱检测器可显著提高分析结果的可靠性及准确性。
4 结 语
挥发性成分对映异构体的分析在食品及植物领域如水果、蜂蜜、植物精油等中都得到了较为广泛的研究和应用。芳樟醇、芳樟醇氧化物、α-松油醇、4-萜品醇、α-紫罗兰酮、α-蒎烯及柠檬烯等对映异构体通过手性GC分析技术可以得到很好的分离效果,且由于部分挥发性对映异构体的比例与植物或食品的品种、产地等有密切联系,目前也已初步应用于生命体的产地溯源、真伪鉴别等方面。
然而,挥发性成分的对映异构体研究在茶叶领域仍然进展缓慢,以往的研究受分析手段限制,往往停留在香气化合物的常规分离上,更深层次的挥发性成分的立体构型、立体构型对茶叶香气的具体影响等,目前尚未得到系统研究。今后的研究可以着眼于手性挥发性成分的研究,通过高端的色谱分析技术解决现有挥发性化合物因种类繁多导致的分离困难问题;在此基础上,采用GC-嗅觉测量法对手性挥发性成分的香气特征、茶叶香气形成的贡献率等做深入而系统的研究;此外,也可以利用挥发性成分的不同构型标准品模拟茶叶中的含量配比,重组茶叶香气,从而对茶叶香气的形成机理展开探索。茶叶的香气是由多种复杂的化合物共同影响而形成,随着人们对茶叶中挥发性化合物认识的不断深入以及检测手段的提升,将挥发性化合物的立体构型等以往被忽视的因素融入香气形成机理研究中也将是今后茶叶香气化学理论研究的重要趋势。
另一方面,受植物或食品领域的研究启发,茶叶中手性挥发性成分的比例组成可能与茶叶的特征性属性,如茶叶的类别、品种等有着重要的联系;因此也可以在研究结果的基础上寻找挥发性成分对映异构体的分布规律,从而应用于茶叶的产地溯源、品种判别、真伪鉴定及质量认证等方面。
综上所述,茶叶中挥发性成分对映异构体的研究有助于从更高水平上科学认识茶叶的重要香气成分及其形成机理,深化茶叶香气基础研究,完善茶叶香气理论体系,不仅在理论上有着重要的创新意义,而且能够为今后茶叶的溯源、真伪辨析、品种判别以及质量认证等提供科学理论依据,有着广阔的应用前景。
[1] 王力, 林智, 吕海鹏, 等. 茶叶香气影响因子的研究进展[J]. 食品科学, 2010, 31(15): 293-298. DOI:10.7506/spkx1002-6630-201015064.
[2] 杨停. 茶叶香气成分中芳樟醇手性异构体的分析[D]. 北京: 中国农业科学院, 2015: 15-25. DOI:10.7666/d.Y2787866.
[3] WANG D, KUBOTA K, KOBAYASHI A. Optical isomers of methyl jasmonate in tea aroma[J]. Bioscience Biotechnology & Biochemistry,1996, 60(3): 508-510. DOI:10.1271/bbb.60.508.
[4] WONG Y F, DAVIES N W, CHIN S T, et al. Enantiomeric distribution of selected terpenes for authenticity assessment of Australian Melaleuca alternifolia oil[J]. Industrial Crops and Products, 2015, 67:475-483. DOI:10.1016/j.indcrop.2015.01.066.
[5] 王秋霜, 陈栋, 吴华玲. 红茶香气研究进展[J]. 广东农业科学, 2011,38(18): 86-88. DOI:10.3969/j.issn.1004-874X.2011.18.035.
[6] 王秋霜, 陈栋, 许勇泉, 等. 广东红茶香气成分的比较研究[J]. 茶叶科学, 2012, 32(1): 9-16. DOI:10.13305/j.cnki.jts.2012.01.002.
[7] 朱旗, 施兆鹏, 任春梅. 绿茶香气不同提取方法的研究[J]. 茶叶科学,2001, 21(1): 38-43. DOI:10.3969/j.issn.1000-369X.2001.01.010.
[8] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003: 39.
[9] 袁海波, 尹军峰, 叶国柱, 等. 茶叶香型及特征物质研究进展[J]. 中国茶叶, 2009, 31(8): 14-15. DOI:10.3969/j.issn.1000-3150.2009.08.004.
[10] 施梦南, 龚淑英. 茶叶香气研究进展[J]. 茶叶, 2012, 38(1): 19-23.DOI:10.3969/j.issn.0577-8921.2012.01.004.
[11] 贺志荣, 项威, 徐燕, 等. 茶树挥发性萜类物质及其糖苷化合物生物合成的研究进展[J]. 茶叶科学, 2012, 32(1): 1-8. DOI:10.13305/j.cnki.jts.2012.01.008.
[12] 吴勇. 萜烯类化合物与茶叶香气[J]. 化学工程与装备, 2009(11):123-125. DOI:10.3969/j.issn.1003-0735.2009.11.042.
[13] 林国强, 陈耀全, 陈新滋, 等. 手性合成: 不对称反应及其应用[M].2版. 北京: 科学出版社, 2005: 3-4.
[14] OHLOFF G, KLEIN E. Die absolute konfiguration des linalools durch verknüpfung mit dem pinansystem[J]. Tetrahedron, 1962, 18(1):37-42. DOI:10.1016/0040-4020(62)80021-0.
[15] PADRAYUTTAWAT A, YOSHIZAWA T, TAMURA H, et al.Optical isomers and odor thresholds of volatile constituents in Citrus sudachi[J]. Food Science & Technology Research, 1997, 3(4): 402-408. DOI:10.3136/fsti9596t9798.3.402.
[16] TAKOI K, KOIE K, ITOGA Y, et al. Biotransformation of hop-derived monoterpene alcohols by lager yeast and their contribution to the flavor of hopped beer[J]. Journal of Agricultural and Food Chemistry,2010, 58(8): 5050-5058. DOI:10.1021/jf1000524.
[17] QUATTRINI F, BIRESSI G, JUZA M, et al. Enantiomer separation of α-ionone using gas chromatography with cyclodextrin derivatives as chiral stationary phases[J]. Journal of Chromatography A, 1999,865(1/2): 201-210. DOI:10.1016/S0021-9673(99)00998-X.
[18] 王秀红, 贾崇荣, 万宏, 等. 多维气相色谱用于手性对映体的分离[J].分析化学, 1993, 21(5): 495-499.
[19] 张冬桃, 孙君, 叶乃兴, 等. 茶树萜烯类香气物质合成相关酶研究进展[J]. 茶叶学报, 2015, 56(2): 68-79. DOI:10.3969/j.issn.1007-4872.2015.02.002.
[20] 谭月萍, 黄建安, 刘仲华. 绿茶香气组成及其在加工中变化研究进展[J]. 茶叶通讯, 2006, 33(1): 35-38. DOI:10.3969/j.issn.1009-525X.2006.01.003.
[21] WANG Dongmei, ANDO K, MORITA K, et al. Optical isomers of linalool and linalool oxides in tea aroma[J]. Bioscience, Biotechnology,and Biochemistry, 1994, 58(11): 2050-2053. DOI:10.1271/bbb.58.2050.
[22] KURODA K, INOUE N, ITO Y, et al. Sedative eあects of the jasmine tea odor and (R)-(-)-linalool, one of its major odor components, on autonomic nerve activity and mood states[J]. European Journal of Applied Physiology, 2005, 95(2/3): 107-114. DOI:10.1007/s00421-005-1402-8.
[23] 杨停, 朱荫, 吕海鹏, 等. 茶叶香气成分中芳樟醇旋光异构体的分析[J]. 茶叶科学, 2015, 35(2): 137-144. DOI:10.13305/j.cnki.jts.2015.02.005.
[24] YANG T, ZHU Y, SHAO C Y, et al. Enantiomeric analysis of linalool in teas using headspace solid-phase microextraction with chiral gas chromatography[J]. Industrial Crops and Products, 2016(83): 17-23.DOI:10.1016/j.indcrop.2015.12.025.
[25] 邵晨阳, 吕海鹏, 朱荫, 等. 不同茶类中挥发性萜类化合物的对映异构体[J]. 中国农业科学, 2017, 50(6): 1109-1125. DOI:10.3864/j.issn.0578-1752.2017.06.012.
[26] ZHU Yin, SHAO Chenyang, LÜ Haipeng, et al. Enantiomeric and quantitative analysis of volatile terpenoids in diあerent teas (Camellia sinensis)[J]. Journal of Chromatography A, 2017, 1490: 177-190.DOI:10.1016/j.chroma.2017.02.013.
[27] DAVIES N W, LARKMAN T, MARRIOTT P J, et al. Determination of enantiomeric distribution of terpenes for quality assessment of Australian tea tree oil[J]. Journal of Agricultural and Food Chemistry,2016, 64(23): 4817-4819. DOI:10.1021/acs.jafc.6b01803.
[28] CHENG B H, LIN C Y, YEH T F, et al. Potential source of S-(+)-Linalool from Cinnamomum osmophloeum ct. linalool leaf: essential oil profile and enantiomeric purity[J]. Journal of Agricultural and Food Chemistry, 2012, 60(31): 7623-7628. DOI:10.1021/jf302248w.
[29] RUIZ DEL CASTILLO M L, HERRAIZ M, BLANCH G P.Determination of the enantiomeric composition of γ-lactones in edible oils by on-line coupled high performance liquid chromatography and gas chromatography[J]. Journal of Agricultural and Food Chemistry,2000, 48(4): 1186-1190. DOI:10.1021/jf990655n.
[30] RUSSELL B, RUSSELL R, MICHAEL N. Linalool in orange juice:origin and thermal stability[J]. Journal of Agricultural & Food Chemistry, 2003, 51(1): 196-199. DOI:10.1021/jf0257291.
[31] STEINHAUS M, FRITSCH H T, SCHIEBERLE P. Quantitation of (R)- and (S)-linalool in beer using solid phase microextraction(SPME) in combination with a stable isotope dilution assay (SIDA)[J].Journal of Agricultural and Food Chemistry, 2003, 51(24): 7100-7105.DOI:10.1021/jf0347057.
[32] RUIZ DEL CASTILLO M L, CAJA M M, HERRAIZ M. Use of the enantiomeric composition for the assessment of the authenticity of fruit beverages[J]. Journal of Agricultural and Food Chemistry, 2003,51(5): 1284-1288. DOI:10.1021/jf025711q.
[33] CAGLIERO C, BICCHI C, CORDERO C, et al. Fast headspaceenantioselective GC-mass spectrometric-multivariate statistical method for routine authentication of flavoured fruit foods[J]. Food Chemistry,2012, 132(2): 1071-1079. DOI:10.1016/j.foodchem.2011.10.106.
[34] BISHT D, CHANOTIYA C S, RANA M, et al. Variability in essential oil and bioactive chiral monoterpenoid compositions of Indian oregano(Origanum vulgare L.) populations from northwestern Himalaya and their chemotaxonomy[J]. Industrial Crops and Products, 2009, 30(3):422-426. DOI:10.1016/j.indcrop.2009.07.014.
[35] BARBA C, FLORES G, HERRAIZ M. Stereodiあerentiation of some chiral aroma compounds in wine using solid phase microextraction and multidimensional gas chromatography[J]. Food Chemistry, 2010,123(3): 846-851. DOI:10.1016/j.indcrop.2009.07.014.
[36] BONNLÄNDER B, CAPPUCCIO R, LIVERANI F S, et al. Analysis of enantiomeric linalool ratio in green and roasted coあee[J]. Flavour &Fragrance Journal, 2006, 21(4): 637-641. DOI:10.1002/あj.1633.
[37] LUAN Fang, MOSANDL A, GUBESCH M, et al. Enantioselective analysis of monoterpenes in different grape varieties during berry ripening using stir bar sorptive extraction- and solid phase extractionenantioselective-multidimensional gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2006, 1112(1/2): 369-374. DOI:10.1016/j.chroma.2005.12.056.
[38] POLAK E H, FOMBON A M, TILQUIN C, et al. Sensory evidence for olfactory receptors with opposite chiral selectivity[J]. Behavioural Brain Research, 1989, 31(3): 199-206. DOI:10.1016/0166-4328(89)90002-8.
[39] WINTER M, SUNDT E. Recherches sur les arǒmes. 5e communication. Analyse de l’arǒme des framboises. I. Les constituants carbonylés volatils[J]. Helvetica Chimica Acta, 1962, 45(6): 2195-2211. DOI:10.1002/hlca.19620450654.
[40] MÜGGLER-CHAVAN F, VIANI R, BRICOUT J, et al. Sur la composition de l’arôme de thé[J]. Helvetica Chimica Acta, 1966,49(6): 1763-1767. DOI:10.1002/hlca.19660490609.
[41] UHDE G, OHLOFF G. Parmon, eine phantomverbindung im veilchenblütenöl[J]. Helvetica Chimica Acta, 1972, 55(7): 2621-2625.DOI:10.1002/hlca.19720550739.
[42] LINKO R R, KALLIO H, PYYSALO T, et al. Volatile monocarbonyl compounds of carrot roots at various stages of maturity[J]. Z Lebensm Unters Forsch, 1978, 166(4): 208-211. DOI:10.1007/BF01126545.
[43] SHUTAVA H G, KAVALENKA N A, SUPICHENKA N N, et al.Essential oils of lamiaceae with high content of α-, β-pinene and limonene enantiomers[J]. Journal of Essential Oil-Bearing Plants,2014, 17(1): 18-25. DOI:10.1080/0972060X.2014.884816.
[44] CHIN S T, NOLVACHAI Y, MARRIOTT P J. Enantiomeric separation in comprehensive two-dimensional gas chromatography with accurate mass analysis[J]. Chirality, 2014, 26(11): 747-753. DOI:10.1002/chir.22280.
[45] DELORT E, JAQUIER A, DECORZANT E, et al. Comparative analysis of three Australian finger lime (Citrus australasica)cultivars: identification of unique citrus chemotypes and new volatile molecules[J]. Phytochemistry, 2015: 111-124. DOI:10.1016/j.phytochem.2014.10.023.
[46] SCIARRONE D, SCHIPILLITI L, RAGONESE C, et al. Thorough evaluation of the validity of conventional enantio-gas chromatography in the analysis of volatile chiral compounds in mandarin essential oil: a comparative investigation with multidimensional gas chromatography[J]. Journal of Chromatography A, 2010, 1217(7):1101-1105. DOI:10.1016/j.chroma.2009.09.080.
[47] SIANI A C, TAPPIN M R R, RAMOS M F S, et al. Linalool from Lippia alba: study of the reproducibility of the essential oil profile and the enantiomeric purity[J]. Journal of Agricultural & Food Chemistry,2002, 50(12): 3518-3521. DOI:10.1021/jf011592n.
[48] ŠPÁNIK I, PAŽITNÁ A, ŠIŠKA P, et al. The determination of botanical origin of honeys based on enantiomer distribution of chiral volatile organic compounds[J]. Food Chemistry, 2014, 158: 497-503.DOI:10.1016/j.foodchem.2014.02.129.
[49] VERZERA A, TRIPODI G, CONDURSO C, et al. Chiral volatile compounds for the determination of orange honey authenticity[J]. Food Control, 2014, 39(1): 237-243. DOI:10.1016/j.foodcont.2013.11.012.
[50] PAŽITNÁ A, SPÁNIK I. Enantiomeric distribution of major chiral volatile organic compounds in juniper-flavored distillates[J].Journal of Separation Science, 2014, 37(4): 398-403. DOI:10.1002/jssc.201301151.
[51] MOSANDL A. Authenticity assessment: a permanent challenge in food flavor and essential oil analysis[J]. Journal of Chromatographic Science, 2004, 42(8): 440-449. DOI:10.1093/chromsci/42.8.440.
[52] 李莉, 字敏, 任朝兴, 等. 气相色谱手性固定相研究进展[J]. 化学进展, 2007, 19(2): 393-403. DOI:10.3321/j.issn:1005-281X.2007.02.024.[53] 傅若农. 近几年国内外气相色谱固定相的进展[J]. 分析试验室,2013, 32(5): 111-124. DOI:10.13595/j.cnki.issn1000-0720.2013.0143.
[54] 王秀红, 贾崇荣, 万宏, 等. 多维气相色谱用于手性对映体的分离[J].分析化学, 1993, 21(5): 495-499.
[55] SCHOMBURG G, HUSAMANM, H, HÜBINGER E, et al.Multidimensional capillary gas chromatography: enantiomeric separations of selected cuts using a chiral second column[J]. Journal of High Resolution Chromatography, 1984, 7: 404-410. DOI:10.1002/jhrc.1240070711.
[56] GUICHARD E, KUSTERMANN A, MOSANDL A. Chiral flavor compounds from apricots: distribution of γ-lactone enantiomers and steorediあerentiation of dihydroactinidiolide using multi-dimensional gas chromotography[J]. Journal of Chromatography A, 1990, 498:396-401. DOI:10.1016/S0021-9673(01)84268-0.
[57] BONACCORSI I, SCIARRONE D, COTRONEO A, et al.Enantiomeric distribution of key volatile components in Citrus essential oils[J]. Revista Brasileira de Farmacognosia, 2011, 21(5):841-849. DOI:10.1590/S0102-695X2011005000123.
[58] YUAN Fang, HE Fei, QIAN Yanping, et al. Aroma stability of lemonflavored hard iced tea assessed by chirality and aroma extract dilution analysis[J]. Journal of Agricultural and Food Chemistry, 2016, 64(28):5717-5723. DOI:10.1021/acs.jafc.6b01776.
[59] BICCHI C, D’AMATO A, RUBIOLO P. Cyclodextrin derivatives as chiral selectors for direct gas chromatographic separation of enantiomers in the essential oil, aroma and flavour fields[J]. Journal of Chromatography A, 1999, 843(1/2): 99-121. DOI:10.1016/S0021-9673(99)00202-2.
[60] JUNGE M, BIERI S, HUEGEL H, et al. Fast comprehensive twodimensional gas chromatography with cryogenic modulation[J].Analytical Chemistry, 2007, 79(12): 4448-4454. DOI:10.1021/ac062351n.
[61] SHELLIE R, MARRIOTT P, CORNWELL C. Application of comprehensive two-dimensional gas chromatography (GC×GC)to the enantioselective analysis of essential oils[J]. Journal of Separation Science, 2001, 24(10/11): 823-830. DOI:10.1002/1615-9314(20011101)24:10/11<823::AID-JSSC823>3.0.CO;2-H.
