日粮添加蛋氨酸对宫内发育迟缓生长猪肠道发育和抗氧化功能的影响
2018-06-19苏伟鹏应志雄张礼根张莉莉
苏伟鹏,张 昊,应志雄,李 悦,张礼根,张莉莉,王 恬*
(南京农业大学动物科技学院,江苏 南京 210095)
胎儿宫内发育迟缓(intrauterine growth retardation,IUGR)是围产期的常见并发症之一,临床表现为胎儿初生体质量低,各组织器官生长发育受阻,高发病率和死亡率等[1-2]。流行病学研究发现,IUGR会导致胎儿成年后发生代谢综合征的风险升高,如高血压、糖尿病和肥胖症等[3]。据统计,全球每年约有5%~10%的IUGR新生儿,IUGR已经成为困扰人类医学的一大难题[4]。肠道是营养物质消化吸收的主要部位,同时也是外界抗原、微生物和病毒入侵的主要位点[5]。诸多研究表明,IUGR可引起机体氧化应激及肠道黏膜损伤,导致肠道功能紊乱[6-8]。
近年来,膳食氨基酸的临床应用在维持肠道健康和预防肠道疾病方面已受到广泛关注[9]。蛋氨酸(methionine,Met)属于含硫氨基酸,是人体的必需氨基酸之一[10]。研究发现,蛋氨酸在促进蛋白质代谢、提供活性甲基、调节机体免疫功能等方面具有重要作用[11-12]。同时,体外实验表明,蛋氨酸可以缓解过氧化氢诱导的线粒体氧化损伤[13],具有潜在的抗氧化作用。Nkabyo等[14]报道,含硫氨基酸的缺乏会导致大鼠血浆和肠道黏膜中还原型谷胱甘肽/氧化型谷胱甘肽(reduced glutathione/oxidized glutathione,GSH/GSSG)的氧化还原状态失衡。另外,缺乏含硫氨基酸会显著抑制肠道黏膜生长,具体表现为肠道绒毛萎缩以及肠上皮细胞增殖减少[15]。蛋氨酸代谢产物半胱氨酸及其参与形成的GSH,在提高机体抗氧化防御能力以及维持肠道功能方面也发挥着积极作用[11,16]。因此,蛋氨酸作为食品营养添加剂对于改善人体健康和维持肠道功能具有重要意义。
但有关蛋氨酸缓解IUGR后代肠道损伤方面的报道较少,特别是在生长发育迅速的关键阶段。猪和人在肠道结构、消化系统等方面均有较高的相似性,IUGR猪作为人类理想的动物模型,对临床治疗IUGR后代肠道功能紊乱具有重要的参考意义[17]。因此,本研究以IUGR生长猪为动物模型,探讨蛋氨酸对IUGR生长猪肠道发育和抗氧化功能的影响,为改善IUGR后代肠道损伤提供新的思路,同时为蛋氨酸在食品营养添加剂中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
L-蛋氨酸(纯度99%) 韩国希杰有限公司;蔗糖酶试剂盒、麦芽糖酶试剂盒、乳糖酶试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、蛋白质羰基(protein carbonyl,PC)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、谷胱甘肽还原酶(glutathione reductase,GR)试剂盒、总谷胱甘肽(total glutathione,T-GSH)/GSSG试剂盒、总蛋白定量测定(二辛可宁酸(bicinchoninic acid,BCA)法)试剂盒 南京建成生物工程研究所;TRIzol试剂 美国英杰生命技术有限公司;mRNA反转录试剂盒、SYBR Green定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 宝生物工程(大连)有限公司。
1.2 仪器与设备
BSA224S-CW型分析天平 德国Sartorius公司;Bio-Gen Series PRO 200型匀浆机 美国PRO Scientific公司;5804R型台式高速冷冻离心机 德国Eppendorf公司;DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;T-6m型紫外-可见分光光度计 南京菲勒仪器有限公司;DW-25L262型医用低温保存箱青岛海尔特种电器有限公司;Multiskan Go型全波长酶标仪、8925型-80 ℃超低温冰箱、实时荧光PCR仪美国Thermo Fisher Scientific公司;ECLIPSE 80i型显微镜日本Nikon公司。
1.3 方法
1.3.1 动物实验设计
在体况相似、胎次接近、品种相同的30 头母猪所产的新生仔猪中,每窝各挑选1 头正常初生体质量(normal birth weight,NBW)和2 头IUGR新生仔猪(以初生体质量接近群体平均值且小于0.5 个标准差的仔猪为NBW仔猪,以初生体质量低于群体平均值2 个标准差的仔猪为IUGR仔猪[18-19]),所用仔猪全部为母猪。所有仔猪于21 日龄断奶,30 头NBW断奶仔猪饲喂基础(control,CON)日粮(NBW-CON组),60 头IUGR断奶仔猪随机分成两个处理组,分别饲喂基础日粮(IUGR-CON组)和蛋氨酸日粮(IUGR-MET组),每个处理组6 个重复,每个重复5 头猪。实验期为84 d。日粮配制参照美国国家研究委员会(2012)猪的营养需要[20],日粮配方和营养水平见表1。实验猪饲养管理严格执行卫生防疫制度。
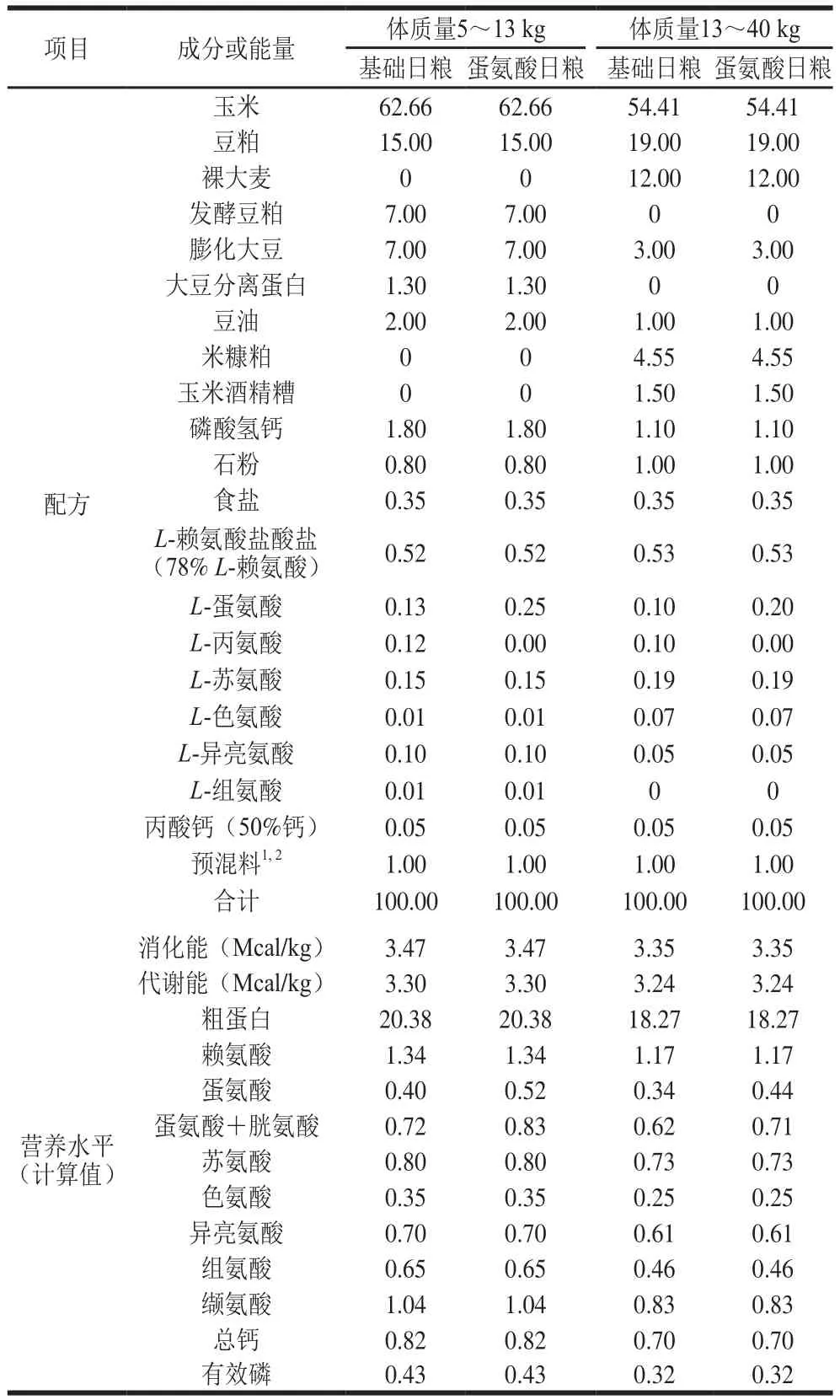
表1 日粮配方和营养水平Table 1 Composition and nutrient levels of the experimental diets%
1.3.2 样品采集
实验结束时,每组的每个重复中挑选1 头体质量适中的实验猪,肌内注射戊巴比妥钠(50 mg/kg)麻醉后处以安乐死。迅速剖开腹腔,分离出空肠和回肠。在每段肠道中间分别取1.0 cm的肠段并用4%(质量分数,下同)多聚甲醛固定。用手术剪剪开肠道,刮取肠道黏膜并装入冻存管中,液氮速冻后置于-80 ℃超低温冰箱保存。
1.3.3 测定指标
1.3.3.1 肠道组织形态变化观察
从4%多聚甲醛固定液中取出肠道组织进行常规石蜡包埋,苏木精-伊红染色,利用显微成像系统对组织切片进行观察拍照。使用Image-Pro Plus软件测量绒毛高度(villus height,VH)/μm、绒毛宽度(villus width,VW)/μm和隐窝深度(crypt depth,CD)/μm,并计算绒毛高度/隐窝深度比值(VH/CD)和绒毛表面积(villus surface area,VSA)/mm2,VSA根据下式计算[21]。
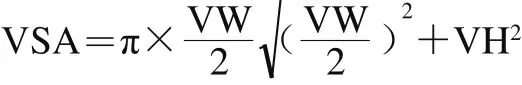
1.3.3.2 肠道黏膜匀浆液制备与指标测定
称取0.2 g左右肠道黏膜组织,按照1∶4(m/V)的比例加入预冷的生理盐水,冰水浴条件下机械匀浆,然后在4 ℃下3 000 r/min离心10 min,取上清液(即20%肠道黏膜匀浆液),放置于-20 ℃冰箱保存待用。使用BCA法测定蛋白含量;肠道黏膜匀浆液中MDA含量采用硫代巴比妥酸法测定[22];PC含量采用2,4-二硝基苯肼法测定[23];SOD活力采用黄嘌呤氧化酶法测定[24];GSH-Px活力[25]和GSSG含量[26]采用2-硝基苯甲酸法测定,GSH含量=T-GSH含量-2×GSSG含量;GR活力采用还原型辅酶Ⅱ法测定[27]。以上指标的测定均严格按照产品说明书进行操作。
1.3.3.3 肠道黏膜相关基因mRNA相对表达量测定
采用TRIzol试剂提取肠道黏膜组织总RNA,并按照反转录试剂盒说明书的方法和步骤进行反转录。使用SYBR Green定量PCR试剂盒进行实时荧光定量PCR(20 µL体系):cDNA 2 µL,上、下游引物各0.4 µL,SYBR Premix Ex Taq 10 µL,Rox Reference Dye 0.4 µL,超纯水6.8 µL。反应程序如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,重复40 个循环。选择β-actin作为内参基因,采用2−ΔΔCt法计算各目的基因mRNA相对表达量。各目的基因引物序列见表2。

表2 实时荧光定量PCR引物序列Table 2 Primer sequences used in real-time PCR
1.4 数据统计与分析
实验数据应用SPSS 16.0统计软件中的单因素方差分析进行差异显著性检验,并采用Tukey法进行多重比较,以P<0.05作为差异显著。实验结果以平均值±标准误表示。
2 结果与分析
2.1 日粮添加蛋氨酸对IUGR生长猪肠道绒毛形态的影响
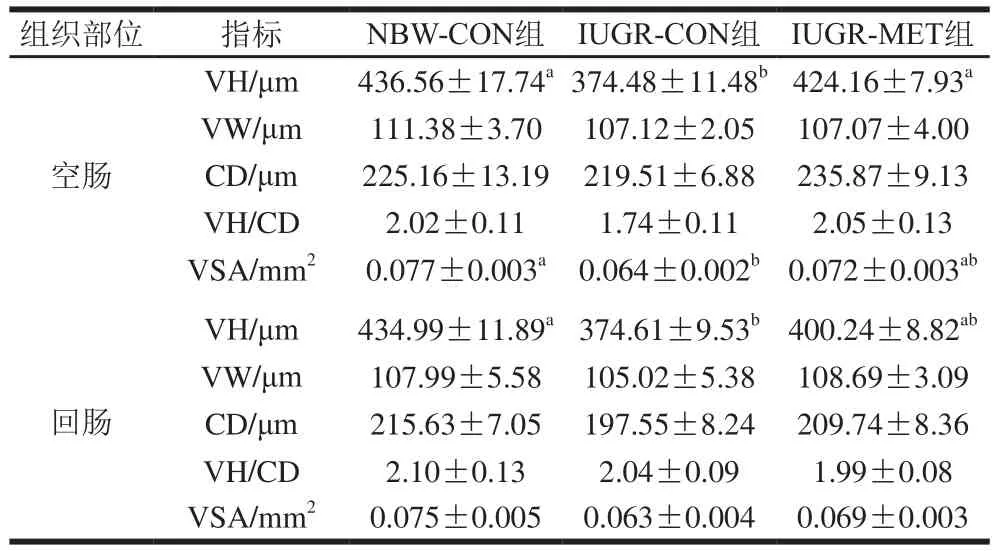
表3 日粮添加蛋氨酸对IUGR生长猪肠道绒毛形态的影响Table 3 Effect of dietary methionine supplementation on villus morphology in the intestine of growing pigs with IUGR
由表3可知,与NBW-CON组生长猪相比,IUGR-CON组生长猪空肠VH和VSA显著降低(P<0.05),VW、CD和VH/CD值无显著差异(P>0.05);回肠VH显著降低(P<0.05),VW、CD、VH/CD值和VSA无显著差异(P>0.05)。与IUGR-CON组生长猪相比,IUGR-MET组生长猪空肠VH显著升高(P<0.05),VW、CD、VH/CD值和VSA无显著差异(P>0.05);回肠绒毛形态无显著差异(P>0.05)。与NBW-CON组生长猪相比,IUGR-MET组生长猪空肠和回肠绒毛形态均无显著差异(P>0.05)。
2.2 日粮添加蛋氨酸对IUGR生长猪肠道二糖酶活力的影响

表4 日粮添加蛋氨酸对IUGR生长猪肠道二糖酶活力的影响Table 4 Effect of dietary methionine supplementation on disaccharidases activities in the intestine of growing pigs with IUGR U/mg pro
由表4可知,与NBW-CON组生长猪相比,IUGR-CON组生长猪空肠二糖酶活力无显著差异(P>0.05);回肠蔗糖酶和麦芽糖酶活力显著降低(P<0.05),乳糖酶活力无显著差异(P>0.05)。与IUGR-CON组生长猪相比,IUGR-MET组生长猪空肠二糖酶活力无显著差异(P>0.05);回肠麦芽糖酶活力显著升高(P<0.05),蔗糖酶和乳糖酶活力无显著差异(P>0.05)。与NBW-CON组生长猪相比,IUGR-MET组生长猪空肠和回肠二糖酶活力均无显著差异(P>0.05)。
2.3 日粮添加蛋氨酸对IUGR生长猪肠道氧化还原状态的影响
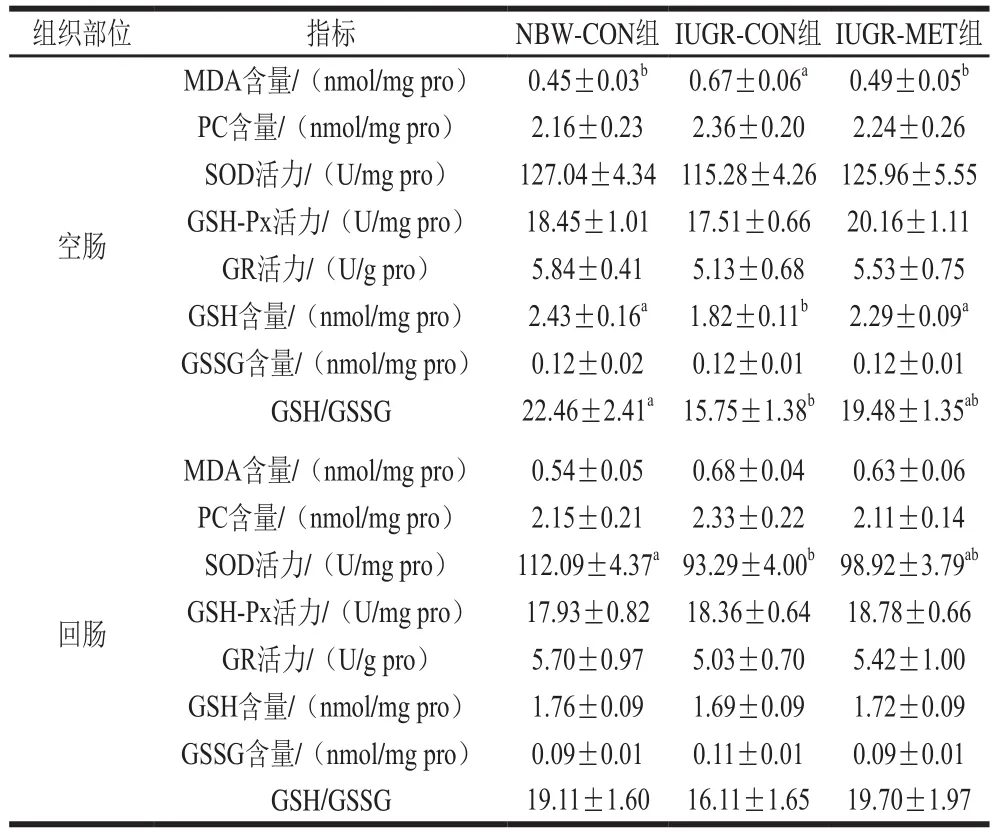
表5 日粮添加蛋氨酸对IUGR生长猪肠道氧化还原状态的影响Table 5 Effect of dietary methionine supplementation on oxidative status in the intestine of growing pigs with IUGR
由表5可知,与NBW-CON组生长猪相比,IUGR-CON组生长猪空肠MDA含量显著升高(P<0.05),GSH含量和GSH/GSSG值显著降低(P<0.05),PC和GSSG含量、SOD、GSH-Px和GR活力无显著差异(P>0.05);回肠SOD活力显著降低(P<0.05),MDA、PC、GSH和GSSG含量、GSH-Px和GR活力、GSH/GSSG值无显著差异(P>0.05)。与IUGR-CON组生长猪相比,IUGR-MET组生长猪空肠MDA含量显著降低(P<0.05),GSH含量显著升高(P<0.05),PC和GSSG含量、SOD、GSH-Px和GR活力、GSH/GSSG值无显著差异(P>0.05);回肠氧化还原状态无显著差异(P>0.05)。与NBW-CON组生长猪相比,IUGR-MET组生长猪空肠和回肠氧化还原状态均无显著差异(P>0.05)。
2.4 日粮添加蛋氨酸对IUGR生长猪肠道基因mRNA相对表达量的影响
由表6可知,与NBW-CON组生长猪相比,IUGR-CON组生长猪空肠OCLN mRNA相对表达量显著降低(P<0.05),SOD1、GPx1、CLDN2和ZO1 mRNA相对表达量无显著差异(P>0.05);回肠各基因mRNA相对表达量均无显著差异(P>0.05)。与IUGR-CON组生长猪相比,IUGR-MET组生长猪空肠OCLN mRNA相对表达量显著升高(P<0.05),SOD1、GPx1、CLDN2和ZO1 mRNA相对表达量无显著差异(P>0.05);回肠各基因mRNA相对表达量均无显著差异(P>0.05)。与NBW-CON组生长猪相比,IUGR-MET组生长猪空肠和回肠各基因mRNA相对表达量均无显著差异(P>0.05)。
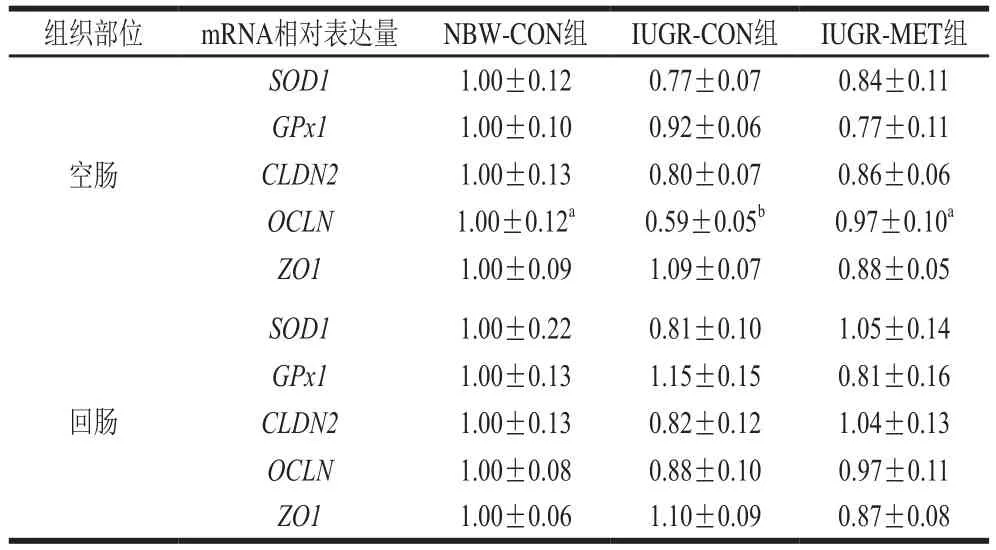
表6 日粮添加蛋氨酸对IUGR生长猪肠道基因mRNA相对表达量的影响Table 6 Effect of dietary methionine supplementation on mRNA expression in the intestine of growing pigs with IUGR
3 讨 论
研究表明,IUGR对后代肠道发育和抗氧化功能均具有不同程度的负面作用,导致其健康状况长期受损,阻碍机体的正常生长发育[28]。随着人们营养观念和生活水平的提高,通过营养干预改善IUGR的健康状况已经受到广泛关注。作为人体必不可少的营养物质,蛋氨酸的代谢与蛋白质合成、DNA甲基化和肠道功能等方面密切相关[11,29]。因此,蛋氨酸在食品营养添加剂中的应用具有广阔的发展前景。但长期摄入高水平蛋氨酸可能会给机体带来不利影响[10]。研究表明,蛋氨酸是毒性最强的氨基酸之一[30]。Gomez等[31]发现,大鼠摄入过量的蛋氨酸会导致肝中毒,并伴随着肝脏线粒体活性氧自由基(reactive oxygen species,ROS)的增多以及线粒体DNA损伤。Garlick[32]报道,尽管蛋氨酸作为高半胱氨酸的前体,但并没有证据表明在合理范围内摄入蛋氨酸会引发机体中毒。因此,摄入适量的蛋氨酸对于机体生长发育和健康状况具有重要意义。本研究对在合理范围内添加蛋氨酸对IUGR生长猪肠道发育和抗氧化功能的影响进行探讨。
肠道的正常结构和功能是机体充分消化吸收营养物质的关键[33]。VH增高和VSA增大可以增加肠道与营养物质的接触面积,从而强化机体对营养物质的吸收。本研究发现,IUGR导致105 日龄生长猪空肠和回肠VH降低以及空肠VSA减小,提示IUGR可导致机体对营养物质的吸收能力降低,从而阻碍机体的生长发育。王远孝[28]的研究表明,160 日龄IUGR猪空肠和回肠VH均显著低于NBW猪,与本实验结果相似。本研究中,通过添加蛋氨酸可显著升高IUGR生长猪空肠VH,提示蛋氨酸可在一定程度上促进IUGR后代肠道黏膜发育。另外,Chen Ying等[34]研究发现,日粮添加蛋氨酸可提高断奶仔猪空肠VH以及VH/CD比值,与本实验结果相似。
二糖酶作为肠道中重要的消化酶,是肠道黏膜发育成熟的标志[35]。研究发现,IUGR影响肠道黏膜中消化酶的发育成熟[21]。本实验中,IUGR导致105 日龄生长猪回肠蔗糖酶和麦芽糖酶活力显著降低,提示IUGR阻碍肠道黏膜发育成熟。王远孝[28]的研究表明,160 日龄IUGR猪空肠蔗糖酶和麦芽糖酶活力分别比NBW猪降低了39.07%和42.39%,与本实验结果相似。本研究中,通过添加蛋氨酸可显著升高IUGR生长猪回肠麦芽糖酶活力,表明蛋氨酸对肠道二糖酶发育成熟具有一定的促进作用。研究发现,缺乏含硫氨基酸会抑制肠上皮细胞增长[15],从而影响肠道的消化吸收功能。因此,膳食补充蛋氨酸对IUGR后代肠道吸收营养物质具有重要意义。
肠道紧密连接是肠道与外界屏障的重要组成部分,维持完整的紧密连接形态和功能对保护肠道黏膜屏障和防止细菌入侵具有重要意义[36]。研究表明,紧密连接蛋白OCLN是紧密连接的主要功能调节蛋白[37],OCLN表达量降低可引起肠上皮屏障通透性增强[38]。本研究发现,IUGR显著降低生长猪空肠OCLN mRNA相对表达量,提示IUGR肠道黏膜屏障受损。Wang Wei等[39]研究表明,IUGR导致新生仔猪肠道OCLN基因相对表达量降低并增加肠道通透性。本研究发现,日粮添加蛋氨酸后IUGR生长猪空肠OCLN mRNA相对表达量显著升高。Chen Ying等[34]给断奶仔猪补充蛋氨酸,提高了肠道OCLN蛋白表达量,与本实验结果相似。
先前的研究发现,氧化应激是导致IUGR后代肠道损伤的重要因素[6]。机体在正常的新陈代谢过程中会不断地生成ROS,并与机体内的抗氧化系统保持良好的动态平衡[40]。当机体ROS的生成与抗氧化系统失衡时,则会引起机体氧化应激[41]。研究表明,IUGR与氧化应激密切相关,易加剧机体脂质过氧化程度[42]。MDA是脂质过氧化产物之一,常用来反映机体氧化应激的程度[43]。本研究发现,IUGR可导致105 日龄生长猪空肠MDA含量显著升高。SOD是清除ROS的金属酶,可迅速捕捉体内生成的ROS,维持机体抗氧化系统平衡[44]。GSH是一种小分子巯基化合物,参与组成机体内非酶促抗氧化系统[45]。本研究发现,IUGR生长猪回肠SOD活力显著降低,空肠GSH含量和GSH/GSSG值显著降低。由此可见,IUGR会导致猪肠道抗氧化酶活力和抗氧化物质含量显著降低,加剧氧化应激程度,导致肠道发育受阻。蛋氨酸是合成半胱氨酸的重要成分,而半胱氨酸是合成GSH的前体物质[46]。半胱氨酸可通过调节机体氧化还原状态促进肠上皮细胞增殖,对肠上皮细胞的抗氧化功能起着重要作用[47]。Chen Ying等[34]研究发现,在猪日粮中添加蛋氨酸可显著提高十二指肠和空肠GSH含量,显著降低GSSG含量。本研究发现,日粮添加蛋氨酸可显著降低IUGR生长猪空肠MDA含量,显著升高空肠GSH含量,与上述结果相似,表明蛋氨酸对IUGR后代肠道氧化损伤具有一定的改善作用。
4 结 论
本研究表明,IUGR显著升高生长猪肠道MDA含量,显著降低抗氧化酶活力和非酶物质含量,引起肠道绒毛萎缩、二糖酶活力降低和OCLN mRNA表达水平下调。日粮添加蛋氨酸显著降低IUGR生长猪肠道MDA含量,显著升高GSH含量,并显著缓解IUGR介导生长猪肠道绒毛萎缩、麦芽糖酶活力降低和OCLN mRNA表达水平下调。上述结果提示,IUGR导致生长猪肠道氧化损伤,破坏抗氧化防御系统,从而引起肠道结构、功能以及黏膜屏障受损。日粮添加蛋氨酸可通过改善生长猪肠道抗氧化能力,缓解IUGR导致的肠道功能紊乱。本研究进一步丰富了蛋氨酸作为食品营养添加剂在促进肠道健康方面的积极作用,也为建立IUGR后代营养干预方法提供新的思路和理论依据。
[1] VALSAMAKIS G, KANAKA-GANTENBEIN C, MALAMITSIPUCHNER A, et al. Causes of intrauterine growth restriction and the postnatal development of the metabolic syndrome[J]. Annals of the New York Academy of Sciences, 2006, 1092(1): 138-147.DOI:10.1196/annals.1365.012.
[2] MANDRUZZATO G, ANTSAKLIS A, BOTET F, et al. Intrauterine restriction (IUGR)[J]. Journal of Perinatal Medicine, 2008, 36(4): 277-281. DOI:10.1515/JPM.2008.050.
[3] SUHAG A, BERGHELLA V. Intrauterine growth restriction (IUGR):etiology and diagnosis[J]. Current Obstetrics and Gynecology Reports,2013, 2(2): 102-111. DOI:10.1007/s13669-013-0041-z.
[4] WU G, BAZER F W, DATTA S, et al. Proline metabolism in the conceptus: implications for fetal growth and development[J]. Amino Acids, 2008, 35(4): 691-702. DOI:10.1007/s00726-008-0052-7.
[5] HUANG Ying, SHAO Xiaomei, NEU J. Immunonutrients and neonates[J]. European Journal of Pediatrics, 2003, 162(3): 122-128.DOI:10.1007/s00431-002-1128-0.
[6] WANG Xiaoqiu, WU Weizong, LIN Gang, et al. Temporal proteomic analysis reveals continuous impairment of intestinal development in neonatal piglets with intrauterine growth restriction[J]. Journal of Proteome Research, 2010, 9(2): 924-935. DOI:10.1021/pr900747d.
[7] TRAHAIR J F, DEBARRO T M, ROBINSON J S, et al. Restriction of nutrition in utero selectively inhibits gastrointestinal growth in fetal sheep[J]. Journal of Nutrition, 1997, 127(4): 637-641. DOI:10.1093/jn/127.4.637.
[8] WANG Yuanxiao, ZHANG Lili, ZHOU Genlai, et al. Dietary L-arginine supplementation improves the intestinal development through increasing mucosal Akt and mammalian target of rapamycin signals in intra-uterine growth retarded piglets[J]. British Journal of Nutrition, 2012, 108(8): 1371-1381. DOI:10.1017/S0007114511006763.
[9] WANG W W, QIAO S Y, LI D F. Amino acids and gut function[J].Amino Acids, 2009, 37(1): 105-110. DOI:10.1007/s00726-008-0152-4.
[10] MASTROTOTARO L, SPONDER G, SAREMI B, et al.Gastrointestinal methionine shuttle: priority handling of precious goods[J]. IUBMB Life, 2016, 68(12): 924-934. DOI:10.1002/iub.1571.
[11] MÉTAYER S, SEILIEZ I, COLLIN A, et al. Mechanisms through which sulfur amino acids control protein metabolism and oxidative status[J]. Journal of Nutritional Biochemistry, 2008, 19(4): 207-215.DOI:10.1016/j.jnutbio.2007.05.006.
[12] VAN BRUMMELEN R, DU TOIT D. L-methionine as immune supportive supplement: a clinical evaluation[J]. Amino Acids, 2007,33(1): 157-163. DOI:10.1007/s00726-006-0390-2.
[13] WU Pengfei, LONG Lihong, ZENG Jianhua, et al. Protection of L-methionine against H2O2-induced oxidative damage in mitochondria[J]. Food and Chemical Toxicology, 2012, 50(8):2729-2735. DOI:10.1016/j.fct.2012.04.047.
[14] NKABYO Y S, GU L H, JONES D P, et al. Thiol/disulfide redox status is oxidized in plasma and small intestinal and colonic mucosa of rats with inadequate sulfur amino acid intake[J]. Journal of Nutrition,2006, 136(5): 1242-1248. DOI:10.1093/jn/136.5.1242.
[15] BAUCHART-THEVRET C, STOLL B, CHACKO S, et al. Sulfur amino acid deficiency upregulates intestinal methionine cycle activity and suppresses epithelial growth in neonatal pigs[J]. American Journal of Physiology Endocrinology and Metabolism, 2009, 296(6): 1239-1250. DOI:10.1152/ajpendo.91021.2008.
[16] BAUCHART-THEVRET C, STOLL B, BURRIN D G. Intestinal metabolism of sulfur amino acids[J]. Nutrition Research Reviews,2009, 22(2): 175-187. DOI:10.1017/S0954422409990138.
[17] FERENC K, PIETRZAK P, GODLEWSKI M M, et al. Intrauterine growth retarded piglet as a model for humans-studies on the perinatal development of the gut structure and function[J]. Reproductive Biology, 2014, 14(1): 51-60. DOI:10.1016/j.repbio.2014.01.005.
[18] WANG Tian, HUO Yongjiu, SHI Fangxiong, et al. Effects of intrauterine growth retardation on development of the gastrointestinal tract in neonatal pigs[J]. Biology of the Neonate, 2005, 88(1): 66-72.DOI:10.1159/000084645.
[19] D'INCA R, KLOAREG M, GRAS-LE GUEN C, et al. Intrauterine growth restriction modifies the developmental pattern of intestinal structure, transcriptomic profile, and bacterial colonization in neonatal pigs[J]. Journal of Nutrition, 2010, 140(5): 925-931. DOI:10.3945/jn.109.116822.
[20] National Research Council. Nutrient requirements of swine[M].Washington D. C.: National Academy Press, 2012: 208-367.
[21] DONG Li, ZHONG Xiang, HE Jintian, et al. Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growth-restricted piglets[J]. Clinical Nutrition,2016, 35(2): 399-407. DOI:10.1016/j.clnu.2015.03.002.
[22] PLACER Z A, CUSHMAN L L, JOHNSON B C. Estimation of product of lipid peroxidation (malonyl dialdehyde) in biochemical systems[J]. Analytical Biochemistry, 1966, 16(2): 359-364.DOI:10.1016/0003-2697(66)90167-9.
[23] GANHÃO R, MORCUENDE D, ESTÉVEZ M. Protein oxidation in emulsified cooked burger patties with added fruit extracts: influence on colour and texture deterioration during chill storage[J]. Meat Science,2010, 85(3): 402-409. DOI:10.1016/j.meatsci.2010.02.008.
[24] SUN Yi, OBERLEY L W, LI Ying. A simple method for clinical assay of superoxide dismutase[J]. Clinical Chemistry, 1988, 34(3): 497-500.
[25] HAFEMAN D G, SUNDE R A, HOEKSTRA W G. Effect of dietary selenium on erythrocyte and liver glutathione peroxidase in the rat[J]. Journal of Nutrition, 1974, 104(5): 580-587. DOI:10.1093/jn/104.5.580.
[26] TIETZE F. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione: applications to mammalian blood and other tissues[J]. Analytical Biochemistry, 1969,27(3): 502-522. DOI:10.1016/0003-2697(69)90064-5.
[27] CARLBERG I, MANNERVIK B. Glutathione reductase[J].Methods in Enzymology, 1985, 113: 484-490. DOI:10.1016/s0076-6879(85)13062-4.
[28] 王远孝. IUGR猪的生长与肠道发育及L-精氨酸和大豆卵磷脂的营养调控研究[D]. 南京: 南京农业大学, 2011: 61-94.
[29] FANG Zhengfeng, YAO Kang, ZHANG Xiaoling, et al. Nutrition and health relevant regulation of intestinal sulfur amino acid metabolism[J]. Amino Acids, 2010, 39(3): 633-640. DOI:10.1007/s00726-010-0502-x.
[30] BENEVENGA N J, STEELE R D. Adverse effects of excessive consumption of amino acids[J]. Annual Review of Nutrition, 1984,4(1): 157-181. DOI:10.1146/annurev.nu.04.070184.001105.
[31] GOMEZ J, CARO P, SANCHEZ I, et al. Effect of methionine dietary supplementation on mitochondrial oxygen radical generation and oxidative DNA damage in rat liver and heart[J]. Journal of Bioenergetics and Biomembranes, 2009, 41(3): 309-321.DOI:10.1007/s10863-009-9229-3.
[32] GARLICK P J. Toxicity of methionine in humans[J]. Journal of Nutrition, 2006, 136(6): 1722S-1725S. DOI:10.1093/jn/136.6.1722s.
[33] WANG Bin, WU Guoyao, ZHOU Zhigang, et al. Glutamine and intestinal barrier function[J]. Amino Acids, 2015, 47(10): 2143-2154.DOI:10.1007/s00726-014-1773-4.
[34] CHEN Ying, LI Defa, DAI Zhaolai, et al. L-methionine supplementation maintains the integrity and barrier function of the small-intestinal mucosa in post-weaning piglets[J]. Amino Acids,2014, 46(4): 1131-1142. DOI:10.1007/s00726-014-1675-5.
[35] CUMMINS A G, STEELE T W, LABROOY J T, et al. Maturation of the rat small intestine at weaning: changes in epithelial cell kinetics,bacterial flora, and mucosal immune activity[J]. Gut, 1988, 29(12):1672-1679. DOI:10.1136/gut.29.12.1672.
[36] ULLUWISHEWA D, ANDERSON R C, MCNABB W C, et al.Regulation of tight junction permeability by intestinal bacteria and dietary components[J]. Journal of Nutrition, 2011, 141(5): 769-776.DOI:10.3945/jn.110.135657.
[37] HIRASE T, STADDON J M, SAITOU M, et al. Occludin as a possible determinant of tight junction permeability in endothelial cells[J].Journal of Cell Science, 1997, 110(14): 1603-1613.
[38] WALSH S V, HOPKINS A M, NUSRAT A. Modulation of tight junction structure and function by cytokines[J]. Advanced Drug Delivery Reviews,2000, 41(3): 303-313. DOI:10.1016/s0169-409x(00)00048-x.
[39] WANG Wei, DEGROOTE J, VAN GINNEKEN C, et al. Intrauterine growth restriction in neonatal piglets affects small intestinal mucosal permeability and mRNA expression of redox-sensitive genes[J].FASEB Journal, 2016, 30(2): 863-873. DOI:10.1096/fj.15-274779.
[40] DURACKOVÁ Z. Some current insights into oxidative stress[J].Physiological Research, 2010, 59(4): 459-469.
[41] YU B P. Cellular defenses against damage from reactive oxygen species[J]. Physiological Reviews, 1994, 74(1): 139-162.DOI:10.1152/physrev.1994.74.1.139.
[42] KAMATH U, RAO G, KAMATH S U, et al. Maternal and fetal indicators of oxidative stress during intrauterine growth retardation(IUGR)[J]. Indian Journal of Clinical Biochemistry, 2006, 21(1):111-115. DOI:10.1007/BF02913077.
[43] MATEOS R, LECUMBERRI E, RAMOS S, et al. Determination of malondialdehyde (MDA) by high-performance liquid chromatography in serum and liver as a biomarker for oxidative stress : application to a rat model for hypercholesterolemia and evaluation of the effect of diets rich in phenolic antioxidants from fruits[J]. Journal of Chromatography B, 2005, 827(1): 76-82. DOI:10.1016/j.jchromb.2005.06.035.
[44] ZELKO I N, MARIANI T J, FOLZ R J. Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1),Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression[J]. Free Radical Biology and Medicine, 2002, 33(3): 337-349.DOI:10.1016/S0891-5849(02)00905-X.
[45] FORMAN H J, ZHANG H, RINNA A. Glutathione: overview of its protective roles, measurement, and biosynthesis[J]. Molecular Aspects of Medicine, 2009, 30(1/2): 1-12. DOI:10.1016/j.mam.2008.08.006.
[46] WU Guoyao, FANG Yunzhong, YANG Sheng, et al. Glutathione metabolism and its implications for health[J]. Journal of Nutrition,2004, 134(3): 489-492. DOI:10.1093/jn/134.3.489.
[47] SHOVELLER A K, STOLL B, BALL R O, et al. Nutritional and functional importance of intestinal sulfur amino acid metabolism[J].Journal of Nutrition, 2005, 135(7): 1609-1612. DOI:10.1093/jn/135.7.1609.
