南极磷虾抗冻蛋白热滞活性的差示扫描量热法评价
2018-06-19马庆保刘志东
马庆保,刘志东*
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学食品学院,上海 201306)
生活于低温环境的生物体,为了抵御低温胁迫,会适应性地产生一种具有抗冻活性的特殊蛋白质——抗冻蛋白(antifreeze proteins,AFPs),亦称为冰结合蛋白或冰结构蛋白。AFPs是一类以非依数性形式降低体系冰点、改变冰晶形态、抑制冰晶生长、防止冰晶对生物体细胞造成的损伤和致死的特殊蛋白质[1]。AFPs能够降低体系的冰点,但对体系的融点却影响较小;因此,导致了体系的融点和冰点出现差值,这个差值称为热滞活性(thermal hysteresis activity,THA)[2]。
THA是评价AFP抗冻活性的重要指标,目前评价THA的方法主要有毛细管单晶生长观察法,纳升渗透压法和差示扫描量热(differential scanning calorimetry,DSC)法等。毛细管单晶生长观察法是最早用于THA测定的方法,该法不需要大型的仪器设备,但操作过程较复杂、耗时长,而且人为误差较大[3-4]。纳升渗透压法主要基于珀尔帖原理实现控温[5-8],但该法依然依靠人工观察完成,容易出现误差,温度的变化速率和波动也无法实现精准的控制[4]。DSC法主要是基于样品结晶过程中吸热和放热的变化,检测体系发生的物理变化,精确迅速测定热容和热焓,从而确定真实的结晶起始温度,进而获得样品的THA,并能精确测定体系的冰晶含量[9]。DSC法能够精确测定体系的吸热和放热,反映AFPs特殊的相变和热力学行为。DSC法因其稳定性和精确性,得到了越来越广泛的应用[10-11]。
南极磷虾(Euphausia superba Dana)是一种生活在南极海域的小型浮游类海洋动物,生物量巨大(约为6.5亿~10.0亿 t)[12-15]。因此,南极磷虾己经成为近年来食品科学等学科的研究热点[16]。南极磷虾生活于南极海域冰冷的海水中(水温约为-1.9 ℃)[17],研究表明南极磷虾主要依靠AFPs应对南极海域的低温胁迫[17-18]。作为一种潜在、广泛的天然AFPs来源,南极磷虾AFPs具有重要的应用前景;对于提高南极磷虾附加值也具有重要意义。本实验以纯化的南极磷虾AFPs为研究对象,采用DSC法评价其THA;重点考察了升降温速率、南极磷虾AFPs质量浓度、冰晶含量、缓冲体系等参数对THA的影响,以为AFPs的评价研究及抗冻机理提供基础信息。
1 材料与方法
1.1 材料与试剂
南极磷虾由上海开创远洋渔业有限公司2016年11月于南极设得兰群岛海域捕获,冷藏运回国内,实验室于-80 ℃贮藏备用;牛血清白蛋白(bovine serum albumin,BSA) 国药集团化学试剂有限公司;标准蛋白Marker 美国Bio-Rad公司。
1.2 仪器与设备
FreeZone真空冷冻干燥机 美国LABCONCO公司;204 F1 DSC仪 德国NETZSCH公司;电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 南极磷虾AFPs的提取
以南极磷虾蛋白为原料提取南极磷虾AFPs,参照Kuiper等[19]方法构建特异性亲和吸附法提取南极磷虾AFPs,将提取的南极磷虾AFPs进行真空冷冻干燥。采用pH 7.8的磷酸盐缓冲液(phosphate buffered saline,PBS)分别配制不同质量浓度的AFPs溶液和BSA溶液。
1.3.2 南极磷虾AFPs的SDS-PAGE电泳
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)进行南极磷虾AFPs的纯度鉴定,按照5∶1(V/V)的比例将样品与上样缓冲液混合,置于沸水中煮沸5 min,取15 μL样品上样,12.5%分离胶和4.0%浓缩胶,样品在120 V恒压条件下进行电泳。电泳完毕后,将凝胶置于质量分数0.4%的考马斯亮蓝R-250中染色2 h,在醋酸脱色液中脱色至背景无色,采用凝胶分析仪进行拍照。
1.3.3 DSC法测定样品的THA
采用DSC法测定南极磷虾AFPs的THA,以BSA为对照。参照Ding Xiangli等[20]的方法稍作改动。将10 μL质量浓度为1.0 mg/mL的南极磷虾AFPs密封于铝制坩埚中,放置在样品池中央,以空铝皿为参比。设备稳定后,以1.0 ℃/min的升降温速率从室温降温至-30 ℃,然后升温至20 ℃,再降温至-30 ℃,获得南极磷虾AFPs的熔融焓(ΔHm)和熔点(Tm)。接着,从-30 ℃缓慢升温至样品体系为固液混合物状态,称为保留温度(Th),停留5 min,使冰晶完全孵化,再将温度从Th降低至-30 ℃,重复上述过程,在不同的Th下停留5 min。记录不同Th下,样品结晶的起始温度(T0)和结晶焓(ΔHf)。按照公式(1)和(2)计算样品的THA和冰晶含量。

1.3.4 DSC法测定THA条件的优化
参照文献[10],考察DSC法测定南极磷虾AFPs的THA影响因素,优化其评价条件以获得最佳的测定条件。
1.3.4.1 升降温速率对THA评价的影响
分别选取升降温速率为0.50、0.75、1.00、2.50、5.00 ℃/min,南极磷虾AFPs质量浓度为1.0 mg/mL,以PBS为缓冲体系开展实验。以THA为评价指标,考察升降温速率对南极磷虾AFPs的THA的影响。
1.3.4.2 南极磷虾AFPs质量浓度对THA评价的影响
分别选取南极磷虾AFPs质量浓度为0.1、0.5、1.0、2.5、5.0 mg/mL,升降温速率为1 ℃/min,以PBS为缓冲体系开展实验。以THA为评价指标,考察南极磷虾AFPs质量浓度对THA评价的影响。
1.3.4.3 冰晶含量对THA评价的影响
采用DSC法测定THA时,冰晶含量与Th有着密切的关系,Th越接近平衡熔点,冰晶含量就越小。因此,分别选取-2.3~-3.0 ℃间不同的Th,南极磷虾AFPs质量浓度为1.0 mg/mL,升降温速率为1 ℃/min,以PBS为缓冲体系开展实验。以THA为评价指标,考察冰晶含量对THA评价的影响。
1.3.4.4 缓冲体系对THA评价的影响
将南极磷虾AFPs分别溶解于水、PBS、Tris-盐酸不同的缓冲体系,并以BSA为对照,南极磷虾AFPs质量浓度为1.0 mg/mL,升降温速率为1 ℃/min开展实验。以THA为评价指标,考察缓冲体系对THA评价的影响。
2 结果与分析
2.1 SDS-PAGE对南极磷虾AFPs分子质量及纯度的鉴定
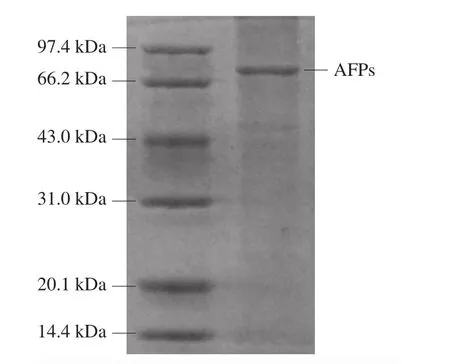
图1 南极磷虾AFPs的SDS-PAGE图Fig. 1 SDS-PAGE profile of AFPs
通过SDS-PAGE对南极磷虾AFPs的分子质量及纯度进行鉴定,由图1可知,样品呈现单一条带,无其他杂带。结果表明,所提取的南极磷虾AFPs具有较高的纯度,分子质量约为76 kDa。
2.2 南极磷虾AFPs的THA
由图2和表1可知,AFPs由完全结冰被加热到不同的保留温度Th,从不同Th开始降温时,已融化的部分没有立即结冰,而是出现了冰点的滞后现象,Th与T0之间相差较大,这表明南极磷虾AFPs具有THA。而BSA从不同Th开始降温时,已融化的部分立即结冰,Th等于T0,没有出现冰点的滞后现象,即BSA没有表现出THA。因此,DSC法可以用于测定南极磷虾AFPs的THA。冰晶含量为11.02%时,南极磷虾AFPs的THA为1.76 ℃。
由图2A和表1也可知,随着Th的升高,冰晶含量不断的下降,南极磷虾AFPs的THA呈现升高趋势,Th为-2.60 ℃时,冰晶含量为5.79 %,THA达到了2.74 ℃,此时的THA可能是由于过冷现象造成的。冰晶结晶过程中,是以体系中已含有的冰晶为冰核开始结晶,体系中冰晶含量越少,冰晶表面AFPs的吸附覆盖程度越高,AFPs抑制冰晶继续生长的作用就越强,其溶液完全结晶所需的时间就越长,测得的THA也就越高[21]。但若AFPs溶液中任意一个区域内都没有形成至少一个足够大的冰核,此时水分子无法包围着晶核结冰,使得溶液出现过冷现象,从而造成冰点比熔点低很多,但此时所测定的冰点并没有真实地反映南极磷虾AFPs的THA。

图2 AFPs与BSA的DSC热流曲线Fig. 2 DSC curves of partially melted AFPs and BSA

表1 AFPs与BSA的Th、T0、冰晶含量和THATable 1 Hold and onset temperature (Th and T0), ice fraction and THA of AFPs and BSA
2.3 DSC法测定THA的条件优化
DSC法是一种热分析方法,能够通过测定升、降温过程中热焓的变化直接反映样品冰点与熔点之间的差异,获得其THA。这种方法避免了直接观察法容易引入人为误差的缺陷[21]。但是由于AFPs来源和特性的不同,采用DSC法测定AFPs是的THA时,可能受到一些因素的影响,如样品质量浓度、升降温速率、冰晶含量和缓冲体系等的影响。因此,需要对其评价条件进行优化[22-23]。
2.3.1 升降温速率对THA的影响
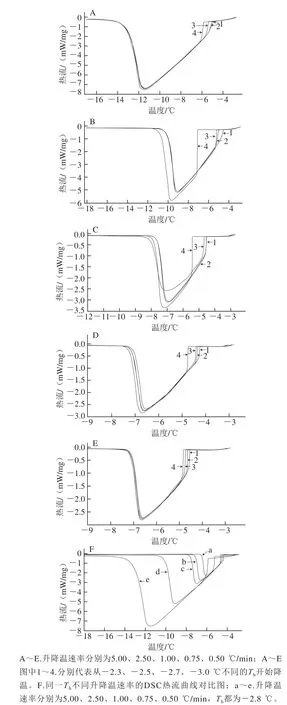
图3 不同升降温速率下AFPs的DSC热流曲线图Fig. 3 DSC curves of AFPs at different cooling rates
从图3中可以看出,除过冷状态,当升降温速率为5.00 ℃/min时,THA都超过2 ℃。如图3A所示,Th为-2.30 ℃,THA为2.92 ℃;当升降温速率为2.50 ℃/min时,THA在2.00 ℃左右;而当升降温速率为1.00、0.75、0.50 ℃/min时,如图3F所示,THA都稳定在1.70 ℃左右。因此,当升降温速率较快时,THA呈现被升高状态,这可能是由于过高的升降温速率使得体系的换热不充分,冰晶冻结的滞后现象被放大[11],热流曲线图上的表现为在-10 ℃以下,体系依然处于结晶状态。
当升降温速率为0.50~1.00 ℃/min时,样品结晶时放热处于相对正常的范围,体系换热充分。因此,能够测得相对稳定的南极磷虾AFPs的THA。但升降温的速率过低,耗时太长,因此,选择1.00 ℃/min作为升降温速率较为合适。这也与多数研究中选择的升降温速率相吻合[24-26]。
2.3.2 样品质量浓度对THA的影响表2 不同质量浓度AFPs的Th、T0、冰晶含量和THA

图4 不同质量浓度AFPs的DSC热流曲线图Fig. 4 DSC curves of AFPs at different concentrations

表2 不同质量浓度AFPs的Th、T0、冰晶含量和THATable 2 Th, T0, ice fractions and THA of AFPs at different concentrations
由图4和表2可知,随着南极磷虾AFPs质量浓度的增加,THA先快速升高;当样品质量浓度达到1.0 mg/mL后,THA的变化趋向于平稳,THA的增量收窄。因此,南极磷虾AFPs的THA在一定的范围内呈质量浓度依赖关系。其他研究也表明,部分AFPs的THA具有质量浓度依赖性,THA不仅需要AFPs分子吸附于冰晶上,还需要溶液中有自由AFPs分子的存在[27-30]。基于吸附抑制机理可知,AFPs吸附于冰晶的部分表面,而非整个表面,以一种类似网状结构形式存在,AFPs分子彼此之间存在一定的间隔[31-33]。AFPs会改变冰水界面的局部表面张力,干扰其所覆盖的冰晶生长,使得其所覆盖区域的冰晶生长受到抑制,而其他区域不受抑制[34]。当所吸附的AFPs彼此之间的平均间隔等于或小于两倍的冰晶冰峰临界曲率半径时,冰晶的生长就会受到抑制。因此,如果AFPs的质量浓度过低,形成的网状结构AFPs分子之间的距离过大,冰晶生长的抑制效果就会较差,THA表现的较低。
目前的研究也表明,在某些AFPs(如鱼类AFPs)中,THA与AFPs分子和冰晶面的结合速率以及其质量浓度密切相关,THA在一定的质量浓度范围内呈依赖关系,通常与AFPs质量浓度的平方根成正比[1,30,35]。而对于高活性AFPs(如昆虫AFPs),其能够与冰晶的基面结合[36-37],当将吸附了AFPs分子的冰晶周围环境的AFPs除去后,THA依然保持不变,这表明,其THA不直接依赖于溶液中的AFPs的质量浓度,而与AFPs分子在冰晶面上的表面密度相关[1,34,38]。
2.3.3 冰晶含量对THA的影响
研究表明,冰晶的含量与粒径会对THA产生影响[39-40]。当冰晶的含量和粒径足够小时,冰晶所吸附的AFPs的数量很少。因此,当THA评价时剩余样品溶液中AFPs的质量浓度保持相对稳定,若冰晶含量或粒径过大,剩余样品溶液中AFPs的质量浓度因大量吸附而降低,AFPs在冰晶表面的吸附度会降低,这将导致THA的降低[27]。采用传统方法或者纳升渗透压计法测定AFPs的THA时,体系中都是仅保留一个冰晶,通过显微镜观察冰晶的生长情况,以获得样品的THA,尽量降低冰晶含量和粒径对THA的影响,存在人为误差。采用DSC法测定时,虽然无法直接观察到冰晶的情况,但可以通过计算(公式2)获得样品中的冰晶含量。
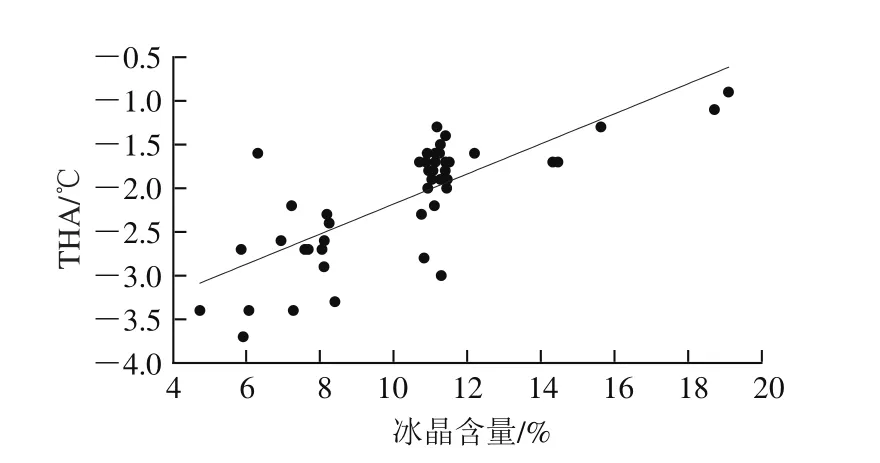
图5 不同Th下样品的冰晶含量与THA间的关系Fig. 5 Relationship between ice crystal fraction and THA of AFPs at different Th
先前的研究指出,冰晶含量在0.13%~10.00%间,THA与冰晶含量呈现幂指数函数的增长关系[40],而当冰晶含量在10%~90%时,THA就会呈现相对稳定的数值[11,20]。由图5可知,当冰晶含量低于4%时,出现样品的过冷现象,即样品在零下十几度才会出现结晶现象,不能将其用于真实THA的计算。相反,当冰晶含量高于20%时,样品立刻结冰,检测不到THA;冰晶含量在4%~20%之间时,THA呈现下降趋势;冰晶含量为4%~10%之间时,THA普遍超过2 ℃,这可能是由于部分过冷造成;冰晶含量在10%~15%之间时,THA最为稳定,在1.7 ℃附近波动;随着冰晶含量的继续升高,THA开始降低。因此,冰晶含量应在10%~15%之间,这也与Ding Xiangli等[20]的研究结果相近。
2.3.4 缓冲体系对THA的影响
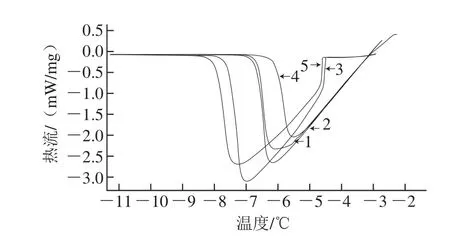
图6 不同缓冲体系中南极磷虾AFPs和BSA的DSC热流曲线图Fig. 6 DSC curves of AFPs and BSA in different buffer systems

表3 不同缓冲体系AFPs样品与BSA的Th、T0、冰晶含量和THATable 3 Th, T0, ice fractions and THA of AFPs and BSA in different buffer systems
采用了不同的缓冲体系,如Tris-盐酸缓冲液(pH 8.0)[41]、PBS(pH 7.4)[24]开展相关实验。不同缓冲体系对南极磷虾AFPs THA的影响如图6和表3所示。BSA无论在任何缓冲体系中都没有表现出THA,南极磷虾AFPs在水中的THA仅为0.08 ℃,在pH值都为7.8的PBS缓冲液和Tris-盐酸缓冲液,THA较为接近,分别为1.62、1.67 ℃,这表明不同缓冲体系能够影响AFPs的THA。
研究表明AFPs的冰晶结合位点是相对疏水的,将AFPs溶解于水中,其冰晶结合位点可能无法完全展开,活性因此受到抑制,引起THA的下降[42-43]。此外,低分子质量的溶质以及盐离子可能也会对THA造成影响[44-49],通常,能够将AFPs的THA提高数倍[44],如Xu Yao等[29]将AFP-Ⅲ样品分别溶于水和0.5 mol/L的柠檬酸钠溶液,溶于水中的AFP-Ⅲ样品的THA呈线性下降。即使是同一种缓冲液,体系pH值的影响也较大,如Tris-盐酸缓冲液,体系pH值为7.2[50]、7.5[51]、8.0[41]等,但都为偏碱性的条件。盐离子及pH值对南极磷虾AFPs的THA的确切影响,在后面的实验中将会重点考察。
3 结 论
本实验以纯化的南极磷虾AFPs为研究对象,采用DSC法评价了影响其THA的因素。研究结果表明,南极磷虾AFPs的分子质量约为76 kDa,THA为1.76 ℃。优化确定DSC法评价南极磷虾AFPs的THA升降温速率为1.00 ℃/min,样品质量浓度为1.0 mg/mL,冰晶含量为10%~15%之间。此外,缓冲体系对THA也有较大的影响,通常选择偏碱性的缓冲溶液体系。盐离子含量、种类及体系pH值等对南极磷虾AFPs的THA影响仍待后续深入研究。
[1] BAR DOLEV M, BRASLAVSKY I, DAVIES P L. Ice-binding proteins and their function[J]. Annual Review of Biochemistry, 2016,85: 515-542. DOI:10.1146/annurev-biochem-060815-014546.
[2] DAVIES P L. Ice-binding proteins: a remarkable diversity of structures for stopping and starting ice growth[J]. Trends in Biochemical Sciences, 2014, 39(11): 548-555. DOI:10.1016/j.tibs.2014.09.005.
[3] DEVRIES A L. Glycoproteins as biological antifreeze agents in Antarctic fishes[J]. Science, 1971, 172: 1152-1155. DOI:10.1126/science.172.3988.1152.
[4] 刘志东, 马庆保, 陈雪忠. 抗冻蛋白抗冻活性评价方法的研究进[J].天然产物研究与开发, 2017, 29(1): 176-181.
[5] CULLINS T L, DEVRIES A L, TORRES J J. Antifreeze proteins in pelagic fishes from Marguerite Bay (Western Antarctica)[J].Deep Sea Research Part II: Topical Studies in Oceanography, 2011,58(13/14/15/16): 1690-1694. DOI:10.1016/j.dsr2.2009.05.034.
[6] NICKELL P K, SASS S, VERLEYE D, et al. Antifreeze proteins in the primary urine of larvae of the beetle Dendroides canadensis[J]. Journal of Experimental Biology, 2013, 216(9): 1695-1703. DOI:10.1242/jeb.082461.
[7] BA Y, MAO Y, GALDINO L, et al. Effects of a type I antifreeze protein (AFP) on the melting of frozen AFP and AFP + solute aqueous solutions studied by NMR microimaging experiment[J]. Journal of Biological Physics, 2013, 39(1): 131-144. DOI:10.1007/s10867-012-9291-7.
[8] 邵强, 李海峰, 刘国生, 等. 抗冻蛋白的抗冻活性及其测定方法[J].平原大学学报, 2005, 22(4): 111-113.
[9] ZHANG C, ZHANG H, WANG L. Eあect of carrot (Daucus carota)antifreeze proteins on the fermentation capacity of frozen dough[J].Food Research International, 2007, 40(6): 763-769. DOI:10.1016/j.foodres.2007.01.006.
[10] HASSAROUDSARI M, GOFF H D. A new quantitative method to measure activity of ice structuring proteins using diあerential scanning calorimetry[J]. Cryo Letters, 2012, 33(2): 118-125.
[11] 张超, 赵晓燕, 马越, 等. 使用差示扫描量热仪测定抗冻蛋白热滞活性方法的研究[J]. 生物物理学报, 2008, 24(6): 465-73.
[12] BURRI L, JOHNSEN L. Krill products: an overview of animal studies[J]. Nutrients, 2015, 7(5): 3300-3321. DOI:10.3390/nu7053300.
[13] 刘志东, 陈雪忠, 黄洪亮, 等. 南极磷虾粉的营养成分分析及评价[J].中国海洋药物, 2012, 31(2): 43-48.
[14] QI X M, LIAO E, WANG L, et al. Extracting protein from Antarctic krill (Euphausia superba)[J]. Journal of Aquatic Food Product Technology,2015, 25(4): 597-606. DOI:10.1080/10498850.2014.904461.
[15] NICOL S, FOSTER J, KAWAGUCHI S. The fishery for Antarctic krill: recent developments[J]. Fish and Fisheries, 2012, 13(1): 30-40.DOI:10.1111/j.1467-2979.2011.00406.x.
[16] 杨洋, 刘晓芳. 南极磷虾主要营养成分及保健机能研究进展[J]. 大连医科大学学报, 2014, 36(2): 186-189; 194.
[17] FIELDS L G, DEVRIES A L. Variation in blood serum antifreeze activity of Antarctic Trematomus fishes across habitat temperature and depth[J]. Comparative Biochemistry and Physiology-Part A:Molecular & Integrative Physiology, 2015, 185: 43-50. DOI:10.1016/j.cbpa.2015.03.006.
[18] 马庆保, 陈雪忠, 刘志东, 等. 南极磷虾抗冻蛋白的特异性亲和吸附提取研究[J]. 食品工业科技, 2016, 37(23): 183-188.
[19] KUIPER M J, LANKIN C, GAUTHIER S Y, et al. Purification of antifreeze proteins by adsorption to ice[J]. Biochemical and Biophysical Research Communications, 2003, 300(3): 645-648.DOI:10.1016/s0006-291x(02)02900-5.
[20] DING Xiangli, ZHANG Hui, CHEN Haiying, et al. Extraction,purification and identification of antifreeze proteins from cold acclimated malting barley (Hordeum vulgare L.)[J]. Food Chemistry,2015, 175: 74-81. DOI:10.1016/j.foodchem.2014.11.027.
[21] 朱玉兵, 曹慧, 徐斐, 等. 应用差示扫描量热法测定胶原蛋白热滞活性[J]. 食品与发酵工业, 2013, 39(10): 63-68.
[22] HANSEN T N, BAUST J G. Differential scanning calorimetric analysis of Tenebrio molitor antifreeze protein activity[J]. Cryobiology,1989, 26(4): 383-388. DOI:10.1016/0167-4838(88)90275-0.
[23] HANSEN T N, BAUST J G. Differential scanning calorimetric analysis of antifreeze protein activity in the common mealworm,Tenebrio molitor[J]. Biochimica et Biophysica Acta, 1988, 957(2):217-221. DOI:10.1016/0167-4838(88)90275-0.
[24] ZHANG Y J, ZHANG H, WANG L, et al. Extraction of oat (Avena sativa L.) antifreeze proteins and evaluation of their eあects on frozen dough and steamed bread[J]. Food and Bioprocess Technology, 2015,8(10): 2066-2075. DOI:10.1007/s11947-015-1560-6.
[25] LIU Z, LI H, PANG H, et al. Enhancement effect of solutes of low molecular mass on the insect antifreeze protein ApAFP752 from Anatolica polita[J]. Journal of Thermal Analysis and Calorimetry,2014, 120(1): 307-315. DOI:10.1007/s10973-014-4171-y.
[26] CAI Y J, LIU S, LIAO X R, et al. Purification and partial characterization of antifreeze proteins from leaves of Ligustrum lucidum Ait[J]. Food and Bioproducts Processing, 2011, 89(2): 98-102.DOI:10.1016/j.fbp.2010.04.002.
[27] KUBOTA N. Effects of cooling rate, annealing time and biological antifreeze concentration on thermal hysteresis reading[J]. Cryobiology,2011, 63(3): 198-209. DOI:10.1016/j.cryobiol.2011.06.005.
[28] XIAO N, HANADA Y, SEKI H, et al. Annealing condition influences thermal hysteresis of fungal type ice-binding proteins[J]. Cryobiology,2014, 68(1): 159-161. DOI:10.1016/j.cryobiol.2013.10.008.
[29] XU Yao, BÄUMER A, MEISTER K, et al. Protein-water dynamics in antifreeze protein III activity[J]. Chemical Physics Letters, 2016, 647:1-6. DOI:10.1016/j.cplett.2015.11.030.
[30] KNIGHT C A, DEVRIES A L. Ice growth in supercooled solutions of a biological “antifreeze”, AFGP 1-5: an explanation in terms of adsorption rate for the concentration dependence of the freezing point[J].Physical Chemistry Chemical Physics, 2009, 11(27): 5749-5761.
[31] RAYMOND J A, DEVRIES A L. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1977,74(6): 2589-2593.
[32] KNIGHT C A. Adding to the antifreeze agenda[J]. Nature, 2000, 406:249-251. DOI:10.1038/35018671.
[33] YANG C, SHARP K A. The mechanism of the type III antifreeze protein action: a computational study[J]. Biophysical Chemistry, 2004,109(1): 137-148. DOI:10.1016/j.bpc.2003.10.024.
[34] DRORI R, DAVIES P L, BRASLAVSKY I. Experimental correlation between thermal hysteresis activity and the distance between antifreeze proteins on an ice surface[J]. Royal Society of Chemistry Advances,2015, 5(11): 7848-7853. DOI:10.1039/c4ra12638f.
[35] WEN D, LAURSEN R A. Structure-function relationships in an antifreeze polypeptide. the effect of added bulky groups on activity[J].Journal of Biological Chemistry, 1993, 268(22): 16396-16400.
[36] RAN D, CELIK Y, DAVIES P L, et al. Ice-binding proteins that accumulate on different ice crystal planesproduce distinct thermal hysteresis dynamics[J]. Journal of the Royal Society Interface, 2014,11(98): 1-9. DOI:10.1098/rsif.2014.0526.
[37] PERTAYA N, MARSHALL C B, CELIK Y, et al. Direct visualization of spruce budworm antifreeze protein interacting with ice crystals:basal plane affinity confers hyperactivity[J]. Biophysical Journal,2008, 95(1): 333-341. DOI:10.1529/biophysj.107.125328.
[38] RAN D, DAVIES P L, BRASLAVSKY I. When are antifreeze proteins in solution essential for ice growth inhibition?[J]. Langmuir,2015, 31(21): 5805-5811. DOI:10.1021/acs.langmuir.5b00345.
[39] ZACHARIASSEN K E, DEVRIES A L, HUNT B, et al. Effect of ice fraction and dilution factor on the antifreeze activity in the hemolymph of the cerambycid beetle Rhagium inquisitor[J]. Cryobiology, 2002,44(2): 132-141. DOI:10.1016/S0011-2240(02)00014-7.
[40] TAKAMICHI M, NISHIMIYA Y, MIURA A, et al. Effect of annealing time of an ice crystal on the activity of type III antifreeze protein[J]. Journal of Federation of European Biochemical Societies,2007, 274(24): 6469-6476. DOI:10.1111/j.1742-4658.2007.06164.x.
[41] CAO H, ZHAO Y, ZHU Y B, et al. Antifreeze and cryoprotective activities of ice-binding collagen peptides from pig skin[J].Food Chemistry, 2016, 194: 1245-1253. DOI:10.1016/j.foodchem.2015.08.102.
[42] ANTSON A A, SMITH D J, ROPER D I, et al. Understanding the mechanism of ice binding by type III antifreeze proteins 1[J].Journal of Molecular Biology, 2001, 305(4): 875-889. DOI:10.1006/jmbi.2000.4336.
[43] BAARDSNES J, KONDEJEWSKI L H, HODGES R S, et al. New ice-binding face for type I antifreeze protein[J]. FEBS Letters, 1999,463(1/2): 87-91. DOI:10.1016/S0014-5793(99)01588-4.
[44] LI N, ANDORFER C A, DUMAN J G. Enhancement of insect antifreeze protein activity by solutes of low molecular mass[J]. Journal of Experimental Biology, 1998, 201(15): 2243-2251.
[45] AMORNWITTAWAT N, WANG S, DUMAN J G, et al.Polycarboxylates enhance beetle antifreeze protein activity[J].Biochimica et Biophysica Acta, 2008, 1784(12): 1942-1948.DOI:10.1016/j.bbapap.2008.06.003.
[46] EVANS R P, HOBBS R S, GODDARD S V, et al. The importance of dissolved salts to the in vivo efficacy of antifreeze proteins[J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology,2007, 148(3): 556-561. DOI:10.1016/j.cbpa.2007.07.005.
[47] KRISTIANSEN E, PEDERSEN S A, ZACHARIASSEN K E.Salt-induced enhancement of antifreeze protein activity: a saltingout effect[J]. Cryobiology, 2008, 57(2): 122-129. DOI:10.1016/j.cryobiol.2008.07.001.
[48] AMORNWITTAWAT N, WANG S, BANATLAO J, et al. Effects of polyhydroxy compounds on beetle antifreeze protein activity[J].Biochimica et Biophysica Acta, 2009, 1794(2): 341-346. DOI:10.1016/j.bbapap.2008.10.011.
[49] WEN X, WANG S, AMORNWITTAWAT N, et al. Interaction of reduced nicotinamide adenine dinucleotide with an antifreeze protein from Dendroides canadensis: mechanistic implication of antifreeze activity enhancement[J]. Journal of Molecular Recognition, 2011,24(6): 1025-1032. DOI:10.1002/jmr.1151.
[50] CAO L, HUANG Q, WU Z, et al. Neofunctionalization of zona pellucida proteins enhances freeze-prevention in the eggs of Antarctic notothenioids[J]. Nature Communications, 2016, 7: 1-11.DOI:10.1038/ncomms12987.
[51] JUNG W, GWAK Y, DAVIES P L, et al. Isolation and characterization of antifreeze proteins from the Antarctic marine microalga Pyramimonas gelidicola[J]. Marine Biotechnology, 2014,16(5): 502-512. DOI:10.1007/s10126-014-9567-y.
