清瘟败毒饮及其拆方组对ALI大鼠的干预作用
2018-06-19张旗陈素娟聂静李强
张旗,陈素娟,聂静,李强*
(1.北京中医药大学中药学院,北京 100102;2.福建医科大学药学院,福建 福州 350122)
清瘟败毒饮出自清代著名医家余师愚之《疫疹一得》,由生石膏、知母、甘草、黄连、黄芩、栀子、犀角(以水牛角代替)、生地黄、赤芍、牡丹皮、连翘、玄参、竹叶、桔梗共14味药组成,合白虎汤、黄连解毒汤和犀角地黄汤之意[1]。全方具有清热解毒、凉血泻火的功效,主治热毒充斥、气血两燔证,与ALI早、中期阶段的中医病机颇为吻合,故早期运用清瘟败毒饮能起到良好的治疗效果。在非典以及甲型 H1N1 流感合并呼吸窘迫综合征治疗中,临床证实清瘟败毒饮加减为有效药物,可与西药合用,作用显著[2-4]。张长志等组研究清瘟败毒饮对ALI大鼠炎症因子表达以及肺组织核因子-κB表达的影响。结果清瘟败毒饮可通过有效调节LPS致ALI大鼠血中炎症细胞因子TNF-α、IL-1β、IL-8、 IL-10和抗炎症细胞因子IL-13表达水平,促使炎症和抗炎症细胞因子趋于动态平衡,从而减轻肺部炎症细胞浸润,起到修复和保护损伤肺组织的作用[5],但清瘟败毒饮对水肿抑制情况以及药效物质基础尚未阐明。
本课题已对清瘟败毒饮高、中、低剂量进行剂量考察,结果高、中剂量均能有效降低大鼠ALI损伤情况,且呈剂量依赖性[6]。然而,清瘟败毒饮干预ALI的药效物质基础尚未明确。由于清瘟败毒饮合白虎汤、黄连解毒汤、犀角地黄汤之意,由14味药组成,成分复杂,因此根据其功效对其进一步拆方分析,拆分为4个拆方组,分别为:清热泻火组(C1)、清热凉血组(C2)、清热燥湿组(C3)和其他组(C4),为阐明其药效成分奠定基础。
1 材料与仪器
1.1 实验动物
清洁级SD雄性大鼠70只,体质量200~220 g,购于北京维通利华实验动物技术有限公司,合格证号:NO.11400700130416。
1.2 试剂及主要仪器
大肠杆菌内毒素LPS(L2880,Sigma);TNF-α试剂盒(Abcam);牛血清白蛋白(A7030,pH-7,Sigma);考马斯亮蓝G-250(code:0615,北京拜尔迪生物科技有限公司);吉姆萨染液(北京博奥拓达科技有限公司);MK3型酶标仪(赛默飞仪器有限公司);德国Effendorf 5810R离心机;BX40F4型光学显微镜(OLYMPUS,日本);AxioCam ERC5s成像系统(德国蔡司);地塞米松磷酸钠注射液(天津金耀药业有限公司);BS110S电子天平(北京赛多利斯仪器系统有限公司)。
2 清瘟败毒饮拆方组干预ALI作用
2.1 清瘟败毒饮拆方组的制备
清热泻火组(C1):生石膏30 g,知母15 g,生栀子12 g,竹叶15 g。
清热凉血组(C2):水牛角12 g,生地黄12 g,赤芍15 g,玄参15 g,牡丹皮12 g。
清热燥湿组(C3):黄芩15 g,黄连4.5 g。
其他组(C4):桔梗12 g,连翘15 g,甘草6 g。
10倍量水回流提取3次,每次1 h,过滤,滤液合并,减压浓缩即得拆方组的水提物,浓度分别为0.72 g/ml、0.68 g/ml、0.2 g/ml和0.33 g/ml。
2.2 ALI模型制备
将大鼠随机均分为7组,每组10只:空白组(Con)、模型组(LPS)、阳性组(地塞米松,DEX组)、清热泻火组(C1)、清热凉血组(C2)、清热燥湿组(C3)和其他组(C4)的大鼠颈部正中切口,暴露气管,除Con组外其余各组用1 mL 注射器经气管滴注LPS(5 mg/kg)溶液(生理盐水配制,10 mg/mL),注入后迅速将动物直立并旋转,使药液能够均匀分布在肺中,待大鼠呼吸状态平稳后,再缝合伤口;Con组在同样的条件下,向气管内注入等体积的生理盐水。
2.3 给药方法
在造模前3天灌胃各拆方组的水提物,每日1次,阳性组 (DEX)于造模前1 h 给予地塞米松注射液(5 mg/kg),Con组和LPS组灌胃给予治疗组等量的生理盐水,每日1次。7组动物均在造模12 h后取材。
2.4 指标检测
2.4.1 BALF中白细胞总数和多形核白细胞(PMNs)数
各组大鼠腹主动脉取血处死后,剪开颈、胸部皮肤,暴漏气管并进行气管插管。右肺结扎,左肺进行灌洗,用4℃ PBS 6 mL分3次进行灌洗(灌洗时保证每次打入2 ml、吸出1.5 ml的液体),收集肺泡灌洗液(BALF)置冰上,离心(4℃,1 300 r/min,10 min)后收集上清液,-80℃保存。离心后的沉淀细胞重悬于PBS,白细胞总数以及PMNs采用血液分析仪进行检验。
2.4.2 BALF中肿瘤坏死因子-α(TNF-α)和蛋白浓度的测定
取“2.4.1”项中离心后的肺泡灌洗上清液,采用考马斯亮蓝G-250法对各组大鼠BALF的上清液进行蛋白含量测定。用酶联免疫法测定TNF-α的含量,严格按照试剂盒说明书操作。
2.4.3 肺的湿/干比值(W/D)测定
大鼠麻醉后,取肺的右中叶进行称重(湿重),将其置烘箱中, 60℃烘至恒重,记下干重,计算得出肺的湿/干比值(W/D)。
2.4.4 肺组织病理形态学观察
各组大鼠以腹主动脉取血处死后,取肺右下叶,10%中性福尔马林固定48 h,常规石蜡包埋,切片,HE染色,光镜下观察肺形态学变化。
2.5 统计学处理

3 结果
3.1 清瘟败毒饮拆方组干预LPS诱导ALI大鼠BALF中PMNs浸润情况比较
实验结果显示,空白组的肺泡灌洗液中有极少的PMNs浸润;LPS组PMNs及白细胞总数均较Con组显著增加(P<0.01);而C1、C2与C3组的PMNs及白细胞总数较LPS组显著降低(P<0.05),且以C3组最佳(P<0.01)。白细胞总数和PMNs结果见表1,图1~2。

表1 清瘟败毒饮不同拆方组干预大鼠急性肺损伤的情况比较
注:与空白组(Con)比较,##P<0.01;与模型组(LPS)比较,*P<0.05,**P<0.01

图1 清瘟败毒饮拆方组干预ALI大鼠BALF中白细胞情况注:与空白组(Con)比较,## P<0.01;与模型组(LPS)比较,*P<0.05,**P<0.01
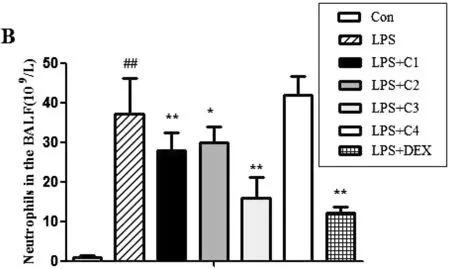
图2 清瘟败毒饮拆方组干预ALI大鼠BALF中PMNs情况注:与空白组(Con)比较,## P<0.01;与模型组(LPS)比较,*P<0.05,**P<0.01
3.2 清瘟败毒饮各拆方组干预LPS诱导的ALI大鼠蛋白浓度和肺约湿/干比值情况比较
与空白组对比,模型组大鼠肺的湿/干比值显著增大(P<0.01);然而清瘟败毒饮4个拆方组能明显降低肺的湿/干比值(P<0.01),尤其以C3组最为显著(图3)。与空白组比,模型组大鼠BALF中蛋白浓度显著增加(P<0.01),然而C1、C2与C3组能明显降低肺泡灌洗液中蛋白浓度(P<0.05),尤其以C2组最强(P<0.01)(图4)。结果见表1。
3.3 清瘟败毒饮拆方组干预LPS诱导的ALI大鼠TNF-α情况比较
与空白组对比,模型组大鼠BALF中肿瘤坏死因子-α(TNF-α)显著增多(P<0.01);拆方组中C1、C2和C4TNF-α水平显著降低(P<0.01),尤其以C1组最佳,结果见表1,图5。

图3 清瘟败毒饮拆方组干预ALI大鼠肺湿/干比情况注:与空白组(Con)比较,## P<0.01;与模型组(LPS)比较,**P<0.01

图4 清瘟败毒饮拆方组干预ALI大鼠的蛋白浓度变化注:与空白组(Con)比较,## P<0.01;与模型组(LPS)比较,*P<0.05,**P<0.01

图5 清瘟败毒饮拆方组干预ALI大鼠TNF-α变化注:与空白组(Con)比较,## P<0.01;与模型组(LPS)比较,**P<0.01
3.4 清瘟败毒饮拆方组改善LPS诱导的ALI大鼠肺组织病理形态变化情况
图6显示,光镜下空白组见肺泡结构完整,大小均匀,肺泡腔清晰、壁薄。模型组肺泡结构破坏,肺泡腔变窄,肺泡间隔明显增厚,肺间质及肺泡充血、水肿、大量炎性细胞浸润。拆方组能够使肺间质及肺泡充血、水肿程度降低、炎性细胞浸润减少。
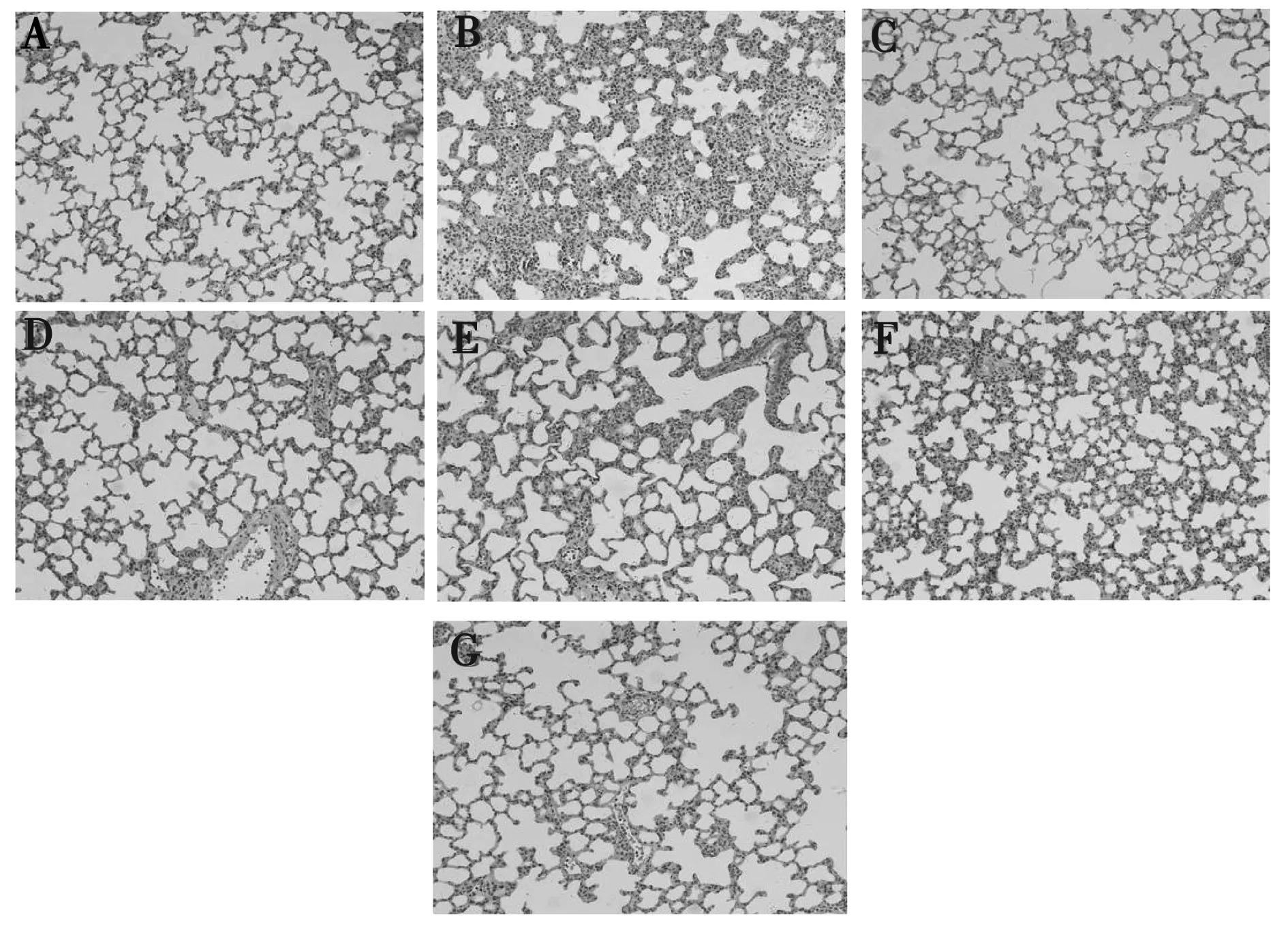
图6 清瘟败毒饮拆方组干预ALI大鼠肺组织病理形态变化图(HE,200×)注:空白组(A);模型组(B);阳性组(C);清热泻火组(D);清热凉血组(E);清热燥湿组(F);其他组(G)
4 讨论
中医学认为,ALI患者多由外感时邪疫毒伤肺[7],引起肺失宣降,水津不布,导致热毒痰癖互结而发病,病情加重时由肺累及全身,故可归于“温病”“瘟疫”范畴,这与现代医学内毒素血症所致ALI认识甚为相似[8],本病初期多为热毒壅盛、肺失宣降,而肺不主气、水凌心肺是本病转危之关键[9],因此多强调早期宜清热解毒为主,对抗机体“内毒”所产生的损害。
在非典时期,中医诊疗方案多强调早期治疗应清热解毒为主。根据临床运用情况,清瘟败毒饮加减是一种治疗临床疑诊或确诊SARS患者的有效药物,可以与西药合用,作用显著[3,10]。同时,中西医结合疗法在治疗甲型 H1N1 流感合并呼吸窘迫综合征中即运用清瘟败毒饮加减方剂,疗效满意,且对患者预后取得了理想疗效[4]。张伯礼[11]总结一线大夫的经验,总体上按卫气营血辨证,认为中医治疗方案的总原则是任何时期都要注重清热药的应用。邓铁涛[12]在病情极期(高峰期)用白虎加参汤、清营汤、犀角汤等,加用活血化瘀之品,效果显著。
实验结果显示,清瘟败毒饮拆方后的4个拆方组,清热泻火组、清热凉血组、清热燥湿组和其他组,各拆方组均能降低肺间质及肺泡充血、水肿程度以及炎性细胞的浸润;但相对比清热燥湿组和其他组,清热泻火和清热凉血组均能较好地改善大鼠ALI损伤(P<0.01),本实验也证实清热法治疗ALI作用效果显著。
[1] 沈维艳,王飞,徐伟,等.清瘟败毒饮古今之用[J].黑龙江中医药,2012,41(6):3-4.
[2] 张学智,于岩岩,万华,等.清瘟败毒饮加减对临床疑诊或确诊SARS患者的退热作用[J].北京中医药大学学报(中医临床版),2003,10(3):48.
[3] 陈益昀,石占成,石英秀,等.清瘟败毒饮加减治疗传染性非典型肺炎28例临床观察[J].河北中医,2003,25(11):805-806.
[4] 褚桂克.中西医结合治疗甲型H1N1流感合并呼吸窘迫综合症13例临床观察[J].中医临床研究,2012,4(3):103-104.
[5] 何神地,骆仙芳,赵玮,等.清瘟败毒饮对内毒素性急性肺损伤大鼠血清细胞因子TNF-α、IL-8、IL-10表达的影响[J].中华中医药学刊,2011,29(9):2067-2071.
[6] ZHANG Q,LEI H M,WANG P L,et al. Bioactive Components from Qingwen Baidu Decoction against LPS-Induced Acute Lung Injury in Rats[J].molecules,2017,22(5):692-711.
[7] 谢玉宝,梁子敬,黄伟青.急性肺损伤的中医药治疗进展[J].实用临床医药杂志,2008,12(2):113-118.
[8] 蒲晓东.内毒素血症中医病机及治法探讨[J].中国中医急症,2005,14(12):1190-1191.
[9] 丁慧芬.中医肺与急性肺损伤的发病关系初探[J].辽宁中医杂志,2004,31(10):823-824.
[10] 丁楠,高菁,陈丹阳,等.清瘟败毒饮清热泻火组干预急性肺损伤的谱效关系研究[J].中医药信息,2017,34(6):23-26.
[11] 张伯礼.非典的中医命名,病机及治法[J].天津中医药,2003,20(5):23-24.
[12] 邓铁涛.论中医诊治非典[J].天津中医药,2003,20(3):12-15.
