CT血管成像与超声评估肝移植术前血管的对比
2018-06-15李彦黄文起柴亚茹
李彦,黄文起*,柴亚茹
1.商丘市第一人民医院超声科,河南商丘 476100;2.郑州大学第一附属医院影像中心,河南郑州 450052;
肝移植是经手术切取健康肝脏来取代不可逆性功能衰竭肝脏,以治愈终末期肝病的有效方法。随着新的免疫抑制剂和长效保存液的应用,以及为解决供肝短缺和儿童肝移植而出现的活体部分肝移植[1],我国临床肝移植取得了巨大进展。至2014年4月,中国肝移植注册网站登记肝移植26 751例[2]。肝脏血管系统复杂,术前做出准确评估有助于术中选择合适的吻合方式。三期CT血管造影不仅能诊断肝脏实质病变,其多种血管后处理重建图像可对肝脏血管情况进行实时三维立体呈现,提供直观准确的信息,对肝移植术前及术后评估均有较大价值[3-4]。超声以其廉价、便捷及独有的血流动力学优势在肝移植围术期评估中具有重要作用[5]。本研究以肝移植术中及术后诊断为参考标准,比较CT血管成像(CTA)和超声对肝移植受体血管术前评估的准确性,为临床肝移植术前选择检查方法提供依据。
1 资料与方法
1.1 研究对象 选择2010年7月—2016年7月郑州大学第一附属医院收治的126例肝移植患者,其中男98例,女28例;年龄2~58岁,中位年龄46岁。114例合并肝硬化,其中肝炎后肝硬化85例,31例伴有肝癌;酒精性肝硬化18例;胆汁性肝硬化3例;淤血性肝硬化8例。12例无肝硬化者包括胆道闭锁5例,原发性肝癌4例,肝豆状核变性3例。所有患者术前均行三期CT扫描和超声检查。
1.2 仪器与方法 采用Siemens Definition AS 128和GE Discovery CT750 HD行上腹部三期增强扫描(脾大及侧支循环开放者加大扫描范围)。扫描参数:管电压120 kV,层厚5 mm,层间距5 mm,重建层厚及层间距均<1 mm。增强扫描经肘前静脉以4.0~5.0 ml/s注射碘伏醇1.5 ml/kg,随后注射生理盐水40 ml。动脉期采用触发扫描模式,门静脉期和静脉期延迟时间分别为 30~35 s、55~60 s。薄层数据传至 GE ADW 4.6工作站进行后处理。重建方法包括容积再现(VR)、最大密度投影(MIP)、曲面重组(CPR)、多平面重组(MPR)等。VR和MIP图像主要观察血管起源、走行等解剖变异情况,CPR图像观察血管管腔通畅情况,MPR重建冠状位及矢状位图像,观察肝实质病变。采用Siemens Sequoia 512彩色多普勒超声诊断仪,探头频率2.5~6.0 MHz,扫查内容包括肝动脉、门静脉主干及其分支、肝静脉及下腔静脉,二维灰阶观察血管走行、管腔内透声、栓子部位大小;彩色多普勒超声观察管腔内彩色血流充盈程度及血流方向。
1.3 图像分析 由2名分别具有5年和12年腹部影像诊断经验的医师观察图像,包括:①肝动脉的解剖变异和管腔通畅情况;②门静脉主干及其分支管腔通畅情况,有无栓子及栓子性质;③门静脉系统侧支循环开放情况;④3支肝静脉及下腔静脉管腔通畅及合干情况;⑤肝内实质性病变的特征及其他相关病变。超声检查由具有8年腹部超声诊断经验的医师完成,超声无需评估肝动脉解剖变异及侧支循环情况。
1.4 统计学方法 采用SPSS 17.0软件,计量资料比较采用χ2检验,观察者间的一致性采用Kappa检验,P<0.05表示差异有统计学意义。
2 结果
2.1 肝动脉评估结果 2名影像医师对肝动脉解剖变异评估一致性较好(Kappa=0.88)。126例肝移植患者中,CT动脉期VR和MIP图像显示肝动脉解剖起源及走行正常98例,属Michel I型;28例(22.2%)存在肝动脉解剖变异。肝动脉管腔无狭窄及异常扩张,发现脾动脉瘤1例(图1)。126例患者术中动脉解剖与CTA评估一致,准确率为100.0%;超声无法评估肝动脉起源变异,见表1。
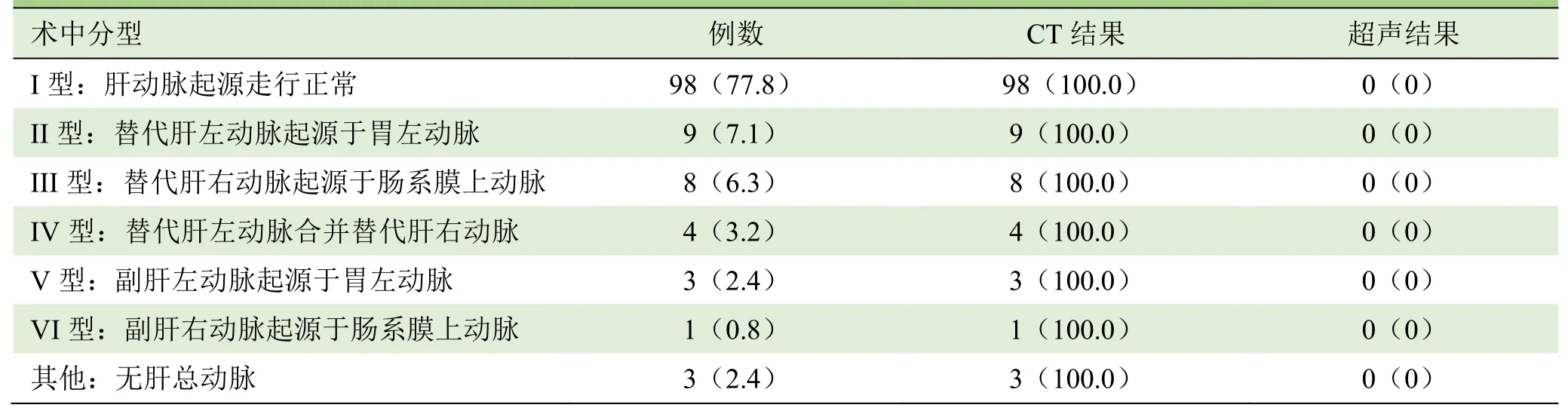
表1 CT和超声对肝动脉解剖变异(按Michel分型)的诊断结果[n(%)]
2.2 门静脉评估结果 术中及术后结果示32例伴门静脉系统栓子,其中血栓21例,瘤栓11例。2名影像医师对门静脉评估的一致性较好(Kappa=0.76)。门静脉期CTA重建图像漏诊血栓4例,误诊1例;漏诊瘤栓2例,误诊1例。超声对栓子的总体检出率较高,为90.6%(29/32);定性欠缺,漏诊血栓6例,误诊4例;漏诊瘤栓5例,误诊8例。CTA对血栓和瘤栓的诊断敏感度和准确度均高于超声,差异有统计学意义(P<0.05),见表 2、3 及图 2~4。
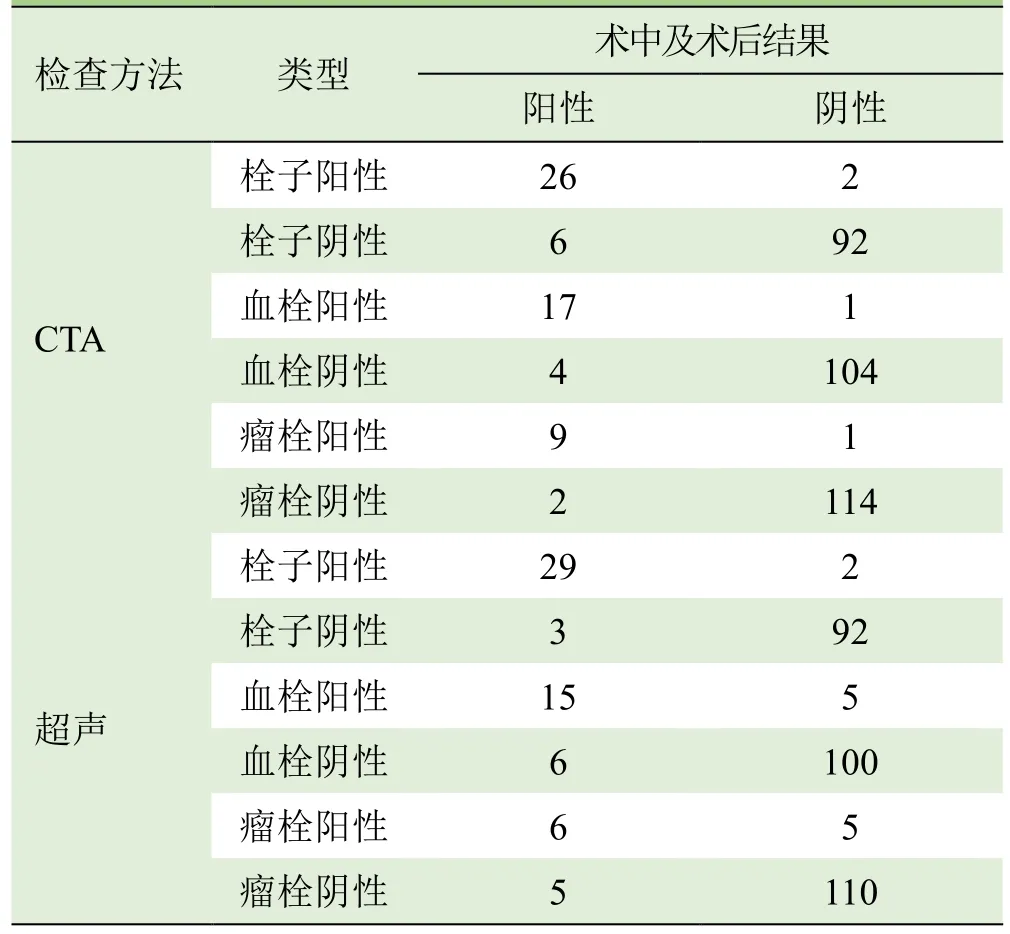
表2 CTA、超声对门静脉栓子检出及定性诊断结果与术中及术后结果比较(例)
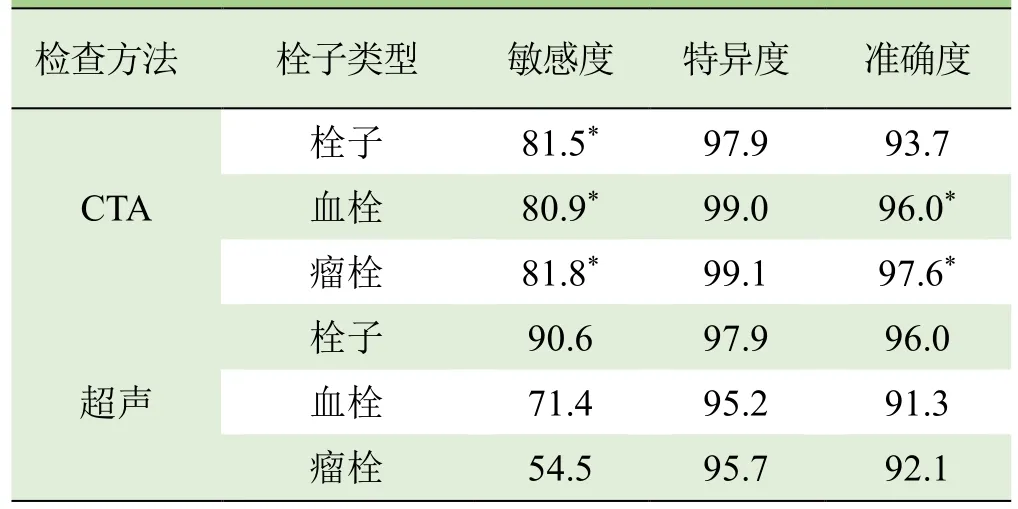
表3 CTA与超声对门静脉栓子检出及定性的诊断效能(%)
2.3 静脉评估结果 肝静脉、下腔静脉均通畅113例,静脉合干及注入下腔静脉的解剖情况为:左中合干42例(图5),右中合干30例,3支分别注入36例,3支合干5例。下腔静脉闭塞5例(图6),其中3例合并肝静脉闭塞;单纯肝静脉闭塞3例。2名影像医师对静脉评估一致性较好(Kappa=0.81)。CTA漏诊1例下腔静脉型布加综合征,超声漏诊1例肝静脉型布加综合征,准确率均为99.3%。CTA和超声对肝静脉合干解剖情况的诊断准确率分别为99.2%、95.2%,差异无统计学意义(P>0.05)。
2.4 侧支循环及其他评估结果 CTA重建图像发现门静脉侧支循环开放39例(图7);发现肝癌33例,病灶119个;动脉-门静脉瘘2例(图8)。超声无法评估侧支循环情况;发现肝癌31例,病灶78个。超声对肝癌病灶的诊断敏感度低于 CT,差异有统计学意义(P<0.05)。
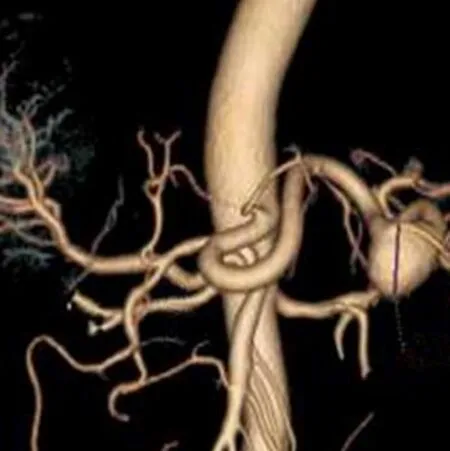
图1 男,43岁,肝硬化,肝动脉Michel III型,合并脾动脉瘤(箭)。CT动脉期VR图像
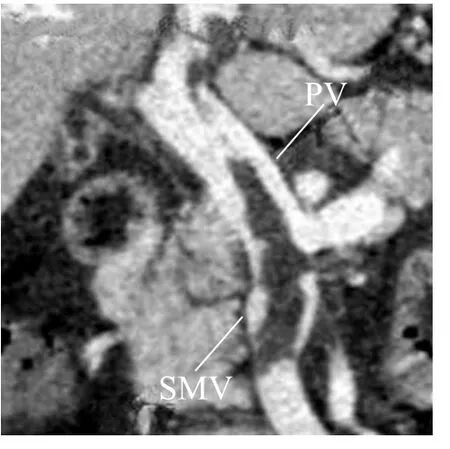
图2 男,51岁,门静脉(PV)及肠系膜上静脉(SMV)血栓。CT门静脉期CPR图像
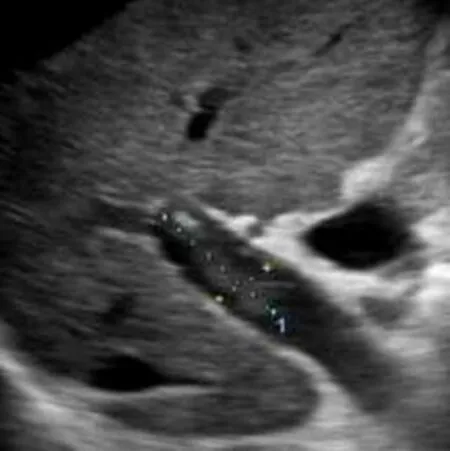
图3 女,47岁,门静脉血栓。超声灰阶图像

图4 男,57岁,肝癌,门静脉右支(R-PV)瘤栓。CT门静脉期CPR图像

图5 男,39岁,肝硬化,肝左(L-HV)、肝中静脉(MHV)合干汇入下腔静脉。CT静脉期VR图像
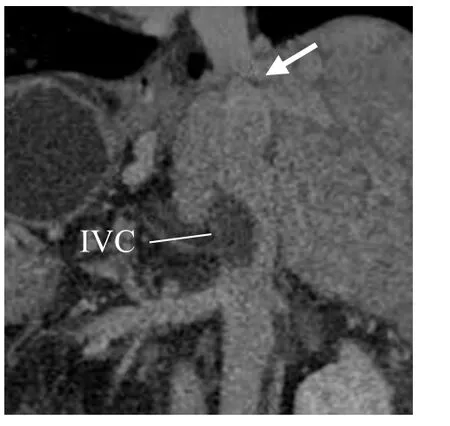
图6 女,49岁,布加综合征,下腔静脉(IVC)膈肌段膜性闭锁(箭),肝下段血栓。CT静脉期CPR图像

图7 女,36岁,肝硬化,脾静脉(SPV)分支与左肾静脉(L-RV)分流。CT门静脉期VR图像。IVC:下腔静脉
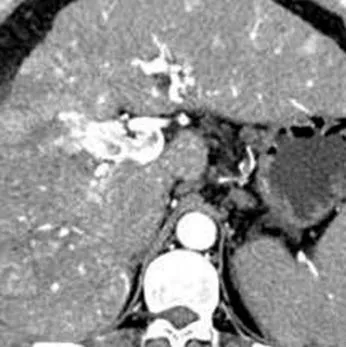
图8 男,59岁,肝癌,肝动脉-门静脉瘘(箭)。CT动脉期轴位图像
3 讨论
肝移植是治疗终末期肝病的有效方法,临床开展日益广泛,但我国病毒性肝炎所致肝硬化及肝癌患者较多,肝源匮乏,供求比远大于1∶100[6]。为提高移植肝术后的成功率和降低并发症发生率,除规范肝移植纳入标准外,术前做出准确的评估至关重要。2008年,中国提出的杭州标准较米兰标准[7-8]引入了肿瘤生物学特性和病理学特征;郑树森等[9]研究表明,杭州标准能将更多的肝癌患者纳入肝移植,且不影响术后总体存活率和无瘤存活率。肝移植术前评估内容除肝脏实质病变外,明确肝脏血管解剖变异及管腔通畅情况对指导术中血管吻合方式及减少术后并发症有重要的临床价值。
肝动脉变异发生率较高,本组患者肝动脉变异与既往研究[10]中的Michel分型比率有差异,可能与本研究的样本例数较少有关。不同类型的肝动脉解剖变异患者手术吻合方式不同,Ishigami等[11]研究表明,术前了解肝动脉解剖变异可明显降低术后肝动脉并发症的发生率。本研究结果显示,CTA对肝动脉解剖变异的诊断准确率为100.0%,而超声由于探查视野的局限性,无法评估肝动脉解剖变异。本研究中,CT发现1例肝硬化肝癌患者合并脾动脉瘤,脾动脉瘤的发生与肝硬化所致门静脉高压有关,Cron等[12]报道门静脉高压患者脾动脉瘤的发生率高达7%。
终末期肝病患者门静脉栓子的发生率较高。合并门静脉栓子最初是肝移植的禁忌证,随着肝移植技术的逐步成熟,此类患者的手术效果也逐步提高。门静脉栓子的部位、大小及栓子的性质对手术方案的选择和预后的评估有重要意义。本研究结果表明,CT对门静脉栓子的整体检出率略低于超声,但CT对门静脉血栓和瘤栓的定性诊断准确率优于超声,与顾莉红等[13]的研究结果有差异,推测与该研究纳入超声造影结果有关。本研究中CT漏诊血栓均为附壁血栓,将栓子误认为正常血管壁,误诊原因包括肿瘤压迫门静脉管腔致使无造影剂显影和门静脉内造影剂混合不均匀。本研究中,超声对血栓的漏诊和误诊原因主要为附壁血栓、侧支循环影响和肠胀气影响。CT和超声对瘤栓的漏诊和误诊均是由于瘤栓与肿块分界不清。CT还能明确显示门静脉侧支循环开放情况,对术中有重要指导价值。
肝移植手术方式包括经典式背驼肝移植、改良式背驼肝移植和经典原位肝移植,采用何种方式与肝静脉合干及注入下腔静脉解剖有关[14]。随着近年劈离式肝移植和亲体供肝活体肝移植技术的不断发展,肝中静脉的解剖变得更加重要,掌握汇入肝中静脉的分支情况有助于术中劈离肝和活体肝切线平面的确定[15]。此外,部分肝癌患者伴有肝静脉及下腔静脉瘤栓,部分经门体血管搭桥术及分流术效果不佳的布加综合征患者也是肝移植的适应证[16]。因此,术前明确肝静脉和下腔静脉管腔通畅情况、肝静脉合干及汇入下腔静脉解剖有利于手术方案的选择。本研究中CTA和超声对肝静脉合干及管腔的诊断准确率无差异。
总之,CTA与超声对肝移植患者术前血管评估均有较大价值。CTA可显示肝动脉解剖变异;对门静脉栓子的定性诊断准确性优于超声,且能显示门静脉侧支循环情况;能准确评估肝静脉和下腔静脉的通畅性及合干情况;术前可为外科医师提供明确客观的诊断,对确定肝移植手术方案具有重要的临床指导价值。本研究的局限性在于未对肝移植术后并发症进行评估比较,有待后续研究深入探讨。
[1] Liang W, Wu L, Ling X, et al. Living donor liver transplantation versus deceased donor liver transplantation for hepatocellular carcinoma: a meta-analysis. Liver Transpl,2012, 18(10): 1226-1236.
[2] 中华医学会器官移植学分会. 中国肝癌肝移植临床实践指南(2014版). 中华消化外科杂志, 2014, 13(7): 497-501.
[3] 戴旭, 徐克, 程颖, 等. 肝动脉及门静脉三维 CT血管造影在肝移植肝门血管重建中的意义. 中华放射学杂志,2005, 39(11): 1176-1180.
[4] 方圆, 孟晓春, 覃杰, 等. 320排CT灌注检查在肝移植后肝动脉狭窄合并缺血性胆道病变中的应用价值. 中华器官移植杂志, 2012, 33(10): 611-614.
[5] 顾莉红, 方华, 杜晶, 等. 彩色多普勒超声在婴幼儿活体肝移植围手术期的应用. 中国超声医学杂志, 2009, 25(9):899-902.
[6] 蒲朝煜, 陈虹. 我国肝移植肝源的困局及其化解方略. 医学与哲学(临床决策论坛版), 2010, 31(5): 73-74.
[7] Strassburg CP. Patient selection and indications for liver transplantation. Chirurg, 2013, 84(5): 363.
[8] Zheng SS, Xu X, Wu J, et al. Liver transplantation for hepatocellular carcinoma: Hangzhou experiences.Transplantation, 2008, 85(12): 1726-1732.
[9] 郑树森, 汪恺, 徐骁, 等. 肝移植治疗肝癌的受者选择杭州标准在亲属活体供肝移植中的应用价值. 中华器官移植杂志, 2011, 32(6): 330-333.
[10] 鲍光进, 李树平, 孙静, 等. 肝动脉解剖变异的 640层容积 CT血管成像研究. 中国医学计算机成像杂志, 2014,20(6): 555-560.
[11] Ishigami K, Zhang Y, Rayhill S, et al. Does variant hepatic artery complications after transplantation?. Am J Roentgenol,2004, 183(6): 1577-1584.
[12] Cron DC, Coleman DM, Sheetz KH, et al. Aneurysms in abdominal organ transplant recipients. J Vasc Surg, 2014,59(3): 594-598.
[13] 顾莉红, 李凤华, 方华, 等. 肝移植术前超声和螺旋 CT门静脉成像检查对诊断门静脉栓塞的准确率. 中华器官移植杂志, 2009, 30(2): 78-80.
[14] 叶殷发, 李弦, 明英姿, 等. 肝静脉解剖与肝移植技术规范的临床研究(附248例报道). 中华肝胆外科杂志, 2013,19(5): 325-328.
[15] Radtke A, Sotiropoulos GC, Sgourakis G, et al."Anatomical" versus "territorial" belonging of the middle hepatic vein: virtual imaging and clinical repercussions. J Surg Res, 2011,166(1): 146-155.
[16] 史瑞, 郑虹, 孙丽莹, 等. 肝移植治疗布加综合征九例.中华器官移植杂志, 2012, 33(3): 149-151.
