超声引导下星状神经节阻滞技术的临床应用
2018-06-15郝云霞崔立刚
郝云霞,崔立刚
北京大学第三医院超声诊断科,北京 100191;
星状神经节(stellate ganglion,SG)又称为颈胸交感神经节。1883年,Liverpool和Alexzander在实施椎动脉结扎治疗癌症时误伤了 SG,却意外获得镇痛的效果,从而引起人们对SG的关注。此后,外科医师常采用颈交感神经节切除术缓解癌症患者的疼痛。1920年,人们逐渐使用药物注射至SG周围的疏松结缔组织进行区域阻滞,代替手术切除,这一微创治疗疼痛的方法即为星状神经节阻滞(stellate ganglion block,SGB)。随着高频超声的发展,Kapral等[1]于 1995年在超声引导下首次成功实施 SGB,与盲探法SGB和X线、CT引导下SGB相比,超声引导下SGB技术定位更为精准,极大地减少了并发症,迅速得以推广。
1 SG的解剖位置及生理功能
颈部交感神经链包括颈上、颈中和颈下交感神经节,约80%的颈下交感神经节与T1交感神经节融合,称为颈胸交感神经节,其外形酷似星星,又称为SG。根据局部解剖学研究结果,将SG的大体形态分为纺锤型(31.9%)、哑铃型(23.2%)、截断型(21.7%)、筛孔型(14.5%)和倒L型(8.7%),其中截断型及筛孔型与椎动脉关系密切,前者与椎动脉平行走行,后者则被椎动脉穿行而过。了解和识别这种特定的解剖形态,对于超声引导下精准、安全的SGB具有重要的参考意义。
颈胸交感神经节多位于C7~T1椎体横突水平,大小为2.5 cm×1.0 cm×0.5 cm,其下缘不会低于T2椎体下缘[2]。SG位于椎前筋膜深方[3],其外侧为前斜角肌,内侧为颈长肌、食管、气管及走行于其中的喉返神经,后方为颈椎横突,下方为锁骨下动脉和胸膜顶。然而,人体颈交感链的解剖位置和形态常发生变异,如果超声能够识别SG自身,而不仅单纯依赖其周围的解剖结构,则能最大限度地减少SGB并发症的出现。
SG是颈部交感神经链中的重要部分,其节前纤维来自T1和T2的中间和外侧细胞柱,在颈交感链神经元换元后,发出节后纤维,主要包括:随臂丛走行分布于血管、汗腺、骨和关节的灰交通支[4-5];加入心交感丛分支;椎动脉、颈内动脉和锁骨下动脉丛。因此,施行SGB后可以抑制其支配范围内的交感神经活动,从而诊断和治疗其支配区域的头、颈和上肢的交感神经相关的疼痛[6]。近年来,随着SGB机制研究的深入,发现其对于全身性疾病的治疗同样有意义,但SGB对于具体疾病的治疗机制、操作方法及有效性尚处于探索阶段[7-8]。
2 超声引导下SGB的穿刺入路及药物用量
根据颈部交感神经节的解剖位置,目前超声引导下SGB多在C6或C7水平,穿刺路径分为气管旁入路和侧方入路两种(图1)。这些方式的优劣目前尚无足够的循证医学证据支持,但临床上多倾向使用侧方入路。
进针水平:分别在 C6和 C7水平盲法注入美蓝染料时,SG被染色的几率分别为45%和63%[9]。目前,超声引导下SGB时,择优选择两者之一进行穿刺,以尽可能避免发生相关并发症。
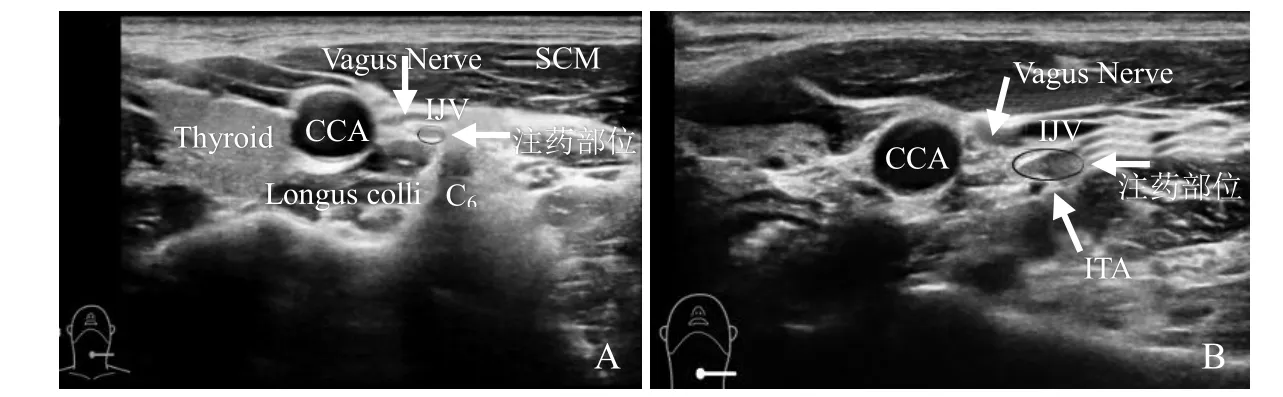
图1 超声引导下SGB的穿刺入路。A为C6水平进针;B为C7水平进针,箭示低回声结构为发现的可能为颈部交感神经节的部位,长轴扫描其两端与线状低回声相连。SCM:胸锁乳突肌;IJV:颈内静脉;CCA:颈总动脉;Thyroid:甲状腺;Vagus Nerve:迷走神经;Longus colli:颈长肌;ITA:甲状腺下动脉
进针路径:气管沟旁前路法:患者去枕平卧,保持头部中立位或侧卧位,并将薄枕垫于双肩下,使颈部处于轻度过伸位,嘴微张以使颈前肌群放松。采用高频线阵探头(6~13 MHz)横断面扫查显示出C6横突前结节(前结节与后结节中间有C6颈神经根穿出)或者C7横突,并观察确定甲状腺、颈动脉鞘、椎动脉、甲状腺下动脉、气管和食管等结构。向外侧尽可能推开颈动脉鞘,在气管旁沟进针,针尖经甲状腺外侧缘进入颈长肌表面的椎前筋膜深方,回抽无血液、脑脊液或气体后,即可注入药物。该穿刺路径容易损伤甲状腺下动脉、椎动脉和食管[3]。
胸锁乳突肌后缘侧入法和肌间沟侧入法:体位、扫查设备和阻滞前准备同前,显示出C6或C7横突后,穿刺针经相应穿刺入路同样到达椎前筋膜深方。该穿刺入路可以避免损伤甲状腺、食管,尽可能避开血管和神经。但有时会由于颈内静脉与C6或C7横突距离过近而损伤静脉,出现血肿,甚至难以进针[10]。
药物种类及用量:目前SGB的经典药物为局部麻醉药物,如0.5%~2.0%利多卡因和0.2%~0.5%布比卡因、罗哌卡因或甲哌卡因。与盲探法SGB和X线或CT引导下SGB相比,超声引导下SGB局部麻醉药物的用量更少,Horner综合征出现更快。但是对于每种局部麻醉药物的最佳和最少用量并无明确共识,有多种临床应用方法[11-17]。因对于SGB缺乏明确的理论或临床依据,目前不推荐使用糖皮质激素、非甾体类抗炎药物等。
3 超声引导下SGB的适应证及禁忌证
适应证:文献报道显示,使用SGB术治疗的病种高达120多种,但不同研究得到的有效率差别较大,可能与适应证选择不恰当有关。目前较广泛认可的适应证包括:①交感神经相关的疼痛性疾病:偏头痛、带状疱疹或带状疱疹后遗神经痛、外周动脉性疼痛(雷诺病、Burger病、糖尿病血管病变、动脉栓塞等)、肿瘤性疼痛(乳腺癌切除后疼痛)[18]、I型和II型区域性复杂性疼痛(complex regional pain syndrome,CRPS)[19]等。尽管第4版美国CRPS诊疗指南将SGB作为一线诊疗手段,但是缺乏高质量的随机对照实验证实其有效性。②心脏疾病:室性心律失常(如先天性长QT综合征、儿茶酚胺依赖性多形性室速、心房颤动、窦性心动过速)、缺血性心肌病,但多作为辅助性治疗手段,仅在药物不良反应难以耐受时谨慎选择[20]。③全身自主神经系统相关性疾病:如多汗症。
其他尚有争议的适应证包括突发性耳聋、更年期潮热或乳腺癌术后雌激素缺乏患者出现的潮热[21-22]、创伤后应激障碍(post-traumatic stress disorder,PTSD)、原发性痛经[23]、视网膜动脉痉挛等。
禁忌证:包括目前正在接受抗凝治疗或凝血功能障碍者、局部皮肤破溃感染者,与其机制有关的禁忌证包括对侧气胸或肺叶切除、严重慢性阻塞性肺疾病、近期发生的急性心肌梗死、房室传导阻滞及青光眼。
4 超声引导下SGB的疗效判定
SGB术后效果的判定主要包括患者疼痛缓解程度评估和交感神经功能测定。(1)疼痛缓解程度评估包括疼痛改变百分率、休斯顿疼痛情况调查表、视觉模拟评分量表等。(2)交感神经功能评定:Malmqvist等[24]界定了一个严格的SGB术成功标准,包括:①Horner综合征(同侧瞳孔缩小、上睑下垂、眼球内陷和同侧面部少汗)是SG阻滞成功的重要标志,也是最常用的标志;②掌侧皮温升高至≥34℃;③皮肤血流量测定≥50%(激光多普勒血流仪);④尺侧皮肤阻抗反应消失;⑤桡侧皮肤阻抗反应消失。其中符合4项视为阻滞成功。Yamazaki等[25]以脉搏血氧仪测定的灌注指数(perfusion index,PI)作为评估SGB术成功与否的标准,21例 SGB成功的患者均出现耳垂与指间 PI增加,而对侧无此表现,而且PI增加与疼痛程度缓解和皮肤微循环血流量的改变成正比,提示PI可以作为评估SGB术疗效的指标。Doytchinova等[26]研究表明,皮肤交感神经活动可以正确反映SG发出的交感神经活性,使用高滤波的心电图仪可以测量皮肤表面的交感神经活动。由于对Horner综合征的判断较为主观,使用PI或皮肤交感神经活动等客观指标作为SGB术是否成功的标准是目前研究的热点,也是临床需求所在。
5 超声引导下SGB的优势及不足
超声引导下SGB的优势:①在椎前筋膜与颈长肌之间注射药物,穿刺针的定位更加准确,局部麻醉药的用量更少,避免了椎前筋膜浅方注射药物所致迷走神经阻滞;②可以直接观察到穿刺路径上的所有结构,提高了操作安全性,避免损伤周围重要结构,减少了由于各种解剖变异带来的损伤;③避免操作者和患者受到放射辐射。
超声引导下 SGB的局限性在于目前尚无超声声像图直接显示SG并引导靶向SGB的报道。此外,初学者需要掌握相关解剖结构和超声引导下穿刺的技术,需要一定的时间和实践经验。
6 超声引导下SGB可能的并发症
①超声引导下 SGB的并发症发生率较盲探法和X线引导下 SGB低,但是由于 SG周围毗邻结构复杂,本身变异较多,而且超声引导下穿刺本身具有一定的危险性,因此仍会发生穿刺并发症。感染:非常少见。②食管、气管、胸膜顶损伤:气管旁入路时更易损伤,会导致食管憩室,甚至出现纵隔炎或纵隔气肿[27]。胸膜顶位于SG的后方,误伤后会导致气胸,尤其在慢性阻塞性肺疾病患者中更易发生。③血管损伤:穿刺针误入血管出现血肿,多发生于SGB后2 h,严重者会压迫气道导致呼吸困难[28];麻醉药进入血液,引起抽搐、心脏骤停。常见的血管损伤见于椎动脉,SGB不仅容易损伤穿刺靶点位置的椎动脉,椎间孔段的椎动脉也易受到损伤[29]。超声引导下 SGB发生椎动脉损伤引起血肿的几率为1/10万[30]。另外,甲状腺下动脉走行纡曲、位置变异较大。除常见的上述2支血管,C6和C7椎体浅方还有颈升动脉、颈深动脉[31]。④膈神经:SGB术患者几乎100%会出现膈神经阻滞,但正常人出现暂时性一侧膈神经阻滞、膈肌瘫痪并不会出现明显症状,因此对于SGB阻滞膈神经的报道较少。然而,当严重慢性阻塞性肺疾病或其他呼吸功能不全患者(如对侧肺切除或对侧膈肌瘫痪者)出现膈神经阻滞后,会导致呼吸困难等严重后果,因此禁止行SGB术。Joeng等[32]分别研究了仰卧位与侧卧位下膈神经的位置变化,建议在施行SGB时注意膈神经的位置,并且认为侧卧位施行SGB不易损伤膈神经,其效果有待更多随机对照研究结果的验证。⑤迷走神经:迷走神经位于颈动脉鞘内,颈总动脉和颈内静脉后方。超声引导下SGB可清楚观察到迷走神经的结构,防止其损伤。⑥喉返神经:损伤几率为50%,若出现短暂性的声嘶,持续数小时后好转,可能为喉返神经阻滞。若损伤喉返神经,可表现为持续声嘶。若患者出现异物感,通常是由于阻滞喉上神经外支或喉返神经所致。⑦臂丛神经:部分或者完全阻滞会出现上肢麻木无力[33]。⑧高位硬膜外阻滞和蛛网膜下腔阻滞:高位硬膜外阻滞脊神经根,会出现双上肢运动障碍,而局部麻醉药误入蛛网膜下腔时会导致全脊髓麻醉,患者出现呼吸困难、意识丧失和血压下降,甚至呼吸停止。
7 超声引导下SGB的前景
超声引导下SGB技术的优势在于监测进针路径上的全部软组织,避免出现穿刺并发症,同时引导穿刺进入SG所在的解剖区域。由于声像图没有确认显示SG的位置、大小、形态,超声引导下SGB并非SG的靶向阻滞技术。Shin等[34]报道了颈中交感神经节的声像图特征,颈中神经节95%位于C6水平,与甲状腺下动脉关系密切。既往进行的SGB是否实际为颈中神经节阻滞所带来的治疗效果,如何在超声引导下进行更精确的SG及其节后纤维的阻滞,如何使用超声这项可视化技术避免在颈部介入性操作中损伤SG,值得进一步研究。
[1] Kapral S, Krafft P, Gosch M, et al. Ultrasound imaging for stellate ganglion block: direct visualization of puncture site and local anesthetic spread. A pilot study. Reg Anesth, 1995,20(4): 323-328.
[2] 刘彦国, 石献忠, 梁海鹏, 等. 星状神经节的应用解剖及其与 Horner综合征关系的探讨. 中国临床解剖学杂志,2006, 24(1): 67-69.
[3] Gofeld M, Bhatia A, Abbas S, et al. Development and validation of a new technique for ultrasound-guided stellate ganglion block. Reg Anesth Pain Med, 2009, 34(5): 475-479.
[4] Song ZF, Sun MM, Wu ZY, et al. Anatomical study and clinical significance of the rami communicantes between cervicothoracic ganglion and brachial plexus. Clin Anat, 2010,23(7): 811-814.
[5] Kuntz A. Distribution of the sympathetic rami to the trachial plexus: its relation to sympathectomy affecting the extremity.Arch Surg, 1927(15): 871-877.
[6] 卢光, 易晓斌, 陶蔚, 等. 星状神经节阻滞技术的临床应用. 中国疼痛医学杂志, 2015, 21(1): 56-59, 63.
[7] Lipov EG, Lipov S, Joshi JR, et al. Stellate ganglion block may relieve hot flashes by interrupting the sympathetic nervous system. Med Hypotheses, 2007, 69(4): 758-763.
[8] 张晓东. 星状神经节阻滞的临床应用及相关机制研究. 重庆医学, 2010, 39(19): 2612-2613.
[9] Feigl GC, Rosmarin W, Stelzl A, et al. Comparison of different injectate volumes for stellate ganglion block: an anatomic and radiologic study. Reg Anesth Pain Med, 2007,32(3): 203-208.
[10] 白志勇, 李水清, 张华斌, 等. 超声引导颈外侧入路星状神经节阻滞治疗颈源性头痛. 中国微创外科杂志, 2014,14(12): 1068-1070.
[11] Lee MH, Kim KY, Sonq JH, et al. Minimal volume of local anesthetic for successful stellate ganglion block. Pain Med,2012, 13(11): 1381-1388.
[12] Cho YW, Song SO, Jang JH. Effect of stellate ganglion block using 0.2% ropivacaine. J Korean Pain Soc, 2000, 13(2): 183-186.
[13] Chang JH, Song SO. Minimal concentration of lidocaine for a diagnostic stellate ganglion block. Korean Anesthesiol,2001, 41(2): 165-170.
[14] 姚玉笙, 陈彦青, 戴东升, 等. 0.2%罗哌卡因用于患者超声引导星状神经节阻滞的量效关系. 中华麻醉学杂志,2014, 34(2): 196-198.
[15] Laufenberg LJ, Weller GE, Lang CH, et al. Nociceptin receptor signaling in sympathetic neurons from septic rats. J Surg Res, 2013, 184(2): 973-980.
[16] Kimura Y, Takahashi Y, Yamaguchi S, et al. Sympathetic block in dogs by a local anesthetic with addition of clonidine.Masui, 2002, 51(11): 1206-1211.
[17] Pöpping DM, Elia Nadia, Marret E, et al. Clonidine as an adjuvant to local anesthetics for peripheral nerve and plexus blocks: a meta-analysis of randomized trials. Anesthesiology,2009, 111(2): 406-415.
[18] Kortüm FC, Bräscher AK, Schmitz-Buchholz D, et al.Interventional pain therapy. Results of a survey among specialized pain physicians in Germany. Schmerz, 2014,28(6): 591-599.
[19] Smart KM, Wand BM, O'connell NE. Physiotherapy for pain and disability in adults with complex regional pain syndrome(CRPS) types I and II. Cochrane Database Syst Rev, 2016,2(11): D10853.
[20] Witt CM, Bolona L, Kinney MO, et al. Denervation of the extrinsic cardiac sympathetic nervous system as a treatment modality for arrhythmia. Europace, 2017, 19(7): 1075-1083.
[21] Guirguis M, Abdelmalak J, Jusino E, et al. Stellate ganglion block for the treatment of hot flashes in patients with breast cancer: a literature review. Ochsner J, 2015,15(2): 162-169.
[22] Guttuso T. Stellate ganglion block for treating hot flashes: a viable treatment option or sham procedure? Maturitas, 2013,76(3): 221-224.
[23] 徐振宏, 吕国荣, 王宏梗, 等. 超声引导星状神经节阻滞治疗原发性痛经. 中国医学影像学杂志, 2015, 23(9): 707-708.
[24] Malmqvist EL, Bengtsson M, Sörensen J. Efficacy of stellate ganglion block: a clinical study with bupivacaine. Reg Anesth,1993, 17(6): 340-347.
[25] Yamazaki H, Nishiyama J, Suzuki T. Use of perfusion index from pulse oximetry to determine efficacy of stellate ganglion block. Local Reg Anesth, 2012, 5(1): 9-14.
[26] Doytchinova A, Hassel JL, Yuan Y, et al. Simultaneous noninvasive recording of skin sympathetic nerve activity and electrocardiogram. Heart Rhythm, 2017, 14(1): 25-33.
[27] Narouze S, Vydyanathan A, Patel N. Ultrasound-guided stellate ganglion block successfully prevented esophageal puncture. Pain Physician, 2007, 10(6): 747-752.
[28] Takanami I, Abiko T, Koizumi S. Life-threatening airway obstruction due to retropharyngeal and cervicomediastinal hematomas following stellate ganglion block. Thorac Cardiovasc Surg, 2009, 57(5): 311-312.
[29] Matula C, Trattnig S, Tschabitscher M, et al. The course of the prevertebral segment of the vertebral artery: anatomy and clinical significance. Surg Neurol, 1997, 48(2): 125-131.
[30] Higa K, Hirata K, Hirota K, et al. Retropharyngeal hematoma after stellate ganglion block: analysis of 27 patients reported in the literature. Anesthesiology, 2006, 105(6): 1238-1245.
[31] Huntoon MA. The vertebral artery is unlikely to be the sole source of vascular complications occurring during stellate ganglion block. Pain Pract, 2010, 10(1): 25-30.
[32] Joeng ES, Jeong YC, Park BJ, et al. Sonoanatomical change of phrenic nerve according to posture during ultrasoundguided stellate ganglion block. Ann Rehabil Med, 2016, 40(2):244-251.
[33] Shankar H, Simhan S. Transient neuronal injury followed by intravascular injection during an ultrasound guided stellate ganglion block. Anesth Pain Med, 2013, 2(3): 134-137.
[34] Shin JE, Baek JH, Ha EJ, et al. Ultrasound features of middle cervical sympathetic ganglion. Clin J Pain, 2015, 31(10): 909-913.
