系统性红斑狼疮心血管系统病变的超声研究进展
2018-06-15罗玲尹立雪
罗玲,尹立雪
1.川北医学院,四川南充 637000;2.四川省医学科学院、四川省人民医院超声医学研究所,四川成都 610072;
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多器官的慢性自身免疫性炎症疾病,多发生于育龄期女性。心血管系统是SLE最常累及的靶器官之一,心血管疾病是晚期SLE的主要致死原因[1]。随着SLE临床诊疗水平的提高,早期病变活动导致的较高死亡率显著降低,但SLE患者心血管疾病发生率仍显著增加,心脏疾病是其主要死亡原因之一[2-3]。超声成像是目前评价心血管结构和功能的主要无创可视化方法。本文拟对SLE患者心血管系统的病理改变和超声研究现状作一综述。
1 SLE的心血管系统主要病理改变
SLE心血管系统损伤的发病机制尚未完全阐明,多认为传统危险因素、SLE患者炎症过程中自身抗体的产生、循环免疫复合物的形成及药物治疗之间的复杂相互作用促进了 SLE患者心血管疾病的进展[4-5]。SLE心血管系统受累主要表现为动脉粥样硬化、心肌病变、瓣膜病变、心包病变、心律失常等。
1.1 动脉粥样硬化 SLE患者由于炎症免疫反应早期即可引起血管内皮损伤及功能障碍,形成亚临床动脉粥样硬化,致使血管弹性功能和结构发生改变。既往研究表明[6],SLE患者与年龄、性别、血压等相匹配的普通人群相比,其临床前期颈动脉内中膜厚度(intima-media thickness,IMT)明显增厚、颈动脉斑块发生率显著升高(图1、2)。既往研究分别对两组SLE患者队列随访8.6年和10年发现,冠心病的发生率分别为13.0%和8.5%[7-8]。
1.2 心肌病变 SLE患者的心肌病变由多种因素引起,包括自身免疫性炎症、药物及其他病因等。Apte等[9]对496例SLE患者研究发现,心肌炎的发病率为10.7%。不同的病程时期心肌病理改变可表现为心肌水肿、心内膜心肌纤维化或心肌梗死[10]。狼疮性心肌病早期多无明显临床症状,可发展为心力衰竭。Ward[11]研究发现,SLE患者因充血性心力衰竭的入院率是年龄相匹配的普通患者的3.8倍。

图1 女,40岁,SLE。颈总动脉分叉处动脉斑块形成

图2 女,40岁,正常人。颈总动脉声像图
1.3 心内膜和瓣膜病变 疣状心内膜炎是 SLE患者的典型病变[12]。疣状赘生物通常邻近瓣膜的边缘,由免疫复合物、单核细胞、苏木紫小体、纤维蛋白和血小板血栓堆积构成,二尖瓣、主动脉瓣和三尖瓣较常受累。瓣膜病变主要表现为瓣膜增厚、瓣膜赘生物及瓣膜关闭不全,瓣膜狭窄较少见[13]。瓣膜病变可能会增加严重并发症的风险。Roldan等[14]对 SLE患者平均随访5年发现,合并瓣膜病变者脑卒中、外周栓塞、心力衰竭、感染性心内膜炎和死亡的联合发生率为22%,而无瓣膜疾病患者为15%。
1.4 心包病变 心包受累是最常见的狼疮性心脏受累表现,也是引起症状性心脏病最常见的原因。心包炎最常发生于SLE患者活动期和复发期。SLE患者心包积液的发病率为25.4%(图3),是正常人的30.52倍[15]。
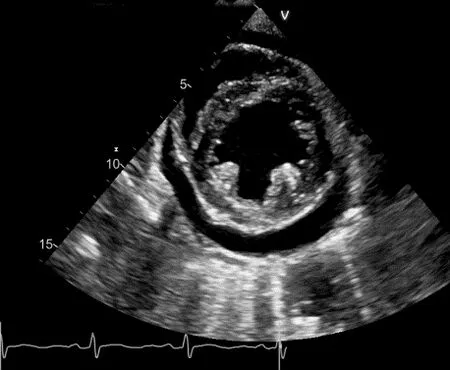
图3 SLE患者活动期出现心包积液(箭)
1.5 心律失常 QT间期延长是心脏猝死的独立危险因素[16]。多项研究表明,SLE患者QT间期延长发生率较高,但其病理机制尚不清楚[17-18]。Rivera-López等[19]研究报道,SLE患者QT间期延长与脉搏波传播速度呈正相关,并与亚临床动脉粥样硬化存在一定的相关性。
2 超声定量评估SLE患者动脉病变
2.1 颈动脉超声及其新技术对颈动脉病变的评估通过颈动脉二维超声可发现SLE患者颈动脉IMT增厚及斑块明显增多[6]。然而,单纯IMT观察对临床前期的颈动脉弹性功能改变敏感度较差。结合其他新技术定量评估 SLE患者颈动脉的弹性功能和结构有可能作为预测其早期血管病变的方法。
2.1.1 血管回声跟踪(E-tracking,ET)技术 ET技术是通过自动采集血管搏动所产生的射频信号,描记血管前后壁实时运动轨迹,再通过分析软件自动算出血管各弹性参数指标,如弹性模量(EP)、僵硬指数(β)、脉搏波传导速度(PWVβ)、顺应性(AC)等。既往研究表明[20],ET技术可早期发现SLE患者颈动脉结构正常时已出现EP、β、PWVβ明显升高及AC显著减低,可以对SLE患者颈动脉的弹性功能进行早期定量评估,对预防动脉粥样硬化的进展有重要的临床意义。
2.1.2 瞬时波强(wave intensity,WI)技术 基于彩色多普勒和ET技术,测量循环系统中动脉血管内任意点的WI来评估心血管系统的总体功能,WI有2个正向波和1个负向波,分别是收缩早期的瞬时加速度波强峰值W1波、收缩晚期的瞬时减速度波强峰值W2波和收缩中期的负向波NA[21]。利用WI技术评估SLE患者颈动脉结构和功能时,其衍生指标β、EP和PWVβ增高,但W2不同的研究结果不同[22-23]。W2既受心脏舒张功能的影响,也受大动脉AC的影响,故不同的研究其结果有一定的差异。
2.1.3 二维应变成像 大动脉是弹性动脉,随着心脏的收缩和舒张,管壁会发生相应的形变。二维应变成像是基于斑点追踪成像的一项新技术,可利用应变成像技术测量动脉壁圆周应变及应变率分析大动脉的弹性。李秀云等[24]研究表明,圆周应变及应变率是比颈动脉IMT更早反映SLE患者血管受累的信号。二维应变成像各参数在一定程度上可以反映弹性动脉的机械特性,但有待更多临床研究进一步证实。
2.2 超声对肱动脉内皮舒张功能的评估 Corretti等[25]创造了使用高分辨率超声观测肱动脉扩张程度判定血管内皮功能的无创检测方法,血流介导的肱动脉内皮依赖性舒张(flow mediated vasodilation,FMD)=[(反应性充血后肱动脉内径-反应性充血前肱动脉内径)/反应性充血前肱动脉内径]×100%,该值降低反映血管内皮依赖性舒张功能受损。Wang等[26]的一项荟萃分析表明,SLE患者较健康对照组FMD明显降低,FMD可作为早期评估SLE患者亚临床动脉粥样硬化的指标。
2.3 经食管超声心动图(transesophageal echocardiography,TEE)对主动脉病变的评估 TEE不仅可以早期准确地评估SLE患者的瓣膜病变,还可以定量评估主动脉粥样硬化(aortic atherosclerosis,AA)。Roldan等[27]采用TEE对47例SLE患者进行研究,结果发现主动脉IMT增厚和斑块的发生率明显高于健康人群,且 AA与环磷酰胺的治疗呈负相关,即环磷酰胺的治疗对AA有预防作用。近年,Roldan等[28]再次使用TEE对SLE进行研究,采用压力应变弹性模量(pressurestrain elastic modulus,PSEM)评估主动脉僵硬指数,PSEM=[k(sBP-dBP)/(sD-dD)/dD]/10 000,其中k=133.3,结果表明SLE患者PSEM明显增高,PESM与左心舒张功能降低显著相关。
2.4 超声对肺动脉压力的评估 SLE相关性肺动脉高压(SLE-PAH)的发病率为0.5%~43.0%[29],其远期生存率低[30],采用免疫抑制剂治疗可以降低肺动脉压力[31],故对 SLE-PAH的早期筛查具有重要的临床意义。使用连续型多普勒测量三尖瓣反流速度可以量化评估SLE患者的肺动脉压力。近年,负荷超声心动图(stress echocardiography,SE)为肺动脉高压的早期诊疗提供了新的视野。Kusunose等[32]利用SE对78例结缔组织病(connective tissue disease,CTD)患者随访 5年,结果发现异常的平均肺动脉压/心排量(△mPAP/△Q)是CTD-PAH进展过程中的独立预测因子,对其早期筛查和预后评价具有重要的临床意义。目前国内SE尚未广泛应用于临床,但其作为无创评估方法具有巨大潜力。
3 超声心动图可视化评价SLE患者的心脏病变
SLE复杂的免疫炎症反应可引起心脏结构及功能的一系列改变,早期可无明显临床症状。超声心动图是目前无创、实时评估心脏结构和功能最常用的检查技术。新型的超声心动图技术还可以评估SLE患者亚临床心脏受累。与心电图同步显示可更准确地了解心脏各时相结构功能的改变,还可用于评价心律失常和心肌电兴奋-机械收缩偶联。
3.1 常规经胸超声心动图(transthoracic echocardiography,TTE) TTE可直接多切面观察心包积液和增厚情况、观察瓣膜结构、血流动力学及室壁运动情况。通过测量左心室舒张末期内径、左心室收缩末期内径、左心室室壁厚度及计算左心室质量指数观察左心室构型的改变。Chen等[15]纳入22项研究的荟萃分析结果表明,TTE可以准确评估SLE患者早期心包积液及左心室构型改变。
根据最新指南[33],二维超声心动图参数二尖瓣早期充盈(E波)速度、二尖瓣舒张晚期充盈(A波)速度、二尖瓣E/A比值、二尖瓣减速时间及左心房最大容积指数可评估左心室舒张功能,但仅用上述指标评估左心室舒张功能时,由于受心率、前后负荷等多种因素的影响而存在假性正常化。在对瓣膜病变的评估方面,TEE明显优于TTE[34]。由此可见,仅用TTE对心脏结构及功能进行评估不完善,需结合其他超声技术综合准确评估心脏功能。
3.2 组织多普勒成像(tissue Doppler imaging,TDI)TDI是测量和显示局部心肌运动速度的技术。脉冲多普勒组织速度成像可通过测量心肌收缩期峰值速度(s')、舒张早期峰值速度(e')、舒张晚期峰值速度(a')定量评估节段心肌的功能状态。根据最新指南[33],e'、E/e'是评估心室舒张功能的主要指标。Buss等[35]研究表明,TDI对 SLE患者临床前期左心室功能的评估较常规 TTE更为敏感。此外,已有多项研究表明,通过TDI测量Tei指数(Tei指数=IRT+ICT/ET)可以准确反映SLE患者早期左、右心室整体功能变化[36-37]。TDI突破了既往超声心动图目测分析室壁运动的局限性。然而,TDI具有角度依赖性,且心脏在心腔的摆动、呼吸运动等会影响TDI对心脏运动分析的准确性。随着超声新技术的发展,TDI与三维超声心动图、心肌声学造影等完美结合,必将为诊疗提供更为准确的信息。
3.3 斑点追踪成像(speckle tracking imaging,STI)STI利用斑点追踪技术自动追踪斑点运动,获取心肌组织纵向、径向、圆周应变和旋转角度等形变参数以评估心肌功能状态[38]。SLE患者的SPECT和心脏MRI研究发现,患者临床前期即已出现心肌灌注异常[39-40],可能导致心肌功能异常改变。高帅等[41]研究表明,SLE患者左心室构型及左心室射血分数正常时,其左心室整体纵向、径向、圆周应变均减低,提示SLE患者存在亚临床心肌功能障碍。此外,Bulut等[42]研究发现,SLE患者不仅临床前期纵向、径向及周向应变指标均减低,其扭转参数在 SLE疾病活动性指数(SLEDAI)>17时明显降低。上述研究表明,STI可对SLE患者亚临床心肌功能障碍做出定量、准确的评估。STI无角度依赖性,为临床评估心肌功能提供了全新的技术方法。见图4、5。

图4 女,28岁,SLE。STI分析显示左心室心尖长轴整体纵向应变为-18.3%

图5 女,28岁,正常人。STI分析显示左心室心尖长轴整体纵向应变为-24.7%
3.4 TEE TEE可排除肥胖、肋骨及肺气肿等多种因素的影响,显示清晰的声像图。Roldan等[43]对81例SLE患者和75例健康对照组研究发现,SLE患者疣状心内膜炎的发生率显著高于健康对照组,TEE和TTE对瓣膜赘生物、瓣膜增厚、瓣膜反流的诊断率分别为46%比6%、70%比52%、30%比23%,TEE诊断瓣膜病变的敏感度显著高于 TTE。另一项研究报道[44],在诊断SLE患者瓣膜反流(二尖瓣反流、主动脉瓣反流)、瓣膜赘生物的数量及大小方面,3D-TEE显著优于2D-TEE。3D-TEE对SLE患者的研究还需进一步证实其临床应用价值。
4 介入性超声对SLE患者心包病变的诊疗
超声引导下心包穿刺能实时监测穿刺全过程,准确、安全、成功率高。沈世华等[45]研究证实,超声引导下心包穿刺置管引流是目前心包积液较理想的诊疗技术。少数SLE患者以心脏压塞症状就诊,超声可快速确诊且及时行超声引导下经皮心包穿刺引流缓解患者的症状[46],并可快速评估患者心脏结构和功能,为临床诊疗提供重要信息。
5 展望
目前,国内SE及3D-STI等超声新技术在SLE患者中的应用尚存在不足,可多学科联合进一步开展超声新技术的临床研究,提高对SLE患者临床前期血流动力学及心肌力学改变的认识。此外,应加强SLE患者心室-动脉匹配功能的临床研究,为其系统性的诊断及治疗提供更有价值的临床信息。
近年来,SLE与基因调控的关系受到重视,探索将某些生物标志物与各种超声结构功能成像相结合,进一步提高对 SLE患者早期心血管系统受累诊疗的敏感度和特异度。
[1] Urowitz MB, Bookman AA, Koehler BE, et al. The bimodal mortality pattern of systemic lupus erythematosus. Am J Med,1976, 60(2): 221-225.
[2] Bartels CM, Buhr KA, Goldberg JW, et al. Mortality and cardiovascular burden of systemic lupus erythematosus in a US population-based cohort. J Rheumatol, 2014, 41(4): 680-687.
[3] Bengtsson C, Ohman ML, Nived O, et al. Cardiovascular event in systemic lupus erythematosus in northern Sweden:incidence and predictors in a 7-year follow-up study. Lupus,2012, 21(4): 452-459.
[4] Mason JC, Libby P. Cardiovascular disease in patients with chronic inflammation: mechanisms underlying premature cardiovascular events in rheumatologic conditions. Eur Heart J, 2015, 36(8): 482-489.
[5] Faccini A, Kaski JC, Camici PG. Coronary microvascular dysfunction in chronic inflammatory rheumatoid diseases.Eur Heart J, 2016, 37(23): 1799-1806.
[6] Tektonidou MG, Kravvariti E, Konstantonis G, et al.Subclinical atherosclerosis in systemic lupus erythematosus:comparable risk with diabetes mellitus and rheumatoid arthritis. Autoimmun Rev, 2017, 16(3): 308-312.
[7] Bessant R, Hingorani A, Patel L, et al. Risk of coronary heart disease and stroke in a large British cohort of patients with systemic lupus erythematosus. Rheumatology (Oxford), 2004,43(7): 924-929.
[8] Esdaile JM, Abrahamowicz M, Grodzicky T, et al. Traditional framingham risk factors fail to fully account for accelerated atherosclerosis in systemic lupus erythematosus. Arthritis Rheum, 2001, 44(10): 2331-2337.
[9] Apte M, Mcgwin G, Vilá LM, et al. Associated factors and impact of myocarditis in patients with SLE from LUMINA, a multiethnic US cohort (LV). Rheumatology (Oxford), 2008,47(3): 362-367.
[10] Mavrogeni S, Markousis-Mavrogenis G, Koutsogeorgo-poulou L, et al. Cardiovascular magnetic resonance imaging pattern at the time of diagnosis of treatment naïve patients. Int J Cardiol,2017, 236: 151-156.
[11] Ward MM. Premature morbidity from cardiovascular and cerebrovascular diseases in women with systemic lupus erythematosus. Arthritis Rheum, 1999, 42(2): 338-346.
[12] Libman E, Sacks B. A hitherto undescribed form of valvular and mural endocarditis. Arch Intern Med, 1924, 33(6): 701-737.
[13] Mohammed AG, Alghamdi AA, Aljahlan MA, et al.Echocardiographic findings in asymptomatic systemic lupus erythematosus patients. Clin Rheumatol, 2017, 36(3): 563-568.
[14] Roldan CA, Shively BK, Crawford MH. An echocardiographic study of valvular heart disease associated with systemic lupus erythematosus. N Engl J Med, 1996, 335(19): 1424-1430.
[15] Chen J, Tang Y, Zhu M, et al. Heart involvement in systemic lupus erythematosus: a systemic review and meta-analysis.Clin Rheumatol, 2016, 35(10): 2437-2448.
[16] Straus SM, Kors JA, De Bruin ML, et al. Prolonged QTc interval and risk of sudden cardiac death in a population of older adults. J Am Coll Cardiol, 2006, 47(2): 362-367.
[17] Myung G, Forbess LJ, Ishimori ML, et al. Prevalence of resting-ECG abnormalities in systemic lupus erythematosus:a single-center experience. Clin Rheumatol, 2017, 36(6): 1311-1316.
[18] Bourré-Tessier J, Urowitz MB, Clarke AE, et al.Electrocardiographic findings in systemic lupus erythematosus:data from an international inception cohort. Arthritis Care Res(Hoboken), 2015, 67(1): 128-135.
[19] Rivera-López R, Jiménez-Jáimez J, Sabio JM, et al.Relationship between QT interval length and arterial stiffness in systemic lupus erythematosus (SLE): a cross-sectional case-control study. PLoS One, 2016, 11(4): e0152291.
[20] 张巍, 杨秀华, 周振芳, 等. E-Tracking技术评价系统性红斑狼疮患者颈总动脉弹性的临床意义. 医学影像学杂志,2011, 21(1): 26-29.
[21] Niki K, Sugawara M, Chang Dehua, et al. A new noninvasive measurement system for wave intensity: evaluation of carotid arterial wave intensity and reproducibility. Heart Vessels,2002, 17(1): 12-21.
[22] Liu CL, Wang CZ, Wang Y, et al. Early evaluation of carotid elasticity by an instantaneous wave intensity technique in patients with systemic lupus erythematosus. J Ultrasound Med, 2014, 33(12): 2125-2129.
[23] 唐雪梅, 舒庆兰, 顾鹏, 等. 瞬时波强技术评价系统性红斑狼疮患者心血管系统功能. 中华医学超声杂志(电子版),2012, 9(4): 328-332.
[24] 李秀云, 任卫东, 肖卫国, 等. 超声二维应变成像早期评价系统性红斑狼疮患者颈动脉弹性. 中国医学影像技术,2009, 25(11): 2024-2026.
[25] Corretti MC, Anderson T, Benjamin EJ, et al. Guidelines for the ultrasound assessment of endothelial-dependent flowmediated vasodilation of the brachial artery. J Am Coll Cardiol, 2002, 39(2): 257-265.
[26] Wang DG, Tang XW, Fan Y, et al. Decreased flow-mediated dilatation in patients with systemic lupus erythematosus: a meta-analysis. Inflammation, 2014, 37(6): 2067-2075.
[27] Roldan CA, Joson J, Jsharraret J, et al. Premature aortic atherosclerosis in systemic lupus erythematosus. J Rheumatol,2010, 37(1): 71-78.
[28] Roldan CA, Alomari IB, Awad K, et al. Aortic stiffness is associated with left ventricular diastolic dysfunction in systemic lupus erythematosus: a controlled transesophageal echocardiographic study. Clin Cardiol, 2014, 37(2): 83-90.
[29] Ahmed S, Palevsky HI. Pulmonary arterial hypertension related to connective tissue disease: a review. Rheum Dis Clin North Am, 2014, 40(1): 103-124.
[30] Qian J, Wang Y, Huang C, et al. Survival and prognostic factors of systemic lupus erythematosus-associated pulmonary arterial hypertension: a PRISMA-compliant systematic review and meta-analysis. Autoimmun Rev, 2016, 15(3): 250-257.
[31] Kommireddy S, Bhyravavajhala S, Kurimeti K, et al.Pulmonary arterial hypertension in systemic lupus erythematosus May benefit by addition of immunosuppression to vasodilator therapy: an observational study. Rheumatology(Oxford), 2015, 54(9): 1673-1679.
[32] Kusunose K, Yamada H, Hotchi J, et al. Prediction of future overt pulmonary hypertension by 6-min walk stress echocardiography in patients with connective tissue disease.J Am Coll Cardiol, 2015, 66(4): 376-384.
[33] Nagueh SF, Smiseth OA, Appleton CP, et al.Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American society of echocardiography and the European association of cardiovascular imaging. J Am Soc Echocardiogr, 2016, 29(4): 277-314.
[34] Roldan CA. Diagnostic value of transesophageal echocardiography in Libman-Sacks endocarditis. Minerva Cardioangiol, 2009, 57(4): 467-481.
[35] Buss SJ, Wolf D, Korosoglou G, et al. Myocardial left ventricular dysfunction in patients with systemic lupus erythematosus: new insights from tissue Doppler and strain imaging. J Rheumatol, 2010, 37(1): 79-86.
[36] Khositseth A, Prangwatanagul W, Tangnararatchakit K, et al.Myocardial performance index in active and inactive paediatric systemic lupus erythematosus. Clin Exp Rheumatol, 2017, 35(2): 344-500.
[37] 吕运梅, 闫国珍, 刘扬. 应用Tei指数评价系统性红斑狼疮患者的右室功能. 中国医学创新, 2015, 12(16): 67-69, 70.
[38] 王新房, 谢明星. 超声心动图学. 第 5版. 北京: 人民卫生出版社, 2016: 134-143.
[39] Plazak W, Gryga K, Milewski M, et al. Association of heart structure and function abnormalities with laboratory findings in patients with systemic lupus erythematosus. Lupus, 2011,20(9): 936-944.
[40] Puntmann VO, D'cruz D, Smith Z, et al. Native myocardial T1 mapping by cardiovascular magnetic resonance imaging in subclinical cardiomyopathy in patients with systemic lupus erythematosus. Circ Cardiovasc Imaging, 2013, 6(2): 295-301.
[41] 高帅, 孙志丹, 徐静. 超声三维斑点追踪成像评价系统性红斑狼疮左心室整体收缩功能. 中国医学影像技术, 2016,24(1): 16-18.
[42] Bulut M, Acar RD, Acar Ş, et al. Evaluation of torsion and twist mechanics of the left ventricle in patients with systemic lupus erythematosus. Anatol J Cardiol, 2016, 16(6): 434-439.
[43] Roldan CA, Qualls CR, Sopko KS, et al. Transthoracic versus transesophageal echocardiography for detection of Libman-Sacks endocarditis: a randomized controlled study. J Rheumatol, 2008, 35(2): 224-229.
[44] Roldan CA, Tolstrup K, Macias L, et al. Libman-Sacks endocarditis: detection, characterization, and clinical correlates by three-dimensional transesophageal echocardiography. J Am Soc Echocardiogr, 2015, 28(7): 770-779.
[45] 沈世华, 李建卫, 吴松松, 等. 超声引导下心包穿刺置管引流术的应用价值. 医学影像学杂志, 2017, 27(4): 640-642.
[46] Tian DG, Jacobs AK, Benjamin EJ. A 19-year-old female with tamponade and systemic lupus erythematosus (SLE). Int J Cardiol, 2015, 179: 1-2.
