颌下腺导管癌的CT表现
2018-06-14刘永健
刘永健
涎腺导管癌(salivary duct carcinoma,SDC)是一类由涎腺导管分泌管或多形性腺瘤分泌管恶变而来的少见的高度恶性肿瘤,约占涎腺恶性肿瘤的1%~3%[1],大多数发生在腮腺,仅2.3%发生在颌下腺。由于颌下腺导管癌的发病率低,目前国内外有关该病CT表现的文献报道少见。笔者回顾性分析经手术病理学检查确诊的12例颌下腺导管癌患者的临床资料,总结颌下腺导管癌的CT表现特征,以期为临床提高对该病的认识提供帮助。
1 临床资料
1.1 一般资料 2005年1月至2017年8月本院经手术病理学检查确诊颌下腺导管癌12例,其中男7例,女5例;年龄39~76岁,平均56岁;病程 20d~1.5年,平均1.7个月;因颌下逐渐增大的质硬肿块而就诊8例,因颈部进行性增大的质硬肿块而就诊4例;伴有疼痛3例,伴有舌部麻木症状2例,伴有颈部淋巴结肿大7例。
1.2 CT检查 均采用荷兰PHILIPS Brilliance 16层CT机,平扫后均行增强扫描,管电压120kV,管电流320mA,准直器宽度0.75mm,扫描螺距为1.0,层厚3mm,层距3mm,扫描范围从听眦线向下至下颌骨颏部。CT增强扫描时经前臂肘静脉团注碘克沙醇注射液80~100ml(320mg I/ml,1.5ml/kg),注射流率 3.0ml/s,延迟45s增强扫描。由2位具有中级以上职称的放射科医师共同阅片,当意见不一致时,通过相互讨论以取得一致意见。
1.3 CT判读标准 CT增强扫描根据CT值增加情况将强化程度分为轻度(<20HU)、中度(21~40HU)、明显(>40HU)。平扫时病灶密度与胸锁乳突肌密度相比,分为低密度、等密度和混杂密度。钙化形式分为点状钙化、条状钙化、蛋壳样钙化。肿大淋巴结按国际7分区法进行分区[2],淋巴结转移CT诊断参照以下标准:颈部淋巴结(Ⅱ~Ⅴ区)短径≥6mm、纵隔淋巴结短径≥10mm,气管食管沟(Ⅵ区)出现淋巴结,无论大小均视为转移。
1.4 结果
1.4.1 CT表现
1.4.1.1 肿瘤的部位、数目、大小、形态 12例患者均为单发肿瘤,位于右侧8例,左侧4例;病灶侵犯大部分或整个颌下腺7例(图1a),病灶位于颌下腺的中心或边缘、侵犯部分颌下腺5例。病灶最大径1.8~7.2(3.5±0.6)cm,其中 1.0~2.0cm 者 2 例,2.0~3.0cm 者 3例,>3.0cm者7例。肿瘤呈类圆形肿块3例,不规则分叶状肿块9例(图1b)。
1.4.1.2 肿瘤密度 CT平扫病灶 (与胸锁乳突肌相比)呈低密度8例,混杂密度4例;病灶内见钙化8例,其中病灶内见圆点状钙化5例(图2a),见条状钙化3例;病灶呈实性3例,呈囊实性9例。
1.4.1.3 强化 CT增强检查病灶呈轻度强化2例,中度强化3例,明显强化7例(图2b),其中病灶呈环形强化4例,病灶内见增粗迂曲的血管影2例。
1.4.1.4 肿瘤边界及肿瘤与周围结构的关系 病灶边界清晰3例,边界不清9例,病灶与正常颌下腺分界模糊(图3a),其中病灶侵犯颌下腺周围深筋膜4例,侵犯皮肤3例,包绕下颌骨2例(图3b)。
1.4.1.5 颈部淋巴结转移情况 7例(58.3%)患者可见颈部肿大淋巴结,位于Ⅰ区2例、Ⅱ区4例、Ⅲ区1例,肿大淋巴结均呈囊实性,所有的淋巴结内均未见明显钙化,增强后呈环形强化(图4),中心坏死。
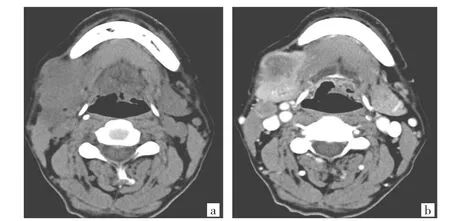
图1 患者男,57岁。右侧颌下腺导管癌(a:CT平扫示右侧颌下腺不规则分叶状软组织肿块,最大径约2.9cm,病灶侵犯大部分颌下腺,与正常颌下腺组织分界不清;b:增强扫描病灶呈环形强化,中心见大片状低密度无强化的坏死区)
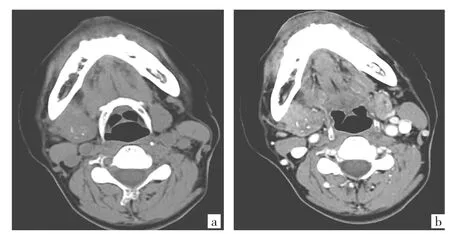
图2 患者女,68岁。右侧颌下腺导管癌(a:CT平扫示右侧颌下腺见不规则形略低密度占位灶,最大径约3.3cm,病灶侵犯整个颌下腺,内见散在圆点状钙化灶;b:增强扫描病灶呈明显强化,颌下腺周围深筋膜增厚)
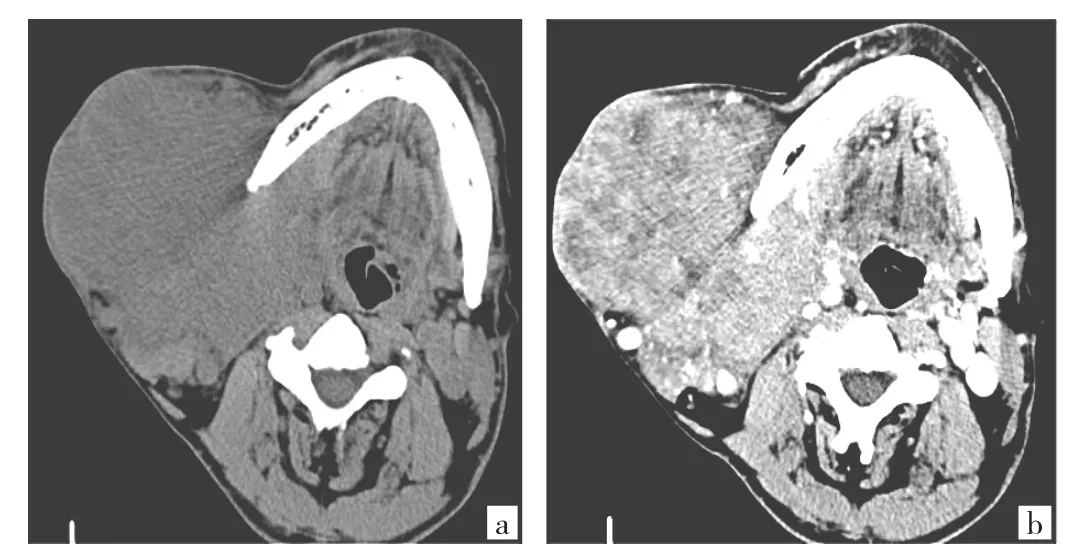
图3 患者男,79岁。右侧颌下腺导管癌(a:CT平扫示右侧颌下腺区见较大不规则分叶状的占位灶,最大径约7.0cm,右侧正常颌下腺结构消失;b:增强扫描见病灶明显强化,增强后CT值达110HU,内见多个囊状不强化的低密度区,肿瘤包绕下颌骨,侵犯局部皮肤)

图4 患者男,57岁。右侧颌下腺导管癌伴右颈淋巴结转移[CT增强扫描示右侧颈鞘周围(Ⅱ区)多发肿大淋巴结,呈明显环形强化]
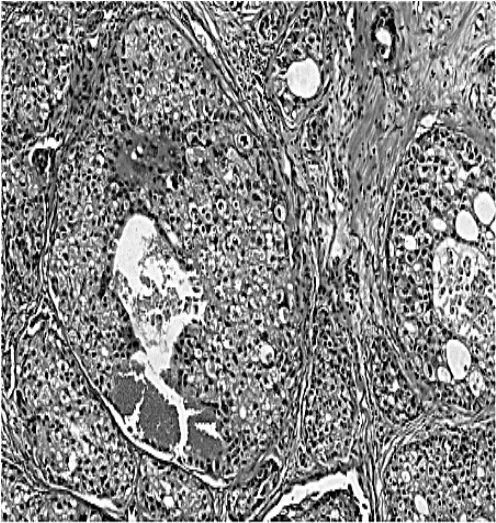
图5 颌下腺导管癌病理图片(显微镜下见肿瘤细胞体积较大,排列成乳头状,细胞质丰富,嗜伊红,间质为纤维结缔组织和血管;HE染色,×100)
1.4.2 病理学表现 肉眼观察肿瘤呈软组织结节,肿瘤没有包膜,边界不清,质地较硬,剖面呈褐色或灰白色,实性或囊实性,可见大小不等的囊性区,囊内含有暗红色液体。显微镜下见瘤细胞呈立方形或多边形,排列呈筛孔状、实性、乳头状,细胞质丰富,嗜伊红(图5),核大深染,常见2~3个核分裂。间质含有纤维结缔组织和较多的血管。免疫组织化学显示Ki-67、p53、大囊肿病液体蛋白15(GCDFP-15)、人类表皮生长因子受体-2(HER-2)呈阳性表达,而平滑肌肌动蛋白(SMA)、S-100蛋白呈阴性表达。
2 讨论
2.1 临床与病理 颌下腺导管癌临床常表现为一侧颌下或颈部进行性增大的软组织肿块,肿瘤所在部位的神经如面神经、舌神经和舌下神经常受累,常出现局部疼痛、舌部麻木及口角歪斜等症状[2]。病程较短,从几个月至数年不等,好发于老年男性患者,发病高峰年龄在50~65岁,男女发病率约为4~5:1[3]。颈部淋巴结转移和血行转移发生率高,预后较差,多数患者在1年内死亡。SDC的治疗原则为根治性手术,术后放、化疗可以提高患者的生存率。
大体病理上肿瘤常为单发肿块,没有包膜,边界不清,质地较硬,切面可呈褐色或红白色,囊实性,可见大小不等的囊性区。显微镜下见肿瘤细胞呈多角形或立方形,排成实性、筛孔状或乳头状,向周围软组织内浸润,病理性核分裂多见,细胞质丰富,嗜伊红,肿瘤间质为纤维结缔组织和血管,可有淋巴细胞浸润。免疫组织化学显示 Ki-67、p53、GCDFP-15、HER-2 等呈阳性表达,而SMA、S-100蛋白呈阴性表达。
2.2 CT表现 颌下腺导管癌常为单侧、单发病灶,肿瘤最大径0.9~6.0cm,常>3.0cm[4-5]。本组12例颌下腺导管癌均为单侧、单发病灶,肿瘤最大径为1.8~7.2cm,>3.0cm者7例。肿瘤没有包膜,呈蟹足状向周围渗透性生长,影像上表现为不规则分叶状软组织肿块[6],与正常颌下腺分界不清,肿瘤常侵犯大部分颌下腺或整个颌下腺,颌下腺失去正常形态,并可以突破颌下腺轮廓而累及周围的组织结构[7-8]。本组患者中病灶呈不规则分叶状软组织肿块9例,7例侵犯大部分或整个颌下腺,其中病灶侵犯颌下腺周围深筋膜4例,侵犯皮肤3例,包绕下颌骨2例,表现其高度侵袭性的生物学特点。CT平扫病灶呈低密度(与肌肉组织相比)或混杂密度。有文献指出,边界不清伴有钙化的涎腺软组织肿块可以提示SDC的诊断[9]。肿瘤生长迅速,血供不足,容易发生缺血、坏死,密度常不均匀,呈囊实性[10]。本组患者中病灶呈低密度8例,混杂密度4例;8例伴有钙化,病灶呈囊实性9例。肿瘤细胞丰富,间质中含有较多的血管,增强扫描肿瘤强化明显[11]。本组患者中病灶呈明显强化7例,轻中度强化5例,以明显强化的比例较高,与文献报道相符。SDC早期就可以见到病灶周围的血管和淋巴管内有瘤栓形成,因此容易伴有颈部淋巴结转移,有文献报道发生率约为43~67%[12],肿大的淋巴结常位于颈部的Ⅰ、Ⅱ、Ⅲ区,以病灶周围的Ⅱ区最为常见,呈囊实性,增强扫描呈环形强化,中心坏死。本组12例患者中7例伴有颈部淋巴结肿大,Ⅰ区2例、Ⅱ区4例、Ⅲ区1例,肿大淋巴结大部分呈环形强化。
2.3 鉴别诊断
2.3.1 颌下腺多形性腺瘤 颌下腺最常见的良性肿瘤,好发于中青年女性患者,病灶多位于颌下腺边缘,与正常颌下腺分界清晰,边缘光整、密度均匀,平扫呈等密度影,增强后轻中度强化,延迟扫描因肿瘤含有较多的间质成分而呈渐进性强化[13]。而SDC没有包膜,呈浸润性生长,病灶边缘常不光整,累及颌下腺大部分或整个颌下腺,常侵犯周围的组织结构,增强扫描早期即呈明显强化,强化程度明显高于多形性腺瘤。
2.3.2 颌下腺其他恶性肿瘤 以腺样囊性癌和腺泡细胞癌最为多见。腺样囊性癌多见于老年女性,病灶边界不清,有沿着神经跳跃性地侵犯周围组织结构的特点[14],颈部淋巴结转移发生率相对高,与SDC有所不同。腺泡细胞癌以膨胀性生长为主,病灶常有线状强化的完整或不完整的包膜,强化明显,类似良性肿瘤的特征,只有当肿瘤较大时(>3cm)才突破包膜呈浸润性生长,与SDC有所不同。
2.3.3 恶性淋巴瘤 肿瘤密度均匀,边缘光整,无明显钙化及坏死,增强扫描轻度-中度强化,肿瘤较大时可以沿着颌下腺外形铸形生长,但一般不侵犯周围组织结构,伴有的颈部肿大淋巴结常密度均匀,轻度强化,无明显坏死及钙化,与颌下腺原发肿瘤的特点一致,两者易于鉴别。
2.3.4 颌下腺慢性炎症 常表现为单侧或双侧颌下腺弥漫增大[15],边缘较光整,增强后呈不均匀明显强化,腺体内低密度占位灶不明确,另外常伴导管内结石及导管扩张,抗炎治疗后病灶明显缩小,有助于鉴别。
综上所述,边界不清伴有钙化,强化明显,容易坏死的颌下腺肿块及伴有颈部Ⅱ区环形强化的肿大淋巴结,可以提示颌下腺导管癌的诊断,CT检查可以显示肿瘤的范围以及肿瘤与周围结构的关系、颈部淋巴结转移情况,有利于肿瘤分期,从而为临床制定个性化、合理的治疗方案提供依据。
[1]Guzzo M,DiPalma S,Grandi C,et al.Salivary duct carcinoma:clinical charac and treatment strategies[J].Head Neck,1997,19(4):126-133.doi:10.1002/(SICI)1097-0347(199703)19:2<126::AID-HED7>3.0.CO;2-6.
[2]陈宪.颌下腺癌的CT诊断[J].临床放射学杂志,1995,14(4):207-208.doi:1671-7651(2009)06-O753-03.
[3]陈飞进,江明祥,邵国良,等.16例腮腺导管癌的临床病理和CT表现分析[J].肿瘤学杂志,2015,21(5):436-439.doi:10.11735/j.issn.1671-170X.2015.05.B019.
[4]陈亮,黄晓峰,胡勤刚,等.303例颌下腺肿瘤临床病理分析[J].口腔医学研究,2009,12(6):753-755.
[5]江明祥,邵国良,孙晶晶,等.涎腺导管癌的CT和MR表现[J].中华放射学杂志,2014,48(11):906-909.doi:10.3760/cma.J.issn.1005-1201.2014.11.006.
[6]Okada F,Honda K,Ando Y,et al.Salivary duct carcinoma of the extra-glandular segment of Stensen's duct:radiological findings and pathologicalcorrelation [J].EurRadiol,2009,19 (6):254-257.doi:10.1007/s00330-008-1026-6.
[7]俞炎平,邝平定,张亮,等.颌下腺恶性肿瘤的CT表现[J].浙江医学,2012,34(12):1068-1070.
[8]范建忠,张玮,王兆元,等.颌下腺良恶性占位性病变CT表现与诊断价值[J].福建医药杂志,2015,37(6):136-139.doi:002-2600(2015)06-0136-04.
[9]Fenean DI,Lenghel M,Baciu,G,et al.Ultrasound and CT imaging features in a patient with salivaryduct carcinoma of the parotid gland:a case report with literaturereview [J].Med-Ultrason,2015,17(1):119-122.doi:10.11152/mu.2013.2066.171.dif.
[10]克热木·阿巴司,陈青立,凌彬,等.涎腺导管癌10例临床分析[J].口腔医学研究,2016,32(7):712-715.doi:10.13701/j.cnki.kqyxyj.2016.07.012.
[11]葛莹,董越,伍健林,等.颌下腺肿瘤的MSCT诊断(附43例分析)[J].实用放射学杂志,2011,27(6):852-855.doi:10.3969/j.issn.1002-1671.2011.06.009.
[12]Hosal AS,Fan C,Barnes L,et al.Salivary duct carcinoma[J].Otolaryngol Head Neck Surg,2003,129(8):720-725.doi:10.1016/S0194-5998(03)01386-X.
[13]谌业荣,王亚非,胡曙东,等.颌下腺多形性腺瘤的CT诊断及鉴别诊断[J].医学影像学杂志,2012,22(1):9-12.doi:ISSN:1006-9011/2012)01-0009-04.
[14]顾雅佳,王玖华,王弘士,等.头颈部腺样囊性癌的CT影像分析[J].中华放射学杂志,2000,34(9):601-604.
[15]朱红霞,汤雷军,程大保,等.颌下腺慢性炎症的CT检查分析[J].浙江医学,2015,37(2):153-155.
