沉默β-catenin表达对胃癌MGC-803细胞生物学行为的影响与作用机制研究
2018-06-14潘安萍朱建伟王忻妍
潘安萍 朱建伟 王忻妍
β-链蛋白(β-catenin)是一种多功能的蛋白质。在正常细胞内,β-catenin多数位于细胞膜,与E钙黏蛋白及α-catenin一起在细胞间的黏附中发挥关键作用[1]。β-catenin若脱离细胞膜进入细胞质,易被降解,但当β-catenin在细胞内发生降解异常时,β-catenin会在细胞内堆积,进入细胞核促进下游靶基因的转录,即β-catenin的另一重要功能-参与Wnt信号通路[2]。β-catenin下游靶基因编码许多调节细胞生物学行为的相关蛋白,如 c-Myc、cyclin D1、Bcl-2、Bax、基质金属蛋白酶(MMP)-7等,即β-catenin作为转录因子有可能影响细胞增殖、分化、侵袭、转移等多种生物学行为,且有研究发现β-catenin在多种肿瘤细胞中明显高表达[3]。基于此,本研究应用干扰慢病毒感染β-catenin相对高表达的胃癌细胞株MGC-803,沉默其细胞内β-catenin表达,而后通过多种实验方法观察β-catenin表达下调对MGC-803细胞增殖、凋亡、侵袭、转移等生物学行为的影响,同时检测沉默β-catenin表达后的MGC-803细胞中Bcl-2、Bax、cyclin D1和MMP-7等蛋白表达水平的变化,初步探讨β-catenin下调影响胃癌MGC-803细胞生物学行为可能的作用机制,现报道如下。
1 材料和方法
1.1 细胞与主要试剂 MGC-803细胞株购自上海博谷生物科技有限公司。β-catenin-RNAi慢病毒液、βcatenin-Neg慢病毒液购于上海吉玛公司;凋亡检测AnnexinV-PE/7-AAD试剂盒、细胞周期碘化丙啶(PI)染色试剂盒购于南京凯基生物有限公司;Matrigel胶购于美国BD公司;兔抗人β-catenin单克隆抗体购于美国Santan Cruz公司;鼠抗人β-actin、羊抗鼠IgG-HRP、羊抗兔IgG-HRP单克隆抗体均购于中杉金桥公司。
1.2 方法
1.2.1 实验分组 分别将购买的β-catenin-RNAi慢病毒及β-catenin-Neg慢病毒感染MGC-803细胞,实验分组:实验组(感染β-catenin-RNAi慢病毒的MGC-803-RNAi细胞)、阴性对照组(感染空载慢病毒的MGC-803-Neg细胞)、空白对照组(未处理的MGC-803细胞)。
1.2.2 病毒感染与细胞培养 根据预实验得知该病毒对MGC-803细胞的感染复数约为100,将MGC-803细胞接种于6孔板,待细胞贴壁后实验组与阴性对照组细胞分别滴加相应慢病毒液,空白对照组加等体积培养基。24h后换液,3d后荧光倒置显微镜下观察细胞荧光染色情况。感染效率=带绿色荧光细胞数/总细胞数×100%。
1.2.3 Western blot检测细胞 β-catenin、Bcl-2、Bax、cyclin D1及MMP-7表达水平 用蛋白提取试剂盒提取各组细胞内的总蛋白,分别取20μl进行聚丙烯凝胶电泳,结束后目的蛋白条带转移至硝酸纤维素(NC)膜,5%的脱脂奶粉封闭1h,一抗(1:1 000)4℃封闭过夜,二抗(1:2 500)室温封闭1h。暗室内用发光液进行曝光、显影、定影,得到目的蛋白条带的胶片,用Image J软件检测各组细胞 β-catenin、Bcl-2、Bax、cyclin D1 及 MMP-7相对表达水平。实验重复3次取平均值。
1.2.4 Annexin-V-PE/7-AAD双染流式细胞术检测各组细胞凋亡率 将各组细胞分别接种于6cm培养皿常规培养。待细胞长至约80%~90%融合度时收集细胞,PBS洗涤2次,加入500 μl的Binding Buffer悬浮细胞,加入1 μl Annexin V-PE染液,室温、避光、反应15min,加入5 μl 7-AAD染液,室温、避光、反应15min。过300目尼龙网后1h内进行流式细胞术检测细胞凋亡率。实验重复3次取平均值。
1.2.5 PI单染流式细胞术检测各组细胞周期 取各组细胞分别接种于6cm培养皿常规培养,待细胞长至约80%~90%融合度时收取细胞,每组细胞取约1×105个。用PBS清洗2次后用预冷的75%乙醇溶液1ml重悬细胞沉淀,4℃固定过夜。第2天1 000r/min离心5min后去固定液,PBS清洗2次,加入100μl的RNase A重悬细胞沉淀,置于37℃水浴锅内30 min,加入PI染料400μl,4℃避光染色30min。过300目尼龙网后,流式细胞术检测细胞周期。实验重复3次取平均值。
1.2.6 Transwell法检测细胞的侵袭能力 将融好的Mtrigel胶与含10%BSA的1640培养基按体积比1:6混合,后取50μl平铺于小室的上室面。收集各组细胞,PBS清洗2次,用完全培养基稀释成1×105/ml的细胞悬液。小室的下室面各加入含10%FBS的1640完全培养基500μl,上室面加入200μl各组细胞悬液,培养24h后取出小室,擦拭上室面未穿膜的细胞后结晶紫染色,显微镜下计数穿膜细胞数分析细胞侵袭能力。实验重复3次取平均值。
1.3 观察指标 观察并比较MGC-803、MGC-803-Neg、MGC-803-RNAi细胞荧光染色情况、β-catenin 表达水平、细胞凋亡率、细胞周期、侵袭能力,以及Bcl-2、Bax、cyclin D1、MMP-7 蛋白表达水平。
1.4 统计学处理 应用SPSS 17.0统计软件;计量资料以表示,3组比较采用单因素方差分析,两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞荧光染色情况比较 感染4d后,荧光显微镜下可见MGC-803-Neg、MGC-803-RNAi细胞显示强绿色荧光,且带绿色荧光的细胞数占总细胞数比例均超过80%,而MGC-803细胞无绿色荧光,即MGC-803-Neg、MGC-803-RNAi细胞慢病毒感染效率>80%。MGC-803-RNAi细胞荧光染色情况见图1(插页)。

图1 MGC-803-RNAi细胞荧光显微镜下所见(×100)
2.2 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞β-catenin表达水平比较 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞β-catenin相对表达水平分别为0.8725±0.0110、0.8593±0.0074、0.4220±0.0164,3 组比较差异有统计学意义(P>0.05),MGC-803-RNAi细胞β-catenin表达水平较MGC-803、MGC-803-Neg细胞下调(均P<0.05),而MGC-803-Neg细胞与MGC-803细胞间比较无统计学差异(P>0.05)。MGC-803、MGC-803-Neg、MGC-803-RNAi细胞 β-catenin蛋白电泳图比较见图2。

图2 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞 β-catenin蛋白电泳图比较(a:MGC-803 细胞;b:MGC-803-Neg细胞;c:MGC-803-RNAi细胞)
2.3 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞凋亡率比较 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞凋亡率分别为(1.20±0.26)%、(1.35±0.35)%、(8.52±0.82)%,3组比较差异有统计学意义(P>0.05),MGC-803-RNAi细胞凋亡率高于 MGC-803、MGC-803-Neg细胞(均P<0.05),而 MGC-803-Neg细胞与MGC-803细胞间比较无统计学差异(P>0.05)。流式细胞术检测 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞凋亡率比较见图3。
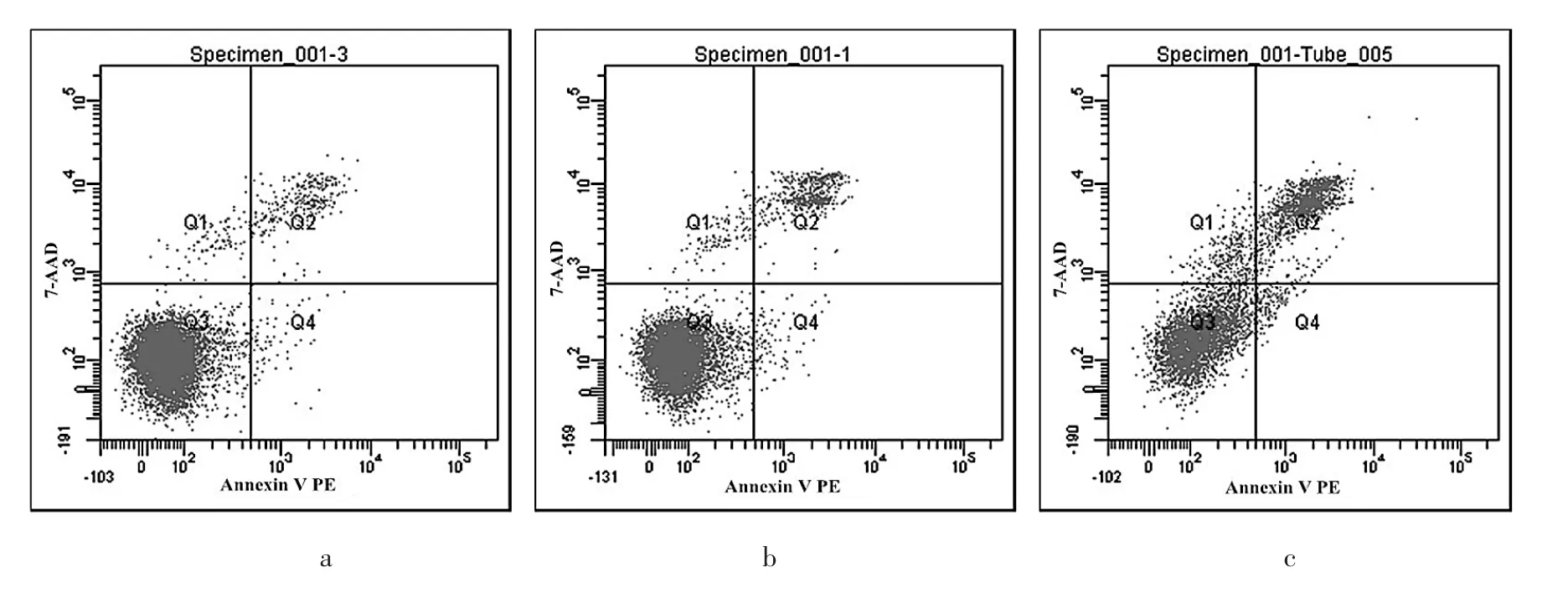
图3 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞凋亡率比较(a:MGC-803 细胞;b:MGC-803-Neg细胞;c:MGC-803-RNAi细胞)
2.4 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞周期比较 以S/G1期细胞比例为观察指标,MGC-803、MGC-803-Neg、MGC-803-RNAi细胞分别为 (1.11±0.05)%、(1.09±0.10)%、(0.78±0.08)%,3 组比较差异有统计学意义(P >0.05),MGC-803-RNAi细胞 S/G1期比例低于 MGC-803、MGC-803-Neg细胞(均P<0.05),而MGC-803-Neg细胞与MGC-803细胞间比较无统计学差异(P>0.05)。流式细胞术检测MGC-803、MGC-803-Neg、MGC-803-RNAi细胞周期结果比较见图4(插页)。

图4 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞周期结果比较(a:MGC803 细胞;b:MGC803-Neg细胞;c:MGC803-RNAi细胞)
2.5 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞侵袭能力比较 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞穿膜染色数分别为(109.80±5.36)、(104.40±7.47)、(54.00±6.28)个,3 组比较差异有统计学意义(P>0.05),MGC-803-RNAi细胞侵袭能力低于 MGC-803、MGC-803-Neg细胞(均P<0.05),而 MGC-803-Neg细胞与MGC-803细胞间比较无统计学差异(P>0.05)。Transwell法检测 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞侵袭能力实验结果见图5(插页)。

图5 MGC-803、MGC-803-Neg、MGC-803-RNAi穿膜细胞显微镜下所见比较(a:MGC803 细胞;b:MGC803-Neg 细胞;c:MGC803-RNAi细胞;结晶紫染色,×200)
2.6 MGC-803、MGC-803-Neg、MGC-803-RNAi 细胞 Bcl-2、Bax、cyclin D1及MMP-7蛋白表达水平比较 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞Bcl-2、Bax、cyclin D1及 MMP-7蛋白表达水平比较差异均有统计学意义(均P>0.05),MGC-803-RNAi细胞Bcl-2、cyclin D1、MMP-7蛋白表达水平均低于MGC-803、MGC-803-Neg细胞(均P<0.05),Bax蛋白表达水平高于 MGC-803、MGC-803-Neg细胞(均P<0.05),而MGC-803-Neg细胞与MGC-803细胞间比较无统计学差异(P >0.05)。MGC-803、MGC-803-Neg、MGC-803-RNAi细胞 Bcl-2、Bax、cyclin D1 及 MMP-7 蛋白电泳图比较见图6。
3 讨论
β-catenin是一种多功能、进化保守的蛋白质分子,在多细胞生物的胚胎发育及机体稳态中发挥至关重要的作用。研究发现,在肿瘤的发生、发展过程中,一方面β-catenin作为一种转录活化因子,能介导多种原癌基因与细胞周期调控基因的转录翻译,促进细胞增殖、侵袭及转移,抑制细胞分化、凋亡,还能诱导肿瘤耐药,另一方面,肿瘤细胞中β-catenin在细胞质内的异常定位导致细胞膜上β-catenin含量下降,易使癌细胞间黏附功能下降,致肿瘤细胞更易于脱离原发部位而发生远处转移[3]。β-catenin参与调控上述生物学行为的靶基因编码蛋白包含 c-Myc、cyclin D1、Bcl-2、Bax、MMP-7、P-gp等[3]。本研究选取β-catenin相对高表达的胃癌MGC-803细胞进行实验,通过干扰慢病毒感染MGC-803细胞,经感染成功的MGC-803细胞在荧光显微镜下有明显的荧光显示;并通过Western blot法证实MGC-803-RNAi细胞β-catenin表达水平明显下调。本研究再将此稳定穿代的3株细胞(MGC-803-RNAi、MGC-803-Neg及MGC-803细胞)进行后续实验,以了解βcatenin表达下调对MGC-803细胞生物学行为的影响及其可能的作用机制。
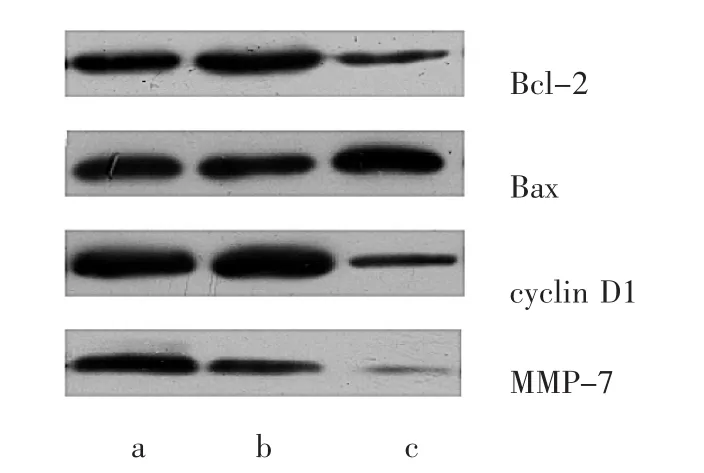
图6 MGC-803、MGC-803-Neg、MGC-803-RNAi细胞 Bcl-2、Bax、cyclin D1及 MMP-7蛋白电泳图比较(a:MGC-803细胞;b:MGC-803-Neg细胞;c:MGC-803-RNAi细胞)
本研究采用Annexin-V-PE/7-AAD双染流式细胞术证实β-catenin表达的下调可促进MGC-803细胞凋亡。这与在肠癌细胞中得到的结果一致[4]。细胞凋亡过程主要受Bcl-2蛋白家族所调控,其中最具代表性的为Bax及Bcl-2蛋白,Bax促进细胞凋亡,而Bcl-2抑制细胞凋亡[5]。本研究检测到沉默β-catenin表达之后的MGC-803-RNAi细胞Bcl-2表达水平明显下调,而Bax表达水平则相对上调,结果同预期。笔者推测,β-catenin表达异常对MGC-803细胞凋亡的影响,其机制与影响Wnt/β-catenin信号通路下游靶蛋白Bax及Bcl-2的表达有关。cyclin是一类在细胞周期中发挥关键调节作用的蛋白,其中cyclin D1能调细胞周期由G1期顺利进入到S期[6]。本研究干扰MGC-803细胞β-catenin的表达后发现MGC-803-RNAi细胞cyclin D1表达水平也下调,且出现明显的G1期阻滞,细胞增殖减弱。这与Shtutman等[7]研究结果相符。笔者推论,沉默β-catenin表达使MGC-803细胞阻滞在G1期,其作用机制与Wnt/β-catenin信号通路下游靶蛋白cyclin D1表达下调有关。
胃癌细胞转移是胃癌患者治疗失败的主要原因。β-catenin作为细胞黏附中的关键因子,当其在细胞膜中减少时,细胞间黏附功能下降,导致肿瘤细胞易脱离原发部位。但是游离出来的肿瘤细胞要在细胞间质中进行迁徙,必须能够分解细胞外基质。在细胞外基质的众酶中,MMP起着关键的作用[8]。研究显示,MMP家族蛋白酶的表达受Wnt/β-catenin信号通路调控,其中MMP-7蛋白与肿瘤关系最密切,MMP-7普遍被发现在肿瘤组织及细胞中明显高表达,且MMP-7在相对晚期的胃癌组织中阳性率明显高于相对早期的胃癌组织[9]。本研究通过Transwell实验方法发现,沉默β-catenin表达之后,MGC-803-RNAi细胞的侵袭力显著下降,且MGC-803-RNAi细胞内MMP-7的表达水平也明显下降。因此推论β-catenin沉默抑制MGC-803细胞侵袭能力与Wnt/β-catenin信号通路下游靶蛋白MMP-7表达水平下调有关。这一结果与在肠癌、食管癌中的研究相似[10]。
综上所述,本研究结果显示,β-catenin表达下调可影响胃癌MGC-803细胞的增殖、凋亡、侵袭等多种生物学行为,其作用机制可能与影响Wnt/β-catenin信号通路下游多种靶蛋白表达有关。
[1]Archbold HC,Yang YX,Chen L,et al.How do they do Wnt they do?:regulation of transcription by the Wnt/β-catenin pathway[J].Acta Physiologica,2012,204(1):74.
[2]Hecht A,Litterst CM,Huber O,et al.Functional characterization of multiple transactivating elements in beta-catenin,some of which interact with the 1'ATA-binding protein in vitro[J].J Biol Chem,1999,274(25):18017-18025.
[3]Polakis P.Wnt signaling and cancer[J].Genes&Development,2000,14(15):1837-1851.
[4]Lu W,Jia G,Meng X,et al.Beta-catenin mediates the apoptosis induction effect of celastrol in HT29 cells[J].Life sciences,2012,91(7):279-283.
[5]Hancock JT,Desikan R,Neill SJ.Role of reactive oxygen species in cell signalling pathways[J].Biochemical Society Transactions,2001,29(2):345-349.
[6]Brunelle JK,Letai A.Control of mitochondrial apoptosis by the Bcl-2 family[J].Journal of cell science,2009,122(4):437-441.
[7]Shtutman M,Zhurinsky J,Simcha I,et al.The cyclin D1 gene is a target of the β-catenin/LEF-1 pathway[J].Proceedings of the National A-cademyof Sciences,1999,96(10):5522-5527.
[8]Deryugina EI,Quigley JP.Matrix metalloproteinases and tumor metastasis[J].Cancer and Metastasis Reviews,2006,25(1):9-34.
[9]Brabletz T,Jung A,Dag S,et al.β-catenin regulates the expression of the matrix metalloproteinase-7 in human colorectal cancer[J].The American journal of pathology,1999,155(4):1033-1038.
[10]Minamoto T,Ougolkov A,Yamashita K,et al.Oncogenic beta-catenin and MMP-7(matrilysin)cosegregate in late stage clinical colon cancer[J].Proceedings of the American Association for Cancer Research,2004,2004(1):1170.
