不同分级脑白质疏松症患者血清胱抑素C水平的临床意义
2018-06-13陆冰刘洲王俊贤陈煜森赵斌
陆冰 刘洲 王俊贤 陈煜森 赵斌
脑白质疏松症(leukoaraiosis,LA)是指脑室周围或半卵圆中心白质区斑点状或斑片状改变,是常见的脑白质病变,主要发病机制是脑小血管病变导致所支配的脑白质区域慢性低灌注损伤。基于肾小血管和脑小血管解剖结构的相似性,推测肾功能损伤与脑白质之间可能存在一定的联系,血清胱抑素C(Cys-C)是一种用于评估肾功能损伤的敏感指标[1],笔者通过测定不同分级LA患者Cys-C水平的变化,探讨其临床意义。
1 对象和方法
1.1 对象 选取2015年1月至2017年9月我院收治的LA患者83例,按照Fazekas评分标准[2]分为3组:轻度(1级:脑白质呈现局灶性损害)组24例,中度(2级:早期融合性病灶)组32例,重度(3级:弥漫性融合性病灶)组27例。纳入标准:3.0TMRI检查结果符合LA特征性改变[3]。排除标准:(1)急性或陈旧性大面积脑梗死;(2)存在直径>2cm的侧脑室旁梗死病灶;(3)中枢系统脱髓鞘疾病:如多发性硬化、视神经脊髓炎等;(4)颅内肿瘤或感染性疾病;(5)自身免疫系疾病、帕金森病、阿尔茨海默病、脑出血等。本研究经本院伦理委员会同意,所有患者均知情同意。
1.2 方法 入院时收集患者的基本临床资料,抽取清晨空腹静脉血8ml,在全自动血液生化分析仪上检测Cys-C、空腹血糖(FPG)、总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白(LDL-C)、血尿酸(UA)。采用颈动脉超声测定颈动脉内膜中层厚度(IMT),取平均值。
1.3 认知功能评定 由经过规范培训的医师对所有患者在入院时采用蒙特利尔认知评价量表(MoCA)进行认知功能评估,主要包括7个方面:视空间与执行力、命名、注意力、语言、抽象思维、延迟回忆、定向力。MoCA总分30分,如果患者的受教育时间<12年,则在结果评分上再加1分进行偏倚校正。MoCA<26分认为其存在认知功能损害。
1.4 统计学处理 应用SPSS17.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料组间比较采用χ2检验。多因素分析采用有序多分类logistic回归。两变量间关系分析采用Spearman相关。P<0.05为差异有统计学意义。
2 结果
2.1 不同分级LA患者一般临床资料比较 3组患者性别、年龄、BMI、FPG、UA、血脂指标、吸烟史、糖尿病比例、冠心病比例、肾脏疾病比例、文化程度比较均无统计学差异(均P>0.05)。但3组患者的IMT值、高血压病比例、腔隙性脑梗死(LACI)比例均依次增高,3组间比较差异均有统计学意义(均P<0.05),详见表1。
2.2 不同分级LA患者血清Cys-C水平的比较 轻度组、中度组、重度组血清Cys-C水平分别为(0.87±0.21)、(0.91±0.24)、(1.64±0.42)mg/L,依次升高,3 组间比较差异均有统计学意义(P<0.05)。
2.3 血清Cys-C水平与LA严重程度的相关性分析将P<0.05的变量纳入logistic回归方程,分析显示:血清Cys-C水平是LA严重程度增加的独立危险因素(OR=2.782,P=0.003),详见表2。进一步校正其他危险因素后,Spearman相关分析显示,血清Cys-C水平与LA严重程度呈正相关(r=0.351,P=0.001)。
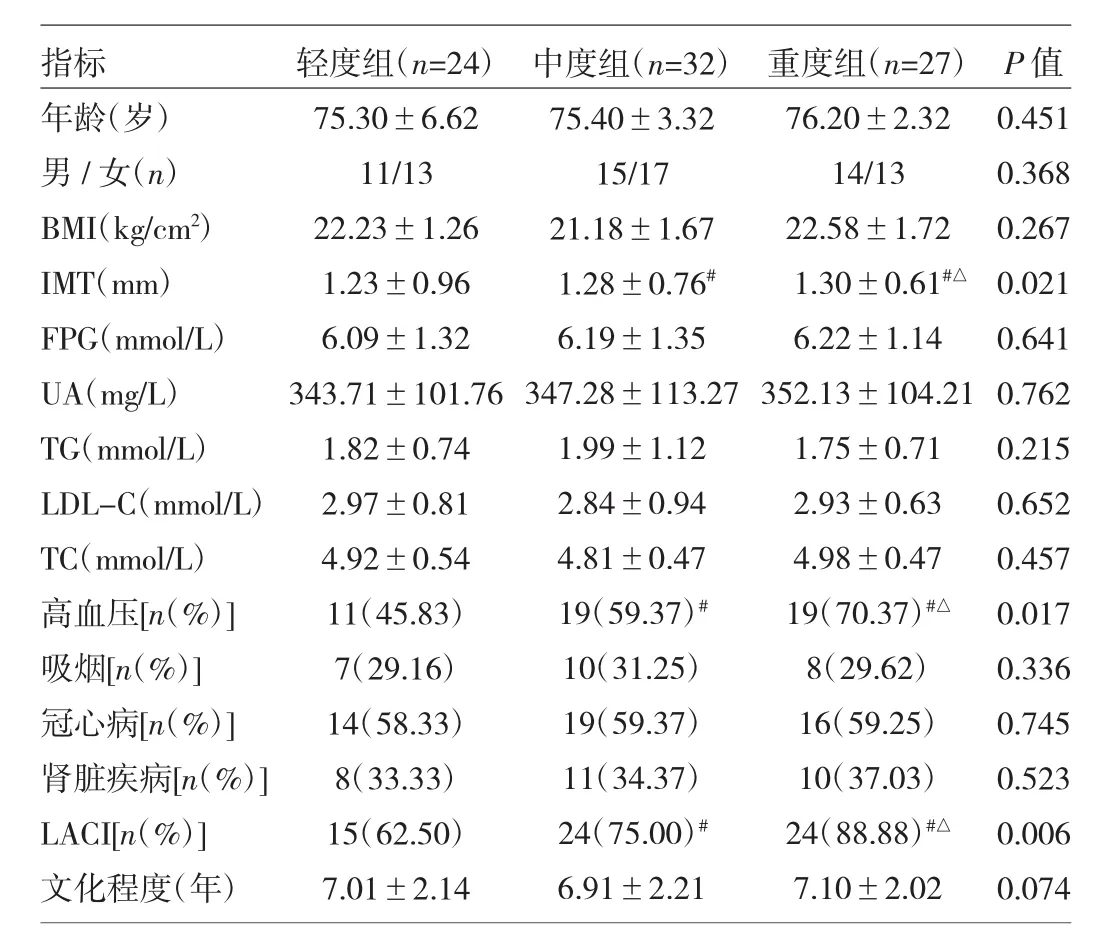
表1 不同分级LA患者一般临床资料的比较
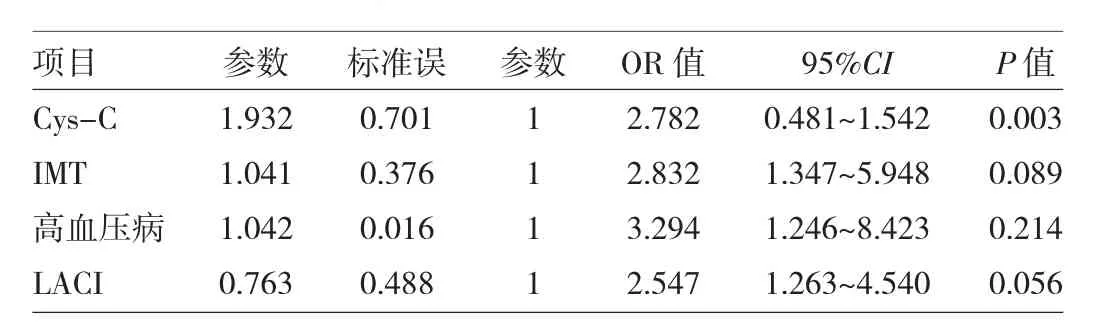
表2 logistic回归分析LA各危险因素
2.4 不同分级LA患者MoCA量表各项目评分的比较不同分级LA患者MoCA总评分、MoCA量表中的视空间与执行力、命名、语言、延迟回忆、定向力、注意与计算力比较差异均有统计学意义(均P<0.05);轻度组、中度组、重度组上述评分依次降低,3组间比较差异有统计学意义(均 P<0.05),详见表 3。
2.5 血清Cys-C水平与认知功能的相关性分析 血清Cys-C水平与MoCA总评分及项目中的视空间与执行力、命名、语言、延迟回忆、注意与计算力的评分均呈负相关(均P<0.05);与抽象、定向力评分的相关性差异均无统计学意义(均P>0.05),详见表4。
3 讨论
LA是脑小血管病引起脑组织损害的一个重要影像学征象,随着神经影像学的发展,LA的检出率日趋增高。LA是认知损害的独立危险因素[4-5],发病隐匿,容易被忽视以致发展为痴呆[6]。因此,寻求一种敏感、有效的生物学标记物,预测LA的发生及进展意义重大。
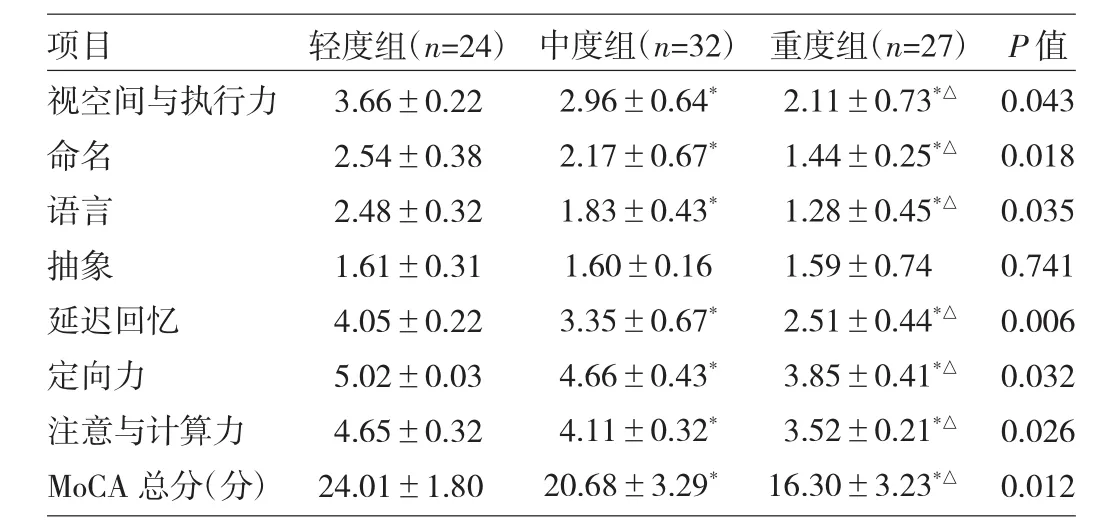
表3 不同分级LA患者MoCA量表各项目评分比较(分)
除了传统的肌酐、肾小球滤过率等外,Cys-C不易受年龄、饮食、炎症等因素影响,是一种敏感且有效反映肾功能的新一代标记物[7]。肾小血管与脑小血管的解剖结构、血流动力学具有一定的相似性,肾功能指标与脑小血管病密切相关[8-9]。一项对日本社区人群的横断面研究发现[10],肾功能异常与脑白质病变的体积呈一致的相关性,提示肾脏指标对LA具有一定的提示作用。本研究发现,血清Cys-C水平在不同程度的脑白质病变之间比较差异均有统计学意义,随着LA严重程度的进展,Cys-C水平也呈递增趋势,相关性分析显示两者呈正相关,提示血清Cys-C水平升高可能预示较为严重的脑白质损害。最新研究表明,传统的血管危险因素能解释70%大动脉粥样硬化性病变,却只能解释1.4%~2%的LA病变[11],而高血压及IMT值被证明对大多数LA有重要意义[12]。本研究发现轻度组、中度组、重度组的高血压病比例、IMT值依次增高,证实了这些危险因素参与了脑白质损害的进程,与其它研究结果基本一致。本研究再进一步排除了这些危险因素干扰后,血清Cys-C水平的升高仍能独立预测LA严重程度的增加,提示Cys-C对脑白质的损害并不完全依赖于其它危险因素,较传统脑小血管危险因素更为准确、敏感反映LA的严重程度。目前,血清Cys-C和LA相互关联的病理生理机制尚未明确,有研究认为LA发病机制是由于慢性缺血引起的白质区域神经元脱髓鞘和血脑屏障破坏。血清Cys-C可透过血脑屏障,与内皮细胞结合激活炎症反应,引起脑小血管损害[13],使血脑屏障破坏渗透性更大,造成脑白质疏松的进展。

表4 血清Cys-C水平与MoCA量表总分及各亚型评分的相关性
越多的研究表明,LA患者容易出现不同程度的认知功能障碍[14-15],最近一篇Meta分析结果显示LA对整体认知功能的影响[16]。基于MoCA在早期发现认知功能损害方面有一定的优势,本研究采用MoCA量表进行认知评定,发现不同分级LA患者MoCA评分存在差异,主要体现在视空间与执行力、命名、语言、延迟回忆、定向力、注意与计算力等方面,提示不同分级LA对认知功能有很大影响,脑白质疏松程度越深,患者认知功能越严重,可能的机制与LA的白质损害直接阻断认知功能联络的神经纤维有关[17]。基础研究表明,血清Cys-C与AB样淀粉蛋白聚集形成淀粉样斑块,参与神经细胞凋亡及神经变性[18],推测血清Cys-C水平与认知功能障碍可能具有一定的相关性。目前相关的研究报道甚少,本研究显示:血清Cys-C水平与MoCA评分呈负性相关(P<0.05),提示血清Cys-C水平升高可进一步加重认知功能损害,是认知功能下降的危险因素之一。进一步分析发现,血清Cys-C水平和视空间与执行力、命名、语言、延迟回忆、注意与计算力的评分均呈负相关(均P<0.05),而与抽象思维、定向力均无关(均P>0.05),提示血清Cys-C表达变化与认知功能下降的相关性主要体现在执行功能、命名、语言、延迟回忆、注意与计算力等方面。推测上述结果的可能机制为执行功能、语言、注意及记忆的储存与额叶-纹状体回路及颞叶-边缘叶环路两条途径有关,当血清Cys-C水平升高时,其产生神经细胞损害对皮层下神经纤维环路的传导过程造成损伤与阻断。可见,血清Cys-C水平可作为反映认知损伤程度的一项标志,且可以调节认知损害的表现。
综上所述,除了作为反映肾功能的指标,血清Cys-C水平是不同分级LA严重程度的独立危险因素,对LA所致的认知功能障碍的发生及进展风险具有重要的提示作用。其检测简便、价格低廉,值得临床推广。
4 参考文献
[1]Harman G,Akbari A,Hiremath S,et al.Accuracy of cystain of C-based estimates ofglomerular filtration rate in kidney transolant recipients:a systematic review[J].NephrolDialTransplant,2013,28(3):741-757.
[2]Fazekas F,Kleinert R,Offenbacher H,et al.Pathologic correlates of incidental MRI white matter signal hyperintensities[J].Neurology,1993,43(9):1683-1689.
[3]赵萍,王春雪,张玉梅.脑白质疏松患者的影像学表现与认知功能损害[J].国际脑血管杂志,2013,21(4):299-304.
[4]Wardlaw JM,Smith EE,Biessels GJ,et al.Neuroimaging standards for research into smallvesseldisease and its contribution to ageing and neurodegeneration[J].LancetNeurol,2013,12(8):822-838.
[5]金花,姜彩霞,刘跃辉,等.脑小血管病诊疗进展[J].临床荟萃,2015,30(2):231-233.
[6]Chen A,AkinyemiRO,Hase Y,et al.Frontalwhite matter hyperintensities,clamatodendrosis and gliovascular abnormalities in ageing and post-stroke dementia[J].Brain,2016,139(Pt1):242-258.
[7]Makin SD,Cook FA,Dennis MS,et al.Cerebral small vessel disease and renal function:systematic review and meta-analysis[J].Cerebrovasc Dis,2015,39(1):39-52.
[8]Saji N,Kimura K,Yagita Y,et al.Deep cerebral microbleeds and renal dysfunction in Patients with acute lacunar infarcts[J].J Stroke Cerebrovasc Dis,2015,24(11):2572-2579.
[9]Song TJ,Kim J,Lee HS,et al.Distribution of cerebralmicrobleeds determines their association with impaired kidney function[J].J Clin Neurol,2014,10(3):222-228.
[10]Akoudad S,Sedaghat S,Hofman A et al.Kidney function and cerebralsmallvesseldisease in the generalpopulation[J].Int J Stroke,2015,10(4):603-608.
[11]Wardlaw JM,Allerhand M,DoubalFN,et al.Vascular risk factors,large-artery atheroma,and brain white matter hyperintensities[J].Neurology,2014,82(15):1331-1338.
[12]杨松,朱林凤,周建忠,等.脑梗死患者胱抑素C与脑白质疏松的相关性[J].江苏医药,2014,40(16):1887-1889.
[13]Kanhai DA,de Kleijn DP,Kappelle LJ,et al.Extracellular vesicle protein levels are related to brain atrophy and cerebral white matter lesions in patients with manifest vascular disease:the SMART-MR study[J].BMJ Open,2014,4:e003824.
[14]Yuan J,Wang S,Guo X,et al.Zhonghua Yi Xue Za Zhi,2015,95:3650.
[15]Frances A,Sandra O,Lucy U.World J Psychiatry,2016,6:199.
[16]Kloppenborg RP,Nederkoorn PJ,Geerlings MI,et al.Presence and progrenssion of white matter hyperintensities and cognition:a meta-analysis[J].Neurology,2014,82(23):2127-2138.
[17]Gioia LC,Kate,Choi V,et al.Ischemia in intracerebral hemorrhage is associated with leukoaraiosis and hematoma volume,not blood pressure reduction[J].Stroke,2015,46(6):1541-1547.
[18]Ghidoni R,Paterlini A,Albertini V,et al.Cystatin C is released in association with exosomes:a new tool of neuronal communication which isunbalanced in Alzheimer,s disease NeurobiolAging,2011,32:1435-1442
