MYBL2和p53在胃癌组织中的表达及临床意义研究
2018-06-13卢洪胜曹学全包卫光章辉周璐青於樱枝
卢洪胜 曹学全 包卫光 章辉 周璐青 於樱枝
胃癌是全球发病率第5位的恶性肿瘤,在肿瘤死亡率中居第3位[1]。由于晚期胃癌患者复发和转移率高,且缺乏有效的治疗策略,因此预后较差[2]。此外,胃癌侵袭和转移的分子机制仍不清楚。因此,识别新的转移相关基因和阐述其潜在的机制可能为抗癌治疗提供潜在的靶点。MYBL2基因,也被称为B-myb,是MYB转录因子家族成员之一,在所有增殖细胞中广泛表达[3]。MYBL2在细胞周期进展、细胞存活和细胞分化过程中起作用,提示MYBL2失调可能具有致癌潜能。MYBL2在乳腺癌、大肠癌和食管癌等多种实体癌中过表达,且与患者预后不良有关[4-6]。研究证实,MYBL2在p53基因突变的肿瘤中不成比例的上调,甚至在p53突变的细胞中可以克服DNA损伤诱导G2期阻滞[7]。目前胃癌组织中MYBL2和p53蛋白联合表达的临床意义研究鲜见报道。本研究采用组织芯片结合免疫组化En Vision法检测88例胃癌和相应癌旁组织中MYBL2和p53蛋白的表达差异,分析MYBL2和p53表达与胃癌临床病理因素的关系,以及胃癌组织中MYBL2和p53蛋白表达的相关性,初步探讨MYBL2和p53蛋白异常表达在胃癌发生、进展中的临床意义及两者之间的关系。
1 资料和方法
1.1 一般资料 收集我院2013年1月至2017年7月间行根治手术的88例胃癌切除标本,均具有完整的临床病理资料,患者术前均未接受放射和化学治疗,术后均经病理证实。肿瘤组织均取自肿瘤中心非坏死部分,同时取距离肿瘤>5cm相应的癌旁正常黏膜组织作为对照。88例胃癌患者中男58例,女30例,年龄32~78(66.26±12.35)岁。组织学分级:高分化9例,中分化30例,低分化49例。根据2016年国际抗癌联盟第8版TNM分期标准:I期10例,Ⅱ期25例,Ⅲ52例,Ⅳ期1例。浸润深度(T分期):T19例,T212例,T32例,T465例;淋巴结转移情况(N分期):N019例,N114例,N221例,N334例。所有组织标本取出后迅速用10%中性甲醛溶液固定,常规脱水、石蜡包埋。
1.2 主要试剂 鼠抗人MYBL2单克隆抗体购自美国Abnova公司,鼠抗人p53单克隆抗体购自美国Sigma公司,即用型羊抗鼠免疫组化En VisionTM检测试剂盒和DAB显色剂均购自福州迈新生物技术有限公司。
1.3 组织芯片的制作 对所有供体组织蜡块行常规病理切片后HE染色,由2位病理科副主任医师进行诊断,并在显微镜下找到典型病变部位作标记。利用组织芯片制作仪在受体蜡块上打直径1mm的孔,根据HE切片上标记的病变部位,然后在供体组织蜡块上的对应位置获取同样大小直径的组织芯,插入受体蜡块阵列孔中,并记录组织编号,重复上述步骤制成阵列块,以4~5μm厚度连续切片,分别进行HE及免疫组化染色。所得组织芯片的每个点均经过病理诊断。
1.4 免疫组化染色 采用En Vision二步法进行免疫组化染色,严格按照试剂盒说明书进行操作,0.1mmol/L枸橼酸盐缓冲液高温高压抗原修复,3%BSA封闭,一抗(MYBL2 工作浓度 1:200;p53 工作浓度 1:100)4℃过夜,DAB显色,封片后光镜下观察。以PBS液代替一抗做阴性对照。
1.5 结果判定 免疫组化染色出现淡黄色至棕黄色颗粒为阳性。MYBL2阳性表达位于细胞质或细胞核,p53定位于细胞核。随机选取5个以上高倍视野(×400),每个高倍视野计数不少于200个细胞中的阳性细胞数,以细胞质或细胞核出现阳性信号的细胞数>10%为阳性,<10%为阴性。
1.6 统计学处理 应用SPSS17.0统计软件。不同组织间MYBL2和p53表达差异采用χ2检验,采用Spearman等级相关对胃癌组织中MYBL2和p53的表达行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 MYBL2和p53在胃癌和癌旁组织中表达的比较MYBL2阳性表达为细胞质或细胞核出现黄色至棕黄色颗粒(图1-2,见插页),p53蛋白阳性表达为细胞核呈现黄色至棕黄色颗粒(图3-4,见插页)。MYBL2和p53在胃癌组织中阳性率分别为62.50%(55/88)、70.45%(62/88),癌旁组织中阳性表达率分别为12.50%(11/88)、10.22%(9/88),胃癌组织中MYBL2和p53表达明显高于癌旁组织(均P<0.05)。见表1。
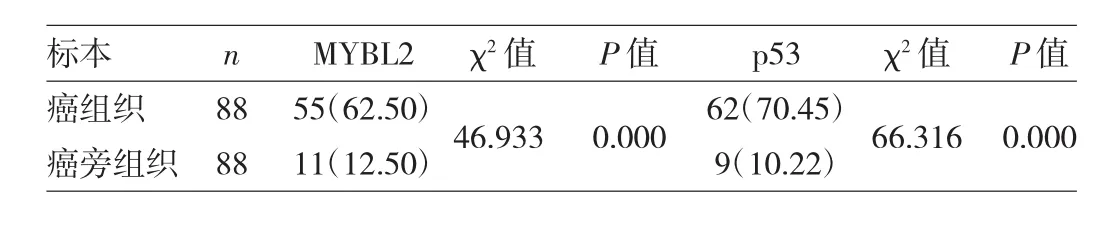
表1 MYBL2和p53在胃癌和癌旁组织中的表达[例(%)]
2.2 MYBL2和p53表达与胃癌临床病理因素的关系随着胃癌患者临床分期增加、浸润深度加深及淋巴结发生癌转移,胃癌组织中MYBL2和p53表达进一步升高,差异均有统计学意义(均P<0.05),而在患者不同年龄、性别、肿瘤大小及分化程度间的表达差异均无统计学意义(均P>0.05)。见表2。
2.3 胃癌组织中MYBL2表达和p53表达的相关性88例胃癌组织中MYBL2表达阳性和p53表达阳性者51例,MYBL2表达阴性和p53表达阴性者 22例,胃癌组织中MYBL2表达和p53表达呈正相关(r=0.630,P=0.000)。见表 3。
3 讨论
MYBL2位于染色体20q13,是Myb转录因子家族的高度保守成员,并且在增殖细胞中普遍表达,特别是在胚胎干细胞和成人造血前体[8]。在生理情况下,MYBL2调节细胞周期进展、细胞存活和细胞分化,然而在恶性肿瘤中常常发现表达上调,能够显著促进肿瘤的发生和进展[9]。Liang等[10]报道,胆囊癌组织中MYBL2表达增加,且与胆囊癌患者的组织学分级,肿瘤浸润深度,临床分期和不良总生存率有关。体外实验显示,MYBL2表达的下调可抑制胆囊癌细胞增殖和DNA复制以及裸鼠异种移植肿瘤的生长。相反,MYBL2过表达导致相反的效果。Tao等[11]发现,在乳腺癌细胞中,敲除MYBL2表达能够恢复上皮标志物E-钙黏蛋白的表达和细胞-细胞间的链接,抑制肿瘤细胞的侵袭、独立性生长和肿瘤的形成。p53基因位于染色体17pl3,分为野生型和突变型两种,编码产物含有393个氨基酸的p53蛋白。野生型p53通过激活和下调基因表达而主要作为转录因子起作用,导致细胞周期停滞或细胞凋亡,是一种抑癌基因[12]。突变型p53基因的扩增具有促癌作用,可与野生型p53基因结合抑制其表达,诱导细胞过度增殖、凋亡细胞明显减少,最终引起恶性肿瘤的发生[13]。
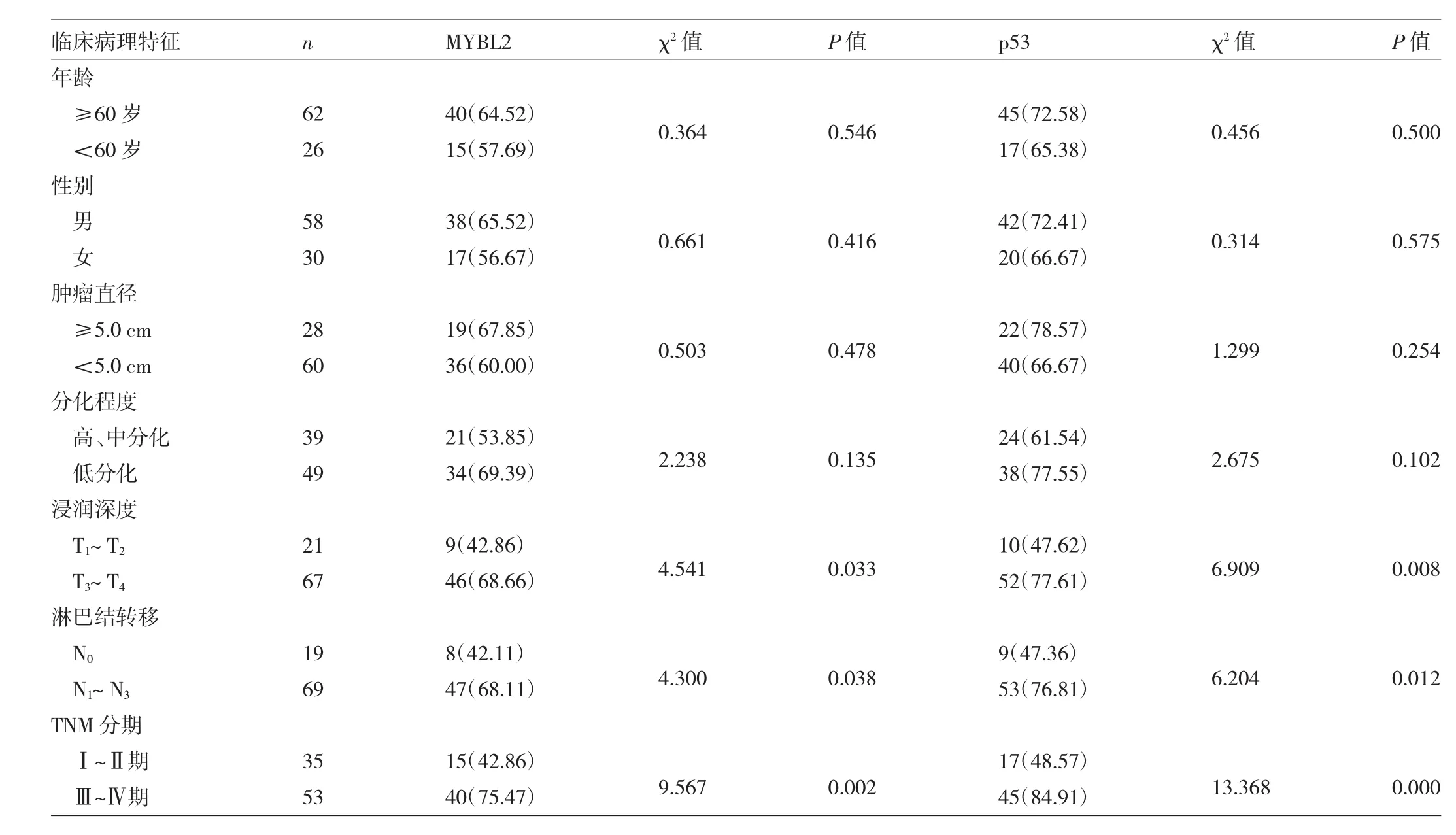
表2 MYBL2和p53表达与胃癌临床病理因素的关系[例(%)]

表3 MYBL2和p53在胃癌组织中表达的相关性
本实验结果表明,胃癌组织中MYBL2和p53蛋白阳性表达率分别为62.50%、70.45%,癌旁组织中分别为12.50%、10.22%,胃癌组织中MYBL2和p53的表达均明显高于癌旁组织(P<0.05)。表明MYBL2和p53表达升高可能与胃黏膜上皮癌变的发生有关,与Yu等[14]在胰腺导管腺癌中的文献报道一致。结合胃癌患者临床病理资料进行分析,MYBL2和p53表达与胃癌临床病理因素关系的结果显示,随着胃癌患者临床分期进展、浸润深度加深及淋巴结发生癌转移,MYBL2和p53阳性表达率进一步升高,差异有统计学意义(P<0.05)。提示MYBL2和p53表达与胃癌的临床分期、浸润深度和淋巴结转移有关。Spearman相关分析结果显示,胃癌组织中MYBL2和p53表达共阳性者51例,表达共阴性者22例,胃癌组织中MYBL2和p53阳性表达呈正相关(P<0.05)。有研究显示,p53-p21-DREAM途径抑制MYBL2表达,特别是在细胞应激的条件下,如DNA损伤。然而在p53基因突变的肿瘤中调控细胞周期进程和细胞存活的MYBL2基因异常[15]。表明MYBL2和突变型p53是一对协同作用因素,可能通过某种调节机制参与胃癌的发生、进展过程。
综上所述,与癌旁组织比较,胃癌组织中MYBL2和p53蛋白存在过表达,其异常表达与胃癌患者的临床分期、浸润深度及淋巴结是否转移密切相关,胃癌组织中MYBL2和p53阳性表达呈正相关。联合检测MYBL2和p53有助于评估胃癌的生物学行为和预后,为胃癌的靶向治疗和进一步研究其浸润、转移的分子机制提供理论基础。

图1 MYBL2表达的组织芯片位点图(En Vision法,×50)
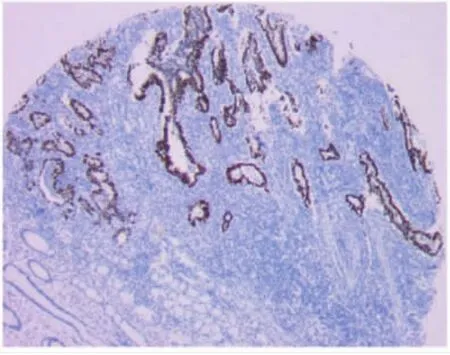
图2 MYBL2在胃癌组织中阳性表达(En Vision法,×400)
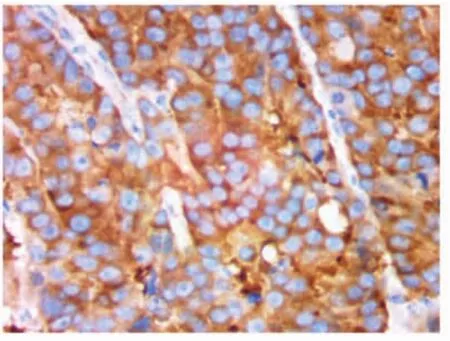
图3 p53表达的组织芯片位点图(En Vision法,×50)

图4 p53在胃癌组织中阳性表达(En Vision法,×400)
4 参考文献
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:Sources,methodsand major patternsin GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.
[2]Fock KM.Review article:the epidemiology and prevention of gastric cancer[J].Aliment PharmacolTher,2014,40(3):250-260.
[3]Martinez I,Dimaio D.B-Myb,cancer,senescence,and microRNAs[J].Cancer Res,2011,71(16):5370-5373.
[4]Inoue K,Fry EA.Novel molecular markers for breast cancer[J].Biomark Cancer,2016,8:25-42.
[5]Ren F,Wang L,Shen X,et al.MYBL2 is an independent prognostic marker that has tumor-promoting functions in colorectal cancer[J].Am J Cancer Res,2015,5(4):1542-1552.
[6]Qin HD,Liao XY,Chen YB,et al.Genomic characterization of esophageal squamous cell carcinoma reveals critical genes underlying tumorigenesis and poor prognosis[J].Am J Hum Genet,2016,98(4):709-727.
[7]Parikh N,Hilsenbeck S,Creighton CJ,et al.Effects of TP53 mutational status on gene expression patterns across 10 human cancer types[J].J Pathol,2014,232(5):522-533.
[8]Tarasov KV,Tarasova YS,Tam WL,et al.B-MYB is essential for normal cell cyle progression and chromosomal stability of embryonic stem cells[J].PLoS One,2008,3(6):e2478.
[9]Musa J,Aynaud MM,Mirabeau O,et al.MYBL2(B-Myb):a central regulator of cell proliferation,cell survival and differentiation invovled in tumorigenesis[J].CellDeath Dis,2017,8(6):e2895.
[10]Liang HB,Cao Y,Ma Q,et al.MYBL2 is a Potential Prognostic Marker that promotes cell proliferation in gallbladder cancer[J].CellPhysiolBiochem,2017,41(5):2117-2131.
[11]Tao D,Pan Y,Jiang G,et al.B-Myb regulates snail expression to promote epithelial-to-mesenchymal transition and invasion of breast cancer cell[J].Med Oncol,2015,32(1):412.
[12]Martin Fischer,Marianne Quaas,Lydia Steiner,et al.The p53-p21-DREAM-CDE/CHR pathway regulates G2/M cell cycle genes.Nucleic Acids Res,2016 J,44(1):164-174.
[13]Urata YN,Takeshita F,Tanaka H,et al.Targeted Knockdown of the kinetochore protein D40/Knl-1 inhibits human cancer in a p53 status independent manner[J].SciRep,2015,5:13676.
[14]Yu R,Li C,Lin X,et al.Clinicopathologic features and prognostic implications of MYBL2 protein expression in pancreatic ductal adenocarcinoma[J].PatholRes Pract,2017,213(8):964-968.
[15]Fischer M,Quaas M,Steiner L,et al.The p53-p21-DREAMCDE/CHRpathway regulates G2/M cell cycle genes[J].Nucleic Acids Res,2016,44(1):164-174.
