重型颅脑损伤患者肾血管阻力指数变化与预后的关系
2018-06-13王婳许兆军蔡挺刘鹏陈培服潘建能
王婳 许兆军 蔡挺 刘鹏 陈培服 潘建能
随着科技的进步和交通的发展,脑外伤逐渐成为成人患者死亡的首要原因,重型颅脑损伤患者的病死率可高达21%~60%[1]。引起脑外伤的原因可分为闭合性和开放性两大类,多由于严重车祸、高处坠落伤或暴力所致。重型颅脑损伤患者在经历创伤性或失血性休克时,全身血流量急剧下降,肾脏是较易受到损伤的器官之一,轻则造成急性肾损伤(AKI),严重者可致急性肾衰竭(ARF),与患者的预后密切相关[2]。重症超声检查作为评估肾血流的一种无创方法,临床上广泛应用。肾血管阻力指数(RRI)的测定具有操作简便、床旁实时、动态观察等特点,不仅可评定肾血流的灌注情况,亦可对肾血流进行半定量的评分[3]。本研究回顾重型颅脑损伤患者连续1周RRI水平,以揭示其动态变化及其与预后的关系。
1 对象和方法
1.1 对象 回顾2016年3月至2017年1月我院ICU收治的重型颅脑损伤患者55例,其中手术组患者28例,主要诊断为小脑出血5例,硬膜外血肿6例,硬膜下血肿8例,颅内血肿9例。非手术组患者27例,主要诊断为创伤性蛛网膜下腔出血9例,颅内多发血肿7例,脑干出血6例,弥漫性轴索损伤5例,其中8例患者合并脑疝。本研究通过我院伦理委员会审批,所有患者家属签署知情同意书。
1.2 纳入与排除标准 纳入标准:诊断符合重型颅脑损伤的诊断标准:广泛颅骨骨折,广泛脑挫裂伤,脑干损伤或颅内血肿,昏迷时间在6h以上,意识障碍逐渐加重或出现再昏迷,有明显的神经系统阳性体征,有明显生命体征改变。排除标准:(1)年龄<18周岁;(2)妊娠;(3)严重慢性肾功能衰竭或诊断明确的肾后性因素导致肾功能衰竭;(4)急性肾脏肿瘤术后及肾移植术后患者;(5)肾动脉狭窄;(6)严重肥胖无法行床旁肾脏血管多普勒检查。
1.3 方法 分别记录两组患者性别、年龄、诊断、格拉斯哥昏迷评分(GCS)、APACHEⅡ评分。使用床旁监护仪(Philips,荷兰,IntelliVue MP40)监测患者生命体征。连续监测两组患者入ICU第1周双侧RRI,记录同期生命体征、血肌酐、尿素氮、尿酸、尿量等指标,观察并比较两组患者生存率的差异。
采用彩色多普勒床旁超声诊断仪(Philips,CX50),腹部超声探头型号C5-1,频率2~5MHz。测量由同一位熟练掌握超声技术的重症医师进行。测量过程中遵循的一定的参数要求[4]:使用凸阵探头,从后外侧扫查获取肾脏冠状切面来定位肾内血管,在多普勒模式下测定肾血流速度,取样容积为2mm,采用最小的脉冲重复频率,最低的壁滤波水平,同时调节增益降低背景噪声。
RRI的计算公式:阻力指数=(收缩期峰流速-舒张期峰流速)/收缩期峰流速。患者取侧卧位,意识障碍者在平静呼吸或机械通气条件下,取连续且频谱形态相似、显示良好的动脉波形,至少连续3个以上,分别选取肾脏叶间动脉的近段、中段及远段,每段进行3次测量,共获得9个数据,取平均值,作为单侧RRI。对侧亦按上述方法进行。
1.4 统计学处理 应用SPSS 17.0统计软件,计量资料以表示,两独立样本的计量资料采用t检验;计数资料组间比较采用χ2检验;相关性分析采用Pearson相关。绘制Kaplan-Meier生存曲线,log rank检验比较生存率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料及肾功能指标的比较 两组患者性别、收缩压、平均动脉压、脉压、呼吸、心率、尿酸、APACHEⅡ评分比较差异均无统计学意义(均P>0.05),仅在年龄、舒张压、尿素氮、尿量比较差异均有统计学意义(均P<0.01),两组患者血肌酐比较差异有统计学意义(P>0.05),但平均值尚在正常范围,见表1。两组患者的RRI与年龄、肌酐、尿素氮、APACHEⅡ评分呈正相关,与舒张压、尿量呈负相关(均P<0.05),见表2。
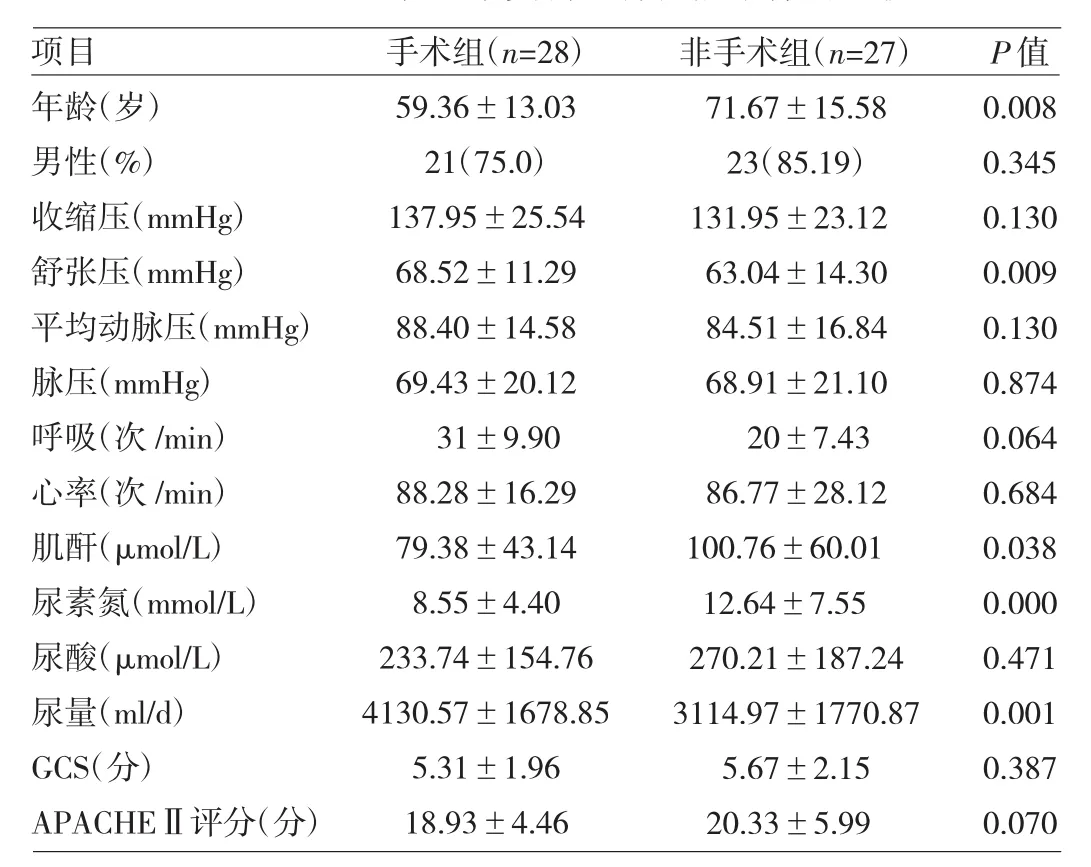
表1 两组患者基本资料及肾功能指标的比较
2.2 两组患者RRI比较 双侧、左侧、右侧RRI平均值手术组患者分别为 0.606±0.038、0.607±0.043、0.606±0.044,非手术组患者分别为 0.664±0.049、0.666±0.057、0.657±0.054。两组患者RRI在双侧和左、右侧比较差异均有统计学意义(均P<0.01)。
2.3 两组患者1周RRI的动态比较 非手术组患者第1天的RRI明显升高,且在第6天达到高峰,此后呈下降趋势。两组患者第1~3天的双侧RRI比较差异均有统计学意义(均P<0.01),第4天比较差异有统计学意义(P<0.05),第5~7天比较差异均无统计学意义(均P >0.05),见表 3。

表2 不同生理指标与RRI的相关性

表3 重型颅脑损伤患者1周的双侧RRI平均值
2.4 两组患者生存率的比较 手术组患者的平均生存时间(27.89±17.42)d,非手术组为(19.48±10.20)d。手术组的生存时间高于非手术组,非手术组的生存时间多短于30d,而手术组患者的生存从30d后开始逐渐趋于稳定,部分患者生存时间超过60d,详见图1。比较两组患者7、14、30、60d的生存率,发现两者7d和14d生存率比较差异无统计学意义(P>0.05),30d和60d的比较差异有统计学意义(P<0.05),详见表4。

图1 手术组和非手术组的生存曲线

表4 两组患者生存率的比较(%)
3 讨论
RRI能反映肾血管床的阻力状态,通过多普勒超声波形计算分析获得。研究显示,肾小球前血管阻力下降与肾小球后血管(出球动脉、管周毛细血管、肾静脉)阻力升高均可使RRI升高。而肾血管阻力主要由肾小球后血管组成,因此RRI升高可提示肾血管阻力升高[5]。重型颅脑损伤患者,由于严重创伤导致的休克,机体首先满足心脑血管系统的血液供应,肾脏的血流急剧下降,造成肾血管的反射性痉挛,肾血管阻力明显升高,临床上表现为少尿,血肌酐、尿素氮升高,这往往需要24h甚至更长的时间[6-7]。如何在临床症状出现及血化验指标升高前,发现患者急性肾损伤的存在,进行早期干预是本项研究的目的。
本研究的55例重型颅脑损伤患者,手术组和非手术组患者的基本资料(除年龄)、入科时疾病的严重程度(APACHEⅡ评分)、性别、生命体征(除舒张压)及尿酸的差异均无统计学意义,但年龄、舒张压、尿素氮、血肌酐、尿量的比较有统计学差异。周永昌等[8]研究发现,正常成人RRI与性别、年龄、左右侧肾无相关性,尽管随年龄的增长,肾动脉内径有所增宽,但RRI变化无统计学意义。故年龄因素对RRI的本身影响不大,但非手术组患者由于颅内病变严重,高龄对肾缺血的耐受性差,进而在入科时即表现为RRI明显升高。舒张压是心脏前负荷的指标,手术组舒张压较非手术组高5mmHg,而RRI更低,提示手术组患者的液体灌注更充足,因此在收缩压不变,舒张压提高时,亦能改善肾灌注。由表1可见两组患者的血肌酐尚在正常范围,尿量明显增多,但非手术组患者的RRI,无论是左右侧还是双侧,均明显升高,提示RRI的升高先于血肌酐的变化,早期行床旁RRI监测,可早期发现AKI患者的存在。
对两组患者进行连续1周的RRI监测发现,非手术组患者的RRI从入科第1天开始升高,一直持续到第7天,前4d的RRI较手术组差异有统计学意义。这与陈九军等[9]对重症感染患者AKI时的RRI研究结果相似。将AKI患者以及非AKI患者第1天的数据进行比较,发现患者的血肌酐数值及肾脏横径、长径、实质厚度均在正常范围内,AKI患者组的RRI已显著高于非AKI患者组,且差异有统计学意义,并且这种升高持续至入院第5天。我们的研究发现从第5天开始,两组患者的RRI差异无统计学意义,是因为经过ICU医生前期的液体复苏,大多数的患者进入液体的正平衡状态,肾脏的有效灌注逐步改善,如没有并发症的出现,意识改善的患者逐渐步入康复期。
回顾两组患者的生存时间,得出手术组患者的平均生存时间在27d左右,较非手术组长8天,进一步比较两组生存率的指标,30d和60d生存率有差异。生存时间的延长与重症监护技术的提高,有着密不可分的关系,在生存曲线上同样可以看出,生存时间超过30d的患者,其长期生存率明显提高。重型颅脑损伤患者死亡早期可能由于原发性脑病或颅高压所致,后期主要死于肺部感染和ARF。而ARF是致命的并发症,病死率达5%[10]。颅脑损伤患者并发ARF的发生机制十分复杂:(1)肾前性因素考虑重型颅脑损伤患者,常合并严重多发伤,失血性休克导致低血容量状态,肾有效灌注不足,长时期低灌注导致ARF。(2)重型颅脑损伤后刺激下丘脑分泌过量的抗利尿激素和促肾上腺皮质激素,前者可以直接影响肾血流量和肾小球滤过率(GFR),后者通过释放大量儿茶酚胺,引起肾血管收缩,肾小管上皮细胞坏死,GFR下降,最终造成ARF。(3)肾毒性药物的影响:包括甘露醇改变血浆渗透压导致肾血管收缩,引起少尿;抗生素如糖肽类万古霉素等,可造成肾间质炎性细胞浸润、间质水肿、肾小管不同程度受损,进而导致急性间质性肾炎,GFR下降,血肌酐升高;(4)其他因素,如脑缺氧、继发性癫痫及四肢的重度挤压伤等,均可导致代谢产物肌红蛋白和肌酸激酶增高,堵塞肾小管,引起AKI,严重者可导致ARF。
由此可见,对于重型颅脑损伤患者,入科第1天即开始监测RRI,并动态观察其变化,可以早期发现AKI患者的存在。同时,本研究亦发现RRI升高的患者预后不良,死亡风险增高。临床上,早期进行干预,如进行有效的液体复苏、积极的开颅及微创介入手术或减少肾毒性药物的使用,都有可能改善患者的预后。但由于本研究患者病例数不多,时间较短,尚需要更多的临床数据来验证结论。
4 参考文献
[1]魏德胜,莫祖娥.颅脑损伤患者预后影响因素调查研究[J].河北医学,2013,19(5):688-690.doi:10.3969/j.issn.1006-6233.2013.05.018.
[2]Hoste EAJ,Bagshaw SM,Bellomo R,et al.Epidemiology of acute renalinjuryin criticallyillpatients:the multinationalAKI-EPIstudy[J].Intensive Care Med,2015,41:1411-1423.doi:10.1007/s00134-015-3934-7.
[3]Schnell D,Reynaud M,Venot M,et al.Resistive index or color-Doppler semi-quantitative evaluation of renalperfusion by inexperienced physicians:results of a pilot study[J].Minerva Anestesiologica,2014,80(12):1273-1281.
[4]Darmon M,Schortgen F,Vargas F,et al.Diagnostic accuracy of Doppler renalresistive index for reversibility of acute kidney injury in critically illpatient[J].Intensive Care Med,2011,37:68-76.doi:10.1007/s00134-010-2050-y.
[5]Maria Boddi,Fabrizia Natucci,Elisa Ciani.The internist and the renal resistive index:truths and doubts[J].Intern Emerg Med,2015,10(8):893-905.doi:10.1007/s11739-015-1289-2.
[6]Schnell D,Darmon M.Renal Doppler to assess renal perfusion in the critically ill:a reappraisal[J].Intensive Care Med,2012,38:1751-1760.doi:10.1007/s00134-012-2692-z.
[7]Schnell D,Camous L,Guyomarc'h S,et al.Renal perfusion assessment by renal Doppler during fluid challenge in sepsis[J].Crit Care Med,2013,41:1214-1220.doi:10.1097/CCM.0b013e31 827c0a36.
[8]周永昌,郭万学.超声医学[M].5版.北京:科学技术文献出版社,2006:784.
[9]陈九军,刘玉,陈云超.重症感染患者急性肾损伤的超声早期诊断评价[J]. 中华医院感染学杂志,2014,24(3):3253-3257.doi:10.11816/cn.ni.2014-134456.
[10]Maria Boddi,Manuela Bonizzoli,Marco Chiostri,et al.Renal resistive index and mortality in critical patients with acute kidney injury[J].Eur J Clin Invest,2016,46(3):242-251.doi:10.1111/eci.12590.
