山楂叶总黄酮对NAFLD肝细胞凋亡影响的研究
2018-06-13黎运呈曾芳王秋景郑迪杨喆娟
黎运呈 曾芳 王秋景 郑迪 杨喆娟
随着人们生活水平的提高,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)患者日益增多。NAFLD进一步发展,约15%患者发展至肝硬化,3%进展至最终的肝衰竭[1-3]。NAFLD是一类肝组织学改变与酒精性肝病相类似,但无过量饮酒史的临床病理综合征[4]。NAFLD在临床上以肝功能异常为主要表现,肝细胞的病理损伤尤以肝细胞线粒体损伤较为显著。线粒体是肝细胞重要的细胞器之一,同时也是具有完整结构和生化功能复杂、多变的细胞器,细胞内和细胞外环境的变化可导致线粒体的结构和功能异常,而肝线粒体的病变与细胞凋亡的发生密切相关[5-6]。现代药理学研究表明,山楂叶总黄酮(hawthorn leaves flavonoids,HLF)具有降血脂、抗氧化、降糖、抗血小板聚集等作用[7-8]。笔者通过观察HLF对NAFLD细胞凋亡的影响,旨在揭示NAFLD发病的分子机制,为中药干预治疗NAFLD提供理论依据,现将结果报道如下。
1 材料和方法
1.1 材料 HLF(长春三九生物制药,批号:20140823);人正常肝细胞L-02株,购自中科院上海细胞研究所细胞库;FBS购自杭州四季青公司;油酸(OA)购自天津风船化学试剂科技有限公司;软脂酸(PA)、油红O、二甲基亚砜(DMSO)购自美国Sigma公司;达氏修正依氏培养基(DMEM)和小牛血清(FCS)购于美国Gibco公司;TG试剂盒、考马斯亮蓝蛋白定量试剂盒购自南京建成生物工程公司。化学药品与试剂:Annexin V-FITC凋亡检测试剂盒购于美国BD公司;MTT购于瑞士罗氏公司;SDS-PAGE试剂购于美国Sigma公司;PVDF膜购于德国 Millipore公司;Caspase-9、Bcl-2、Bax和 β-actin抗体购于Cell Signaling Technology;羊抗兔和羊抗鼠二抗购于美国Bethyl公司。Cytochrome C购于美国Bio-Vision公司。
1.2 方法
1.2.1 细胞培养 人正常肝L-02细胞用含有10%FBS的DMEM培养液,于37℃、含5%CO2的温箱中培养72h,细胞70%~80% 融合时,以0.25%胰酶/0.02%EDTA消化传代,更换培养液。
1.2.2 NAFLD实验分组 取对数生长期的细胞1×105/ml种植到6孔板,并孵育24h后,实验分为正常组、模型组、低剂量组(HLF 100μg/ml)和高剂量组(HLF 400μg/ml),每组4瓶细胞。正常组用MEM培养液换液,而模型组、低剂量组和高剂量组,换液时换成含有1mmol/L,FFA 混合物(OA∶PA=2∶1) 的 10%FBS 的MEM培养液诱导。实验重复5次,每组4个培养瓶。诱导24、48、72h后收集细胞,分别进行油红O染色、显微镜观察、计算细胞活力和TG测定等,确定细胞模型。
1.2.3 细胞形态学观察 不同剂量HLF作用L-02细胞共48h,显微镜下观察正常组、模型组、低剂量组、高剂量组的细胞形态学变化。
1.2.4 细胞凋亡检测 采用Annexin V和PI双染的方法检测凋亡细胞。不同浓度HLF作用于L-02细胞48h后,用0.25%胰酶消化并收集细胞。1 500 r/min离心5 min,4℃,细胞用PBS洗2次,弃上清液,细胞在4℃下的稀释结合液中重悬。取Annexin V-FITC溶液5 μl和PI 2.5 μl加到 100 μl细胞悬液中,混匀,避光,在冰水中孵育10 min。加稀释的结合液400 μl到细胞悬液中混匀后上流式细胞仪检测,于激发波长488 nm处测定细胞凋亡率,并采用CellQuest流式软件分析。
1.2.5 凋亡蛋白表达检测 不同浓度HLF作用于L-02细胞48h后,用0.25%胰酶消化收集细胞。Western blot法检测 Bcl-2、Bax、Caspase-9及 Cytochrome C 蛋白表达。采用 mitochondria/cytosol fractionation kit(Bio-Vision,Mountain View,CA)试剂盒说明书将线粒体及细胞溶质分开。提取蛋白后采用12%SDS-PAGE胶分离蛋白条带,然后转移到PVDF膜。膜采用含5%脱脂牛奶的 TBST 液[10 mmol/L Tris-HCl(pH7.5),150 mmol/L氧化钠和 0.05%Tween-20]封闭,分别采用Bcl-2(1:1 000),Bax(1:1 000),Caspase-9(1:1000),Cytochrome C(1:1 000)和 β-actin(1:1 000)抗体过夜。用辣根过氧化物酶标记的羊抗兔(1:2 000)或羊抗鼠(1:2 000)二抗孵育1 h,过氧化物酶的活力被采用ECL显影的方法检测条带。采用凝胶成像仪上机检测,并用Quantity One软件定量分析。
1.3 统计学处理 应用SPSS 19.0统计软件,计量资料均以表示,多组间比较采用单因素方差分析,方差齐者组间两两比较采用LSD-t检验,方差不齐者组间两两比较用Tamhane′s T2法检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞凋亡形态学变化 不同浓度HLF作用NAFLD的模型细胞48h,倒置显微镜下观察凋亡细胞形态学改变。在FFA作用于细胞后,部分细胞生长被抑制,HLF药物干预后,细胞凋亡明显被抑制。在造模过程中,细胞在FFA的作用下生长受到抑制,细胞的变化主要表现为:细胞体积变小,分散排列,核浆比例降低,细胞膜皱缩起泡,细胞界限表现褶皱和浓染,细胞质出现透明空泡,呈辐射状,叶状突起。进一步发展,出现细胞膜出泡和凋亡小体形成。细胞体积明显变小,细胞间隙明显增大,边界更清晰,凋亡形态也更加明显。通过HLF药物干预,随着浓度的增加,L-02细胞形态改变明显好于低剂量组及模型组。详见图1(见插页)。
2.2 NAFLD细胞的凋亡率 Annexin V-FITC标记凋亡细胞,而PI标记坏死和中晚期凋亡细胞。Annexin VFITC代表水平轴的绿色荧光强度,PI代表垂直轴的红色荧光强度。不同浓度HLF作用NAFLD细胞48h,随着HLF浓度的增加,早期和总的凋亡率较未干预的模型组明显好转,且与浓度增高相关,详见图2。模型组与正常组相比较,细胞总凋亡率明显增高,两者比较差异有统计学意义(P<0.01);经过HLF干预后,模型组与高剂量组比较,早期凋亡率有统计学意义(P<0.05),中晚期及总凋亡率有统计学意义(P<0.01)。低剂量组与高剂量组相比较,中晚期凋亡率有统计学意义(P<0.05),详见表1。
2.3 NAFLD细胞凋亡蛋白的表达 随着HLF作用浓度的增加,Bax、Cytosolic Cytochrome C蛋白表达水平逐渐降低,且Cleaved Caspase-9的活化也减少。然而,随着 HLF作用浓度的增加,Bcl-2、Mitochondria Cytochrome C蛋白表达水平逐渐增加。详见图3。不同浓度HLF作用时,Bax/Bcl-2的比值,与模型组比较,高、低剂量组均有统计学意义(P<0.01),高、低剂量组之间比较有统计学差异(P<0.01);Cytosolic/Mitochondria Cytochrome C的比值,与模型组比较,高、低剂量组均有统计学意义(均P<0.01),高、低剂量组之间比较有统计学差异(P<0.05);Cleaved Caspase-9蛋白的表达,与模型组比较,高、低剂量组均有统计学意义(P<0.01),高、低剂量组之间比较无统计学差异(P>0.01),详见表 2。

图1 不同浓度HLF作用NAFLD细胞模型48h时倒置显微镜下检测形态学改变(×400)

图2 Annexin V-FITC/PI双染检测不同浓度HLF作用后NAFLD细胞的凋亡率(a区:机械损伤细胞,Annexin V-/PI+;b区:中晚期凋亡和坏死细胞,Annexin V+/PI+;c区:早期凋亡细胞,Annexin V+/PI-;d 区:正常活细胞,Annexin V-/PI-;b+c:总凋亡细胞)

表1 各组细胞凋亡率的比较(%)
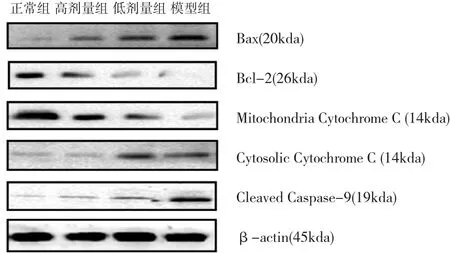
图3 Western blot法检测不同浓度HLF作用于NAFLD细胞48h时 细 胞 的 Bax、Bcl-2、Mitochondria Cytochrome C、Cytosolic Cytochrome C及Cleaved Caspase-9的蛋白表达水平
3 讨论
NAFLD的发病目前认为与脂肪酸的代谢异常、胰岛素抵抗、细胞的氧化应激、肝细胞的凋亡等方面密切相关。随着对线粒体功能的深入研究,线粒体在细胞凋亡中起着关键作用[9-10]。

表2 各组细胞凋亡蛋白表达水平的比较
细胞凋亡被分为外源性死亡受体通路和内源性线粒体通路[11-12]。在内源性凋亡途径中,Bcl-2家族改变线粒体膜电位进而打开线粒体孔道,导致线粒体中的细胞色素C(Cytochrome C)大量释放,细胞质中增多的Cyt-C(Cytosolic Cyto-chrome C)与ATP和凋亡蛋白酶激活因子(Apaf-1)共同作用,激活了 Caspase-9、Caspase-3和PARP,诱导了细胞凋亡。在线粒体调控凋亡的系统中,Bcl-2及其家族构成一个复杂且相互作用的调控细胞凋亡的网络[13-15]。在NAFLD的形成过程中,Bcl-2和Bax扮演着重要的角色,脂肪变性和氧化应激使得Bax的合成和转移到线粒体外膜的Bax增加,导致线粒体膜构型的改变,PT孔开放、细胞色素C的释放,引起细胞的凋亡;Bcl-2主要分布于线粒体外膜,其同源二聚体抑制PT孔开放,且能与Bax结合,阻止Bax的构型变化而起到抗凋亡的作用[16-19]。Cyt-C和Caspase-9均为促凋亡蛋白。Bcl-2是一种抗凋亡蛋白,Bax属于促凋亡蛋白。两者的比值决定了细胞对凋亡的敏感性甚至可喻为细胞“凋亡开关”[20]。
本实验在显微镜下观察NAFLD细胞模型的凋亡形态,发现在FFA作用细胞后,模型组细胞生长被抑制,部分细胞可见凋亡;在不同浓度HLF作用后,肝细胞形态学改变有一定程度的好转。运用Annexin VFITC/PI双染检测NAFLD细胞的凋亡率,可见模型组细胞的凋亡率与正常组相比明显增高,两者比较有统计学差异(P<0.01);经过不同浓度HLF干预后,随着HLF作用浓度的增加,早期和总的凋亡率较未干预的模型组明显好转,随着浓度增高细胞凋亡率明显下降,模型组与高剂量组比较,早期凋亡率有统计学差异(P<0.05),在中晚期及总凋亡率比较有统计学差异(P<0.01)。低剂量组与高剂量组相比较,早期凋亡率及总凋亡率比较无统计学差异,中晚期凋亡率比较有统计学差异(P<0.05)。本研究显示NAFLD肝细胞在FFA作用细胞后,模型组细胞有明显的形态学改变,存在生长被抑制、出现凋亡小体,通过HLF干预后,形态学改变有明显好转,肝细胞的凋亡率有明显降低且与药物浓度有关,差异有统计学意义。
运用Western blot检测蛋白表达的结果表明,与凋亡密切相关的 Bax蛋白、Cytosolic Cytochrome C、Cleaved Caspase-9在NAFLD肝细胞模型中的表达均较正常组增加,而NAFLD细胞模型组中Bcl-2蛋白、Mitochondria Cytochrome C蛋白表达水平明显低于正常组。经过HLF干预后,随着HLF浓度的增加Bcl-2蛋白、Mitochondria Cytochrome C蛋白表达水平较模型组也逐渐增加,而 Bax蛋白、Cytosolic Cytochrome C、Cleaved Caspase-9相应减少。本研究还表明,模型组Bax/Bcl-2、CytosolicCytochromeC/MitochondriaCytochrome c的比值、Cleaved Caspase-9蛋白表达均较正常组升高,两组比较有统计学差异(P<0.01);运用高、低浓度HLF作用NAFLD肝细胞时,Bax/Bcl-2、Cytosolic Cytochrome c/Mitochondria Cytochrome C的比值,Cleaved Caspase-9蛋白的表达均有不同程度下降,与模型组相比较,HLF高、低剂量组有统计学差异(P<0.05)。降低Bax/Bcl-2和Cytosolic Cytochrome C/Mitochondria Cytochrome C比值的作用,高、低剂量组之间比较有统计学差异(P<0.05或 0.01);降低Cleaved Caspase-9凋亡蛋白表达的作用,高、低剂量组之间比较无统计学差异(P >0.05)。
结合文献报道,Bcl-2、Bax、Cytochrome C、Cleaved Caspase-9均与细胞内源性凋亡相关,本实验结果表明,HLF对NAFLD细胞凋亡的影响可能是通过调节线粒体 Bcl-2、Bax、Cytochrome C、Cleaved Caspase-9 等相关凋亡蛋白的表达,稳定线粒体功能而实现调控肝细胞的凋亡。通过调节肝细胞线粒体的功能来延缓或阻止NAFLD的进展,为临床治疗NAFLD提供了又一条思路。
4 参考文献
[1]Angulo P.Nonalcoholic fatty liver disease[J].N Engl J Med,2002,346(16):1221-1231.
[2]李锋,范建高.非酒精性脂肪性肝病的临床特征[J].肝脏,2005,10(2):123-124.
[3]范建高.NAFLD流行病学及危险因素[N].医师报,2012-4-16(3).
[4]黎运呈,丁贤君,李世波,等.中医不同组方对非酒精性脂肪性肝病大鼠脂质过氧化及病理学改变的影响 [J].中国中医药科技,2011,18(1):19-21.
[5]樊丽琳,陈东风.线粒体与非酒精性脂肪肝[J].现代医药卫生,2003,19(5):541-542.
[6]张蕾,于锋.肝细胞线粒体凋亡途径及保护机制研究进展[J].现代生物医学进展,2014,14(3):586-589.
[7]张敏丽,闵清.山楂叶总黄酮的药理作用研究进展[J].湖北科技学院学报(医学版),2015,29(2):182-184.
[8]杨宇杰,董晓强,郭金甲.山楂叶总黄酮活血化瘀作用实验研究[J].河北医学,2009,15(1):22-23.
[9]Desagher S,Martinou JC.Mitochondria as the central control point ofapoptosis[J].Trends CellBiol,2000,10(9):369-377.
[10]Finkel E.The mitochondrion:is it central to apoptosis?[J].Science,2001,292(5517):624-626.
[11]Malhi H,Gores GJ,Lemasters JJ.Apoptosis and necrosis in the liver:a tale of two deaths?[J].Hepatology,2006,43(2 Suppl 1):S31-44.
[12]Hotchkiss RS,Nicholson DW.Apoptosis and caspases regulate death and inflammation in sepsis[J].Nat Rev Immunol,2006,6(11):813-22.
[13]吴方,余陈欢,张欢欢,等.线粒体-细胞色素C途径在兔非酒精性脂肪肝肝细胞凋亡中的作用[J].中国比较医学杂志,2016,26(4):7-13.
[14]AkcaliKC,Dalgic A,Ucar A,et al.Expression ofbcl-2 gene family during resection induced liver regeneration:Comparison between hepatectomized and sham groups[J].World Journal of Gastroenterology,2004,10(2):279-283.
[15]唐辉,肖仔君,蒋鑫炜,等.高糖应激促脂肪变性肝细胞凋亡的线粒体机制[J].中国病理生理杂志,2016,32(8):1419-1424.
[16]沈广海,高爽,沈兆亮,等.缺血后处理通过线粒体途径减轻缺血再灌注诱导的肝细胞凋亡[J].中国医药导报,2011,8(12):21-23.
[17]陈昊,王红霞,张春芳,等.Bcl-2、Bax、Cyt-C和Bid在原发性肝细胞癌中的表达及意义[J].医学研究杂志,2010,39(12):85-88.
[18]陈昊,陈乃玲,张春芳,等.细胞色素C及相关细胞凋亡蛋白、基因在原发性肝癌组织表达的临床意义[J].中国实验诊断学,2011,15(7):1083-1086.
[19]康敏,李森,钟德君,等.非酒精性脂肪肝大鼠肝细胞凋亡与线粒体膜通透性转换孔开放的关系[J].南方医科大学学报,2013,33(7):1062-1066.
[20]Bartek J,Lukas J.Cell biology.Balancing life-or-death decisions[J].Sci-ence,2006,314(5797):261-622.
