控氧发酵对干酪乳杆菌合成苯乳酸的影响
2018-06-12韩朝飞关今韬富敏霞张颂红祝铃钰贠军贤
韩朝飞,关今韬,2,富敏霞,张颂红,祝铃钰,贠军贤
(1.浙江工业大学 化学工程学院 绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310014;2.浙江大学 化学工程与生物工程学院,浙江 杭州 310027)
苯乳酸(phenyl lactic acid,PLA)是一种新型天然抑菌有机酸,具有广谱抑菌能力和体外抗血小板聚集活性[1-2],也可以作为合成聚苯乳酸新型材料的重要单体[3],因此,在食品、医药和化工等行业中有广阔的应用前景。苯乳酸可以通过化学法和生物法进行合成,其中,化学法合成路线长、步骤复杂、需要使用毒性较大的溶剂。生物合成法相比化学法,具有操作过程安全简易、反应条件温和、成本低及可实现安全快速合成制备等优点,因此,成为近几年苯乳酸合成的研究重点[4-16]。
苯乳酸可由白地霉、丙酸杆菌、乳酸菌、芽孢杆菌、米根霉菌、光合细菌及荧光威克酵母菌等多种微生物代谢分泌产生[4]。Lavermicocca等[1]利用植物乳杆菌(Bacillusplantarum21B)合成苯乳酸,发酵液中苯乳酸的浓度达到56.44 mg/L。通过对菌体进行一定的通透化处理,添加转化合成底物,优化pH、温度及转速等影响因素,可使苯乳酸的产量大幅度提升[2,6-7,13-14]。利用基因工程方法,通过引入外源基因对菌种进行基因改造,可使工程菌产量进一步提高[5,8]。Zheng等[5]通过对大肠杆菌进行基因改造,将来自凝结芽孢杆菌BacilluscoagulansNL01具有转化苯丙酮酸(PPA)产L-PLA的乳酸脱氢酶基因和甲酸脱氢酶基因在大肠杆菌中异源共表达,进行苯乳酸的合成,得到苯乳酸的浓度达79.6 mmol/L;Fujita等[3]将荧光威克酵母PPA还原酶在大肠杆菌中表达,所得工程菌发酵合成D-苯乳酸的质量浓度达29 g/L。但是,基因工程菌直接在食品或医药等工业中应用,尚有一定的限制。
以生物安全性优良的食品微生物进行苯乳酸微生物发酵或转化合成,是苯乳酸合成的重要发展方向之一。笔者所在课题组利用干酪乳杆菌L.caseiB3,以苯丙酮酸为底物,进行苯乳酸的转化合成,转化液中苯乳酸的质量浓度达5.3 g/L[6]。溶氧是影响微生物发酵的重要因素,不同控氧条件下,微生物的生长、代谢机制、酶系及分泌产物均会有较大差异。本文中,笔者通过实验方法,探索控氧条件对L.caseiB3菌发酵合成及转化合成苯乳酸的影响规律,以期为研究利用干酪乳杆菌合成苯乳酸的新途径打下基础。
1 材料与方法
1.1 材料
1.1.1 菌株
干酪乳杆菌L.caseiB3菌株保藏在浙江工业大学绿色化学合成技术国家重点实验室培育基地。
1.1.2 培养基
肉汤液体(MRS)培养基:葡萄糖20 g/L,蛋白胨10 g/L,柠檬酸氢二胺2 g/L,无水乙酸钠 5 g/L,MnSO40.25 g/L,MgSO40.58 g/L,K2HPO42 g/L,酵母膏5 g/L,牛肉膏10 g/L,吐温-80 1 mL/L。
固体培养基是在MRS液体培养基的基础上,分别添加20 g/L的琼脂和30 g/L的CaCO3制得的。
1.1.3 主要试剂及仪器
苯乳酸、苯丙酮酸(分析纯),Sigma公司;其他试剂均为市售国产分析纯。
BIOTECH-10BGZ型发酵罐,上海保兴生物设备工程有限公司;Agilent 1260 Infinity高效液相色谱(HPLC)系统,美国安捷伦公司;HZ-2411KB型恒温培养箱,太仓市华利达实验设备有限公司;CR21N型高速冷冻离心机,日本日立公司;Ultrospec 3300 Pro型紫外/可见光分光光度计,美国GE Healthcare公司;Mini-PROTEAN Tetra型蛋白电泳仪,美国伯乐公司。
1.2 发酵与转化
1.2.1 发酵
通过控制发酵罐中无菌空气流量和搅拌转速,分别于静置、搅拌及通气搅拌等条件下进行发酵。其中,搅拌时的转速均为100 r/min,通气时,无菌空气的流量维持在2 L/min。
配制MRS培养基5 L,3 L倒入10 L全自动发酵罐,另外2 L使用2个1 L锥形瓶置于高压灭菌锅,121 ℃灭菌15~20 min。培养基冷却至30 ℃,接种2%(体积分数)种子液,培养72 h。分别于4、8、12、16、20、24、28、32、36、48、60和72 h取样30 mL,将发酵液离心(8 000 r/min、15 min),称量离心所得菌体的质量(湿质量),计算菌体含量;离心所得上清液用于检测,得到其中的苯乳酸及葡萄糖含量。
1.2.2 转化
分别取0.5 g通过静置、搅拌及通气搅拌等条件下培养得到的湿菌体,作为全细胞催化剂,以苯丙酮酸为底物,进行生物转化,合成苯乳酸。转化温度35 ℃,转速75 r/min下反应4 h,转化液经离心分离,取上清液进行检测分析。
1.3 检测方法
1.3.1 葡萄糖的检测
采用3,5-二硝基水杨酸(DNS)法。取离心后发酵上清液1.5 mL,加入3 mL DNS试剂,在沸水中加热5 min,迅速冷却,取0.2 mL,加入2.5 mL超纯水,混合均匀,放置10~15 min,在480 nm波长下测吸光度,根据葡萄糖标准曲线计算发酵液中葡萄糖消耗变化情况。
1.3.2 苯乳酸的检测
采用高效液相色谱法(HPLC)测定。流动相:A为水(0.05%三氟乙酸),B为甲醇(0.05%三氟乙酸)。梯度洗脱步骤:0~20 min时,流动相B从10%线性上升至 100%;在20~23 min 期间,流动相B保持100%;最后在23~25 min时,流动相B从100%线性降至10%。DAD二极管阵列检测器检测波长为210 nm,流动相流速为1 mL/min,色谱柱的温度为30 ℃。对发酵液或转化液进行离心处理,取上清液,用0.22 μm的针筒过滤器过滤,选择适宜稀释倍数稀释,进行检测[6]。
1.3.3 SDS-PAGE凝胶电泳分析酶蛋白
SDS-PAGE法分析菌体胞内酶。将菌体用生理盐水洗涤2次,200 W超声破碎20~30 min,离心取上清液作为样品溶液,用凝胶电泳法进行分析。分离胶浓度12%,运行电压为160 V,上样量10 μL。
2 结果与讨论
2.1 不同控氧条件下L.casei B3的生长曲线及葡萄糖消耗
对L.caseiB3进行静置发酵,发酵培养温度30 ℃,培养时间72 h,测得发酵过程中菌体浓度的变化;维持相同温度,在发酵罐中通过调控通气流量和搅拌转速,进行控氧发酵,测得相应菌体生物量随发酵时间的变化,得到生长曲线,如图1所示。通过DNS法,对3种不同控氧条件下发酵过程中葡萄糖消耗情况进行测定,结果如图2所示。
由图1和2可见:无论静置、搅拌或者通气搅拌条件下进行发酵培养,菌体的生长曲线基本不变,葡萄糖的消耗与菌体生物量的累积曲线也基本一致。从发酵开始,菌体在4~24 h期间进入对数生长期,此时葡萄糖迅速消耗,残糖浓度下降,生物量随时间迅速增长,24 h后趋于稳定,残糖质量浓度已降至约1 g/L。在静置、搅拌或者通气搅拌条件下,发酵液中的湿菌体质量浓度分别约17.7、18.7和18.9 g/L,这说明不同控氧条件对菌体生长影响很小,各生长阶段菌体生长变化程度不大,最终生物量基本不变。
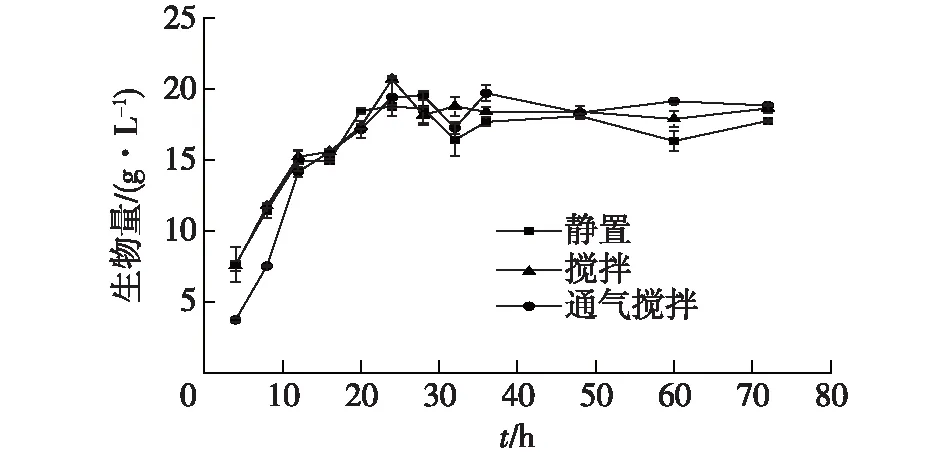
图1 不同控氧条件下L.casei B3菌生长曲线Fig.1 Cell growth curves of L.casei B3 strain under different oxygen control conditions

图2 不同控氧条件下L.casei B3发酵过程中葡萄糖的消耗Fig.2 Glucose consumption curves of L.casei B3 strain under different oxygen control conditions
2.2 不同控氧条件下L.casei B3发酵合成苯乳酸
用HPLC法对静置、搅拌或者通气搅拌条件下所得的发酵液中苯乳酸的浓度进行检测,结果如图3所示。由图3可见:在静置、搅拌和通气搅拌条件下,L.caseiB3在发酵过程中产苯乳酸都随发酵时间逐渐增加。在菌体生长对数期,生物量累积迅速,苯乳酸浓度不断增加;当菌体生长进入稳定期,发酵液中的苯乳酸浓度不再增加。3种控氧条件下的规律是类似的。但是,不同控氧条件下发酵液中苯乳酸的最大浓度有所差异。静置、搅拌和通气搅拌控氧条件下发酵合成苯乳酸的质量浓度分别达0.058、0.082和0.023 g/L,搅拌条件下发酵的结果比静置条件下的提高了41.4%,而通气搅拌条件下得到的苯乳酸浓度最低,比静置发酵条件下降低了约60.3%,说明充足的供氧不利于苯乳酸的合成。

图3 不同控氧条件下L.casei B3发酵过程中合成苯乳酸浓度的变化Fig.3 Variation of PLA concentration in L.casei B3 under different oxygen control conditions
2.3 不同控氧条件下L.casei B3转化合成苯乳酸
笔者所在课题组的朱银龙等[6]研究发现,以PPA为底物,利用L.caseiB3转化合成苯乳酸的过程中,转化液pH、温度、转速、葡萄糖浓度、转化时间及底物浓度等都会对苯乳酸浓度和转化率产生影响。其中,转化液pH和底物浓度是关键因素。转化液的pH为7~8时,底物浓度的变化对苯乳酸的转化合成起决定性作用。因此,本实验中,笔者首先对不同底物浓度下L.caseiB3转化合成苯乳酸的浓度和转化率进行了实验测定。
将L.caseiB3在30 ℃培养72 h,对发酵液进行离心,获得湿菌体。在-20 ℃条件下对菌体进行低温冷冻透性化处理,分别于PPA质量浓度4、6、8、10和12 g/L下进行转化实验。转化实验条件:葡萄糖14 g/L、菌体100 g/L、pH 8.0、温度35 ℃、转速75 r/min、转化时间4 h。考察不同底物PPA浓度下,全细胞转化得到的苯乳酸浓度及转化率结果,如图4所示。
由图4可见:在底物苯丙酮酸8 g/L条件下,L.caseiB3转化合成苯乳酸的质量浓度达5.4 g/L,此时转化率为67.2%,与课题组前期实验结果一致[6]。本文结果进一步说明,L.caseiB3菌体转化合成苯乳酸性能稳定,适宜底物质量浓度为8 g/L。因为底物浓度过高时,产物浓度会下降,对转化反应具有一定的抑制作用。
接着,分别以静置、搅拌、通气搅拌这3种不同控氧发酵条件下所得的菌体为全细胞催化剂,以质量浓度8 g/L的PPA为底物,进行转化实验,其他转化条件与上述实验相同。通过HPLC法对所得的转化液进行分析,结果如图5所示。
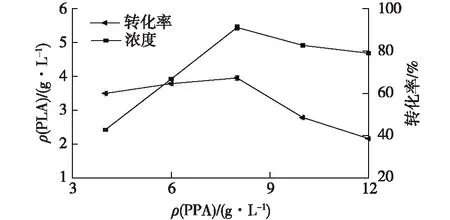
图4 底物PPA浓度对L.casei B3转化合成苯乳酸的浓度及转化率的影响Fig.4 Effects of PPA concentration on concentration and yield of PLA transformed by L.casei B3

图5 不同控氧条件下培养的L.casei B3转化合成的苯乳酸HPLC检测结果Fig.5 HPLC of PLA by transformation using L.casei B3 cells obtained from different oxygen control conditions

图6 不同控氧条件下L.casei B3转化合成苯乳酸的浓度及转化率的比较Fig.6 Comparison of concentrations and yields of PLA transformed by L.casei B3 cells obtained from different oxygen control conditions
由图5可见:以静置、搅拌和通气搅拌3种不同控氧发酵条件下所得的L.caseiB3菌体为全细胞催化剂,用于转化合成苯乳酸,所得转化液中都检测到了苯乳酸产物。
考察3种不同控氧发酵条件下所得菌体转化PPA合成PPL的能力,结果如图6所示。由图6可知:在静置与搅拌条件下,菌体转化合成的苯乳酸质量浓度及转化率基本接近,分别为5.4 g/L、67.2%和5.1 g/L、62.7%;但是,通气搅拌条件下的菌体转化生成苯乳酸含量和转化率明显降低,转化率为35.9%,苯乳酸的质量浓度仅为2.9 g/L,比静置条件下降低了46.3%。生物酶是影响发酵过程中代谢分泌物的重要因素,不同的控氧条件对生物酶活性有着重要的影响[17-18]。
将不同控氧发酵条件下L.caseiB3菌体进行破胞,用SDS-PAGE电泳对破胞液中的蛋白质进行了分析,结果见图7。

图7 不同控氧条件下L.casei B3破胞液SDS-PAGE电泳分析Fig.7 SDS-PAGE analysis of L.casei B3 cell disrupted solution under different oxygen control conditions
由图7可见:L.caseiB3菌体中含有众多不同分子量的蛋白质,其分子量分布很宽,范围为1.0×104~1.4×105;不同控氧发酵条件下菌体胞内蛋白分布存在较大差异。在上述转化反应中,乳酸脱氢酶、苯丙酮酸还原酶等相关生物酶起至关重要的作用,尤其是乳酸脱氢酶是转化PPA合成PLA的关键酶[19]。因此,不同控氧发酵条件下,L.caseiB3菌代谢机制或副产物的生成各不相同,尤其是通气条件下造成转化液中苯乳酸含量锐减,其原因可能是转化生成PLA的相关生物酶含量及活性下降(分子量为4.0×104左右的酶),进而导致苯乳酸浓度下降。
3 结论
控氧发酵对L.caseiB3产苯乳酸和转化合成苯乳酸具有重要影响,但对菌体生长影响不大。在静置、搅拌和通气搅拌等不同控氧条件下,L.caseiB3菌体发酵合成苯乳酸的浓度不同,适当的搅拌有利于发酵合成苯乳酸,但充足供氧的通气搅拌不利于苯乳酸的发酵合成。在转速100 r/min的搅拌条件下,L.caseiB3菌体发酵合成苯乳酸的浓度比静置发酵条件下提高了41.4%;但在空气流量2 L/min及转速100 r/min的通气搅拌下,发酵合成苯乳酸的浓度较静置发酵时下降了60.3%。
以L.caseiB3菌体为全细胞催化剂,以苯丙酮酸为主要底物,经生物转化合成苯乳酸时,底物浓度过高会导致转化合成苯乳酸的浓度下降,对转化反应有一定的抑制作用。以相应静置、搅拌及通气搅拌所得L.caseiB3菌体为全细胞催化剂,在PPA 8 g/L、葡萄糖14 g/L、菌体质量浓度100 g/L、pH 8.0、温度35 ℃、转速75 r/min和转化时间4 h条件下,转化合成苯乳酸时,转化合成苯乳酸的摩尔转化率分别为67.2%、62.7%和35.9%,说明充足的供氧不利于苯乳酸的转化合成,这可能与L.caseiB3菌体中的乳酸脱氢酶、苯丙酮酸还原酶等关键生物酶有密切关系。
参考文献:
[1] LAVERMICOCCA P,VALERIO F,EVIDENTE A,et al.Purication and characterization of novel antifungal compounds from the sourdoughLactobacillusplantarumstrain 21B[J].Appl Environ Microbiol,2000,66(9):4084-4090.
[2] MU W M,CHEN C,LI X F,et al.Optimization of culture medium for the production of phenyllactic acid byLactobacillussp. SK007[J].Bioresour Technol,2009,100:1366-1370.
[3] FUJITA T,NGUYEN H D,ITO T,et al.Microbial monomers custom-synthesized to build true bio-derived aromatic polymers[J].Appl Microbiol Biotechnol,2013,97(20):8887-8894.
[4] 倪正,关今韬,沈绍传,等.苯乳酸的微生物合成及分离研究进展[J].化工进展,2016,35(11):3627-3633.
[5] ZHENG Z J,ZHAO M Y,ZANG Y,et al.Production of optically pure L-phenyllactic acid by using engineeredEscherichiacolicoexpressing L-lactate dehydrogenase and formate dehydrogenase[J].J Biotechnol,2015,207:47-51.
[6] 朱银龙,贠军贤,沈绍传,等.透化性干酪乳杆菌细胞转化苯丙酮酸合成苯乳酸[J].高校化学工程学报,2015(2):495-500.
[7] 王海宽,高雪芹,张淑丽,等.底物对凝结芽孢杆菌TQ33产苯乳酸的影响[J].天津科技大学学报,2014(6):11-15.
[8] KAWAGUCHI H,UEMATSU K,OGINO C,et al.Simultaneous saccharification and fermentation of kraft pulp by recombinantEscherichiacolifor phenyllactic acid production[J].Biochem Eng J,2014,88:188-194.
[9] PRASUNA M L,MUJAHID M,SASIKALA C,et al.L-Phenylalanine catabolism and L-phenyllactic acid production by a phototrophic bacterium,RubrivivaxbenzoatilyticusJA2[J].Microbiol Res,2012,167(9):526-531.
[10] FUJII T,SHIMIZU M,DOI Y,et al.Novel fungal phenylpyruvate reductase belongs tod-isomer-specific 2-hydroxyacid dehydrogenase family[J].Biochim Biophys Acta,2011,1814:1669-1676.
[11] ZHENG Z J,MA C Q,GAO C,et al.Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells ofBacilluscoagulansSDM[J].PloS ONE,2011,6(4):e19030.
[12] 韩旭,陈光,王立梅,等.一株产苯乳酸米根霉的鉴定及产物分析[J].吉林农业,2010(4):82-83.
[13] 沐万孟,刘凤丽,张涛,等.渗透化细胞转化生成苯乳酸的研究[J].食品与发酵工业,2009,35(3):19-22.
[14] 刘凤丽,沐万孟,江波,等.静息细胞转化合成苯乳酸的条件优化[J].食品工业科技,2008,29(8):67-70.
[15] VALERIO F,LAVERMICOCCA P,PASCALE M,et al.Production of phenyllactic acid by lactic acid bacteria:an approach to the selection of strains contributing to food quality and preservation[J].FEMS Microbiol Lett,2004,233:289-295.
[16] THIERRY A,MAILLARD M B.Production of cheese flavor compounds derived from amino acid catabolism byPropionibacteriumfreudenreichii[J].Dairy Sci Technol,2002,82(1):17-32.
[17] 卢志洪,刘志成,郑穗平.不同溶氧条件下谷氨酸棒杆菌发酵过程代谢物及关键酶酶活分析[J].中国酿造,2010,29(6):28-31.
[18] 杨艳坤,王芬,孙杨,等.不同溶氧对谷氨酸棒杆菌代谢的影响[J].微生物学通报,2016,43(11):2540-2549.
[19] LI X F,JIANG B,PAN B L,et al.Purification and partial characterization of lactobacillus species SK007 lactate dehydrogenase(LDH) catalyzing phenylpyruvic acid(PPA) conversion into phenyllactic acid(PLA)[J].J Agric Food Chem,2008,56(7):2392-2399.
