促红细胞生成素经超声微泡介导治疗大鼠损伤面神经的研究*
2018-06-12苏俊波骆文龙郝亚宁王德平
苏俊波,骆文龙,郝亚宁,王德平,刘 进
(重庆医科大学附属第二医院,重庆 400010)
面神经是支配面部表情肌的混合神经,若受损易致面瘫,损伤后的修复是多学科合作的重要研究领域。近年来,学者们逐渐认识到神经生长微环境的重要性,并发现了多种神经营养因子,其中促红细胞生成素(EPO)主要由肾脏合成,有促进红细胞生成作用[1]。EPO及其受体在神经系统广泛分布,具有抗凋亡、抗炎、促进神经营养因子释放和神经再生等作用[2]。但EPO在人体内降解较快,全身给药神经营养效果不佳。微泡造影剂利用超声波与微泡造影剂相互作用所产生的生物学效应,可实现靶向治疗。本研究中运用超声靶向微泡(UTMD)介导EPO基因治疗大鼠面神经损伤,观察治疗后EPO基因mRNA转录水平及治疗效果,为研究和评价超声靶向微泡介导的面神经基因转染提供可靠依据。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:超声转染仪,BL-6420C型生物信号采集与处理系统及脂质微泡(白色冻干粉末状)由重庆医科大学附属第二医院超声影像学研究所提供。
试药:EPO液由重庆医科大学附属第二医院肝病研究治疗中心提供,PT-PCR引物,Trizol试剂由武汉谷歌生物科技有限公司提供。
实验动物:清洁级成年健康SD大鼠(雌雄不限),40只,体质量 220~230 g,许可证号为 SCXK(渝)2012-0001,由重庆医科大学动物实验中心提供,遵循实验动物伦理学原则进行处置。
1.2 方法
1.2.1 质粒提取
EPO液经大肠杆菌扩增16 h后,提取纯化,经酶切电泳鉴定,紫外分光光度计测定质量浓度为1 g/L。
1.2.2 脂质微泡与EPO基因的结合
脂质微泡中加入2 mL生理盐水混合摇匀,微泡直径 3~5 μm,浓度 0.5×108~1.0×108/mL。加入含 EPO基因溶液(质粒质量浓度为 1 g /L)0.5 mL,混匀,室温下静置30 min,使基因充分黏附,检测混合液中质粒量浓度为 0.2 g /L。
1.2.3 动物模型制作
采用5%戊巴比妥30 mg/kg腹腔内注射麻醉大鼠,局部注射5%利多卡因追加麻醉;在手术显微镜下切开大鼠右侧颞骨骨泡,用磨砖磨去面神经镫骨肌支骨管约3 mm,蚊式钳钳夹面神经干长约2 mm,力量为三扣,持续60 s,松开30 s,再钳夹60 s,手术显微镜观察,面神经损伤程度为束膜性神经中断,符合Sunderland损伤Ⅳ度[3],缝合皮肤。各大鼠术后混合饲养。
1.2.4 动物分组及给药
应用随机数字表法将面神经损伤大鼠分为4组,每组10只。A组:EPO+超声组,经股静脉插管注入含EPO 0.2 mg基因溶液1 mL,并使用超声转染仪紧贴大鼠面神经受损部位体外照射,功率0.75 W/cm2,频率1 MHz,照射 10 s,间隔 10 s,共 2 min; B 组:EPO + 微泡组,经股静脉注入载基因微泡溶液1 mL;C组:EPO+超声+微泡组,注入载基因微泡溶液1 mL,再用超声触发,参数同A组;D组:单纯手术组,输入1 mL PBS作为对照。
1.2.5 一般状况观察
于面神经损伤后第1,7,14,28天观察每组大鼠进食、活动、眼部闭合、鼻尖偏向、胡须摆动、局部皮肤肌肉情况。
1.2.6 神经电生理检测
面神经损伤后第28天,以10%水合氯醛麻醉大鼠并固定,将记录电极插入面神经支配的面颊肌,电极间距约为4~6 mm,深度为(4±1)mm。针灸针刺激电极分插至神经损伤处近中枢段和外周端肌肉,采用BL-6420C型生物信号采集与处理系统,以波宽1 ms的正方波刺激,频率60 Hz,电流从0 mA开始,至出现动作电位。测定面神经动作电位波幅、潜伏期及传导速度。
1.2.7 标本采集
面神经损伤大鼠模型经基因转染28 d后,以10%水合氯醛 3.5 mL/kg腹腔注射麻醉大鼠;采用升主动脉插管,剪开右心耳;快速灌注生理盐水300 mL,至右心耳流出血液完全变清;立即用4%多聚甲醛PBS液,先快后慢灌注约250 mL,直至大鼠四肢僵硬。切取损伤处神经组织约1 mm。
1.2.8 损伤面神经组织中EPO基因mRNA转录的检测
采用PT-PCR法,引物由武汉谷歌生物科技有限公司提供,根据GenBank中登录的EPO基因合成。提取损伤处面神经组织RNA(Trizol试剂),以合成的cDNA第一链为模板,进行PCR扩增(反应条件:94℃、30 s,54 ℃ 、30 s,72 ℃ 、40 s,共 35 个循环)。mRNA 水平用β-actin作为内标,以扩增倍数=2-△△CT表示基因相对表达量。
1.3 统计学处理
采用SPSS 19.0统计软件进行分析,计量资料以均数±标准差表示,多个样本均数间两两比较行 q检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般状况
各组大鼠术后无死亡,切口无感染。面神经损伤后第1天,每组大鼠均出现饮食降低,活动范围缩小。损伤侧胡须倒伏、无摆动,鼻尖左偏,无闭眼;转染后第7天,各组大鼠胡须摆动情况较第1天无好转,组间无显著差别;损伤后第14天,A组、B组、D组大鼠仍无明显变化,C组大鼠术侧有少量胡须可观察到细微摆动,鼻尖仍向左偏,有上睑细微运动;术后第28天,A组、B组、D组大鼠术侧胡须较前有明显恢复,A组大鼠胡须部分向前竖起,但摆动无力,鼻尖稍偏左,右眼闭合不完全,C组大鼠术侧胡须可见有力的节律性摆动,鼻尖基本居中,右眼可闭合,肌肉萎缩较其余组大鼠程度轻。
2.2 神经电生理检测指标
C组大鼠面神经动作电位波幅和面神经传导速度高于A组、B组、D组,潜伏期低于其余3组(P<0.05)。详见表1。
表1 各组大鼠转染后第28天损伤面神经电生理检测指标比较(±s,n=10)
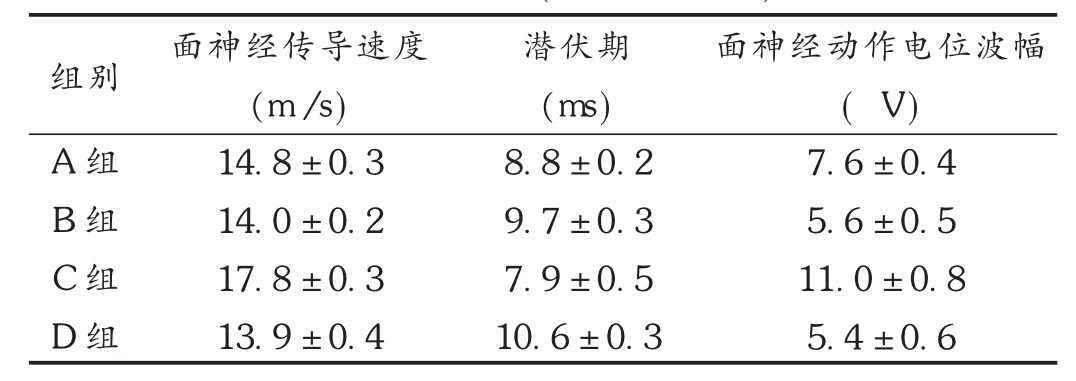
表1 各组大鼠转染后第28天损伤面神经电生理检测指标比较(±s,n=10)
组别A组B组C组D组面神经传导速度(m /s)14.8 ± 0.3 14.0 ± 0.2 17.8 ± 0.3 13.9 ± 0.4潜伏期(ms)8.8 ± 0.2 9.7 ± 0.3 7.9 ± 0.5 10.6 ± 0.3面神经动作电位波幅(μV)7.6 ± 0.4 5.6 ± 0.5 11.0 ± 0.8 5.4 ± 0.6
2.3 大鼠损伤处神经组织中EPO mRNA转录水平
C组大鼠面神经损伤处EPO mRNA表达量明显高于 A 组、B 组、D 组(P <0.05)。详见图 1。
3 讨论

图1 大鼠损伤处神经组织中EPO基因mRNA转录水平
面神经从桥脑发出,经过内听道及岩骨中狭长的骨性管道-面神经管,通过茎乳孔出颅腔,在这之间的任何部位受到损伤,皆可导致部分性或完全性面瘫。目前,面神经损伤的治疗多强调手术修复,但手术治疗存在风险,手术的适应证及获益仍不明确。研究发现,面神经损伤后的功能修复需要神经元胞体的存活和轴突的延伸。远端面肌来源的神经营养因子向神经元胞体逆行性运输发生障碍,使损伤局部神经营养因子缺乏,导致轴突再生的微环境遭到破坏[4]。此外,损伤细胞凋亡机制参与了面神经元的变性和死亡[5]。
EPO已被证实是一种新型的神经保护因子[6],其与EPO受体结合后,使JAK2发生自体磷酸化,通过激活磷脂酰肌醇3,进一步激活 STAT-5。活化的 JAK2激活Bcl-2相关的细胞死亡促进蛋白等底物,发挥抑制凋亡作用;同时,活化的STAT-5移至细胞核,刺激线粒体内抗凋亡蛋白的释放,并通过抑制与细胞色素C释放有关的基因活性,减少凋亡发生[7]。
Viviani等[8]发现,EPO能诱导脑源性神经营养因子(BDNF)的表达,而BDNF在神经保护作用中也具有重要地位。另外,EPO能增加星型胶质细胞释放β-神经生长因子(β-NGF)促进神经元生长。在坐骨神经损伤的动物试验中发现,EPO组损伤处雪旺氏细胞数量较对照组明显增加,体外试验则发现,EPO通过激活JAK2机制,刺激雪旺细胞增殖[9]。在自身免疫性脑脊髓炎动物模型中,EPO可增强少突胶质细胞的增殖和促进髓鞘的再生。本研究中,C组大鼠的面神经功能恢复较A组、B组、D组好,术侧胡须摆动、右眼闭合情况及鼻尖位置及均优于A组、B组、D组;神经电生理方面,C组大鼠的面神经动作电位波幅、面神经传导速度及潜伏期也明显优于A组、B组、D组,进一步证实了EPO的神经营养作用。
EPO有促进红细胞生成的作用,全身用药将会引起血液黏稠、血栓形成,甚至产生抗EPO抗体,出现纯红细胞再生障碍性贫血。超声微泡作为载体不但可在体循环中减少药品不良反应,提高病变区域的药物浓度,还可保护基因片段不被清除和降解[10]。同时,超声微泡作为一种非病毒载体,具有转染效率高、制备简易、无免疫原性等优势[11]。本研究中C组大鼠面神经损伤处EPO基因mRNA的表达量也显著高于A组、B组、D组。说明超声微泡造影剂能与目的基因有效结合,将目的基因转染靶组织,为修复受损面神经提供了安全、高效的途径。
综上所述,超声微泡介导EPO对受损面神经具有修复作用,为面神经的生物学治疗提供了新方法。
[1]Recny MA,Scoble HA,Kim Y.Structural characterization of natural human urinary and recombinant DNA -derived erythropoietin.Identification of des- arginine 166 erythropoietin[J].The Journal of Hiological Chemistry,1987,262(35):17156 - 17163.
[2]代喻兵,骆文龙,陈红江,等.面神经损伤后rhEPO对面神经运动神经元的保护作用[J].中国康复医学杂志,2008,23(6):491-494.
[3]任国山,赵长义,张喜平,等.面神经在不同功能状态下所需神经元的定量分析[J].中国临床康复,2005,9(25):40 - 41.
[4]刘 阳,苏俊波,骆文龙.肝细胞生长因子对面神经损伤后运动终板及肌纤维修复作用的研究[J].重庆医学,2004,33(8):1231-1233.
[5]Butler DP,Grobbelaar AO.Facial palsy:what can the multidisciplinary team do?[J].Journal of multidisciplinary healthcare,2017,10:377 - 381.
[6]Campana WM,Myers RR.Erythropoietin and erythropoietin receptors in the peripheral nervous system:changes after nerve injury[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology,2001,15(10):1804 - 1806.
[7]Egrie JC,Dwyer E,Browne JK,et al.Darbepoetin alfa has a longer circulating half-life and greater in vivo potency than recombinant human erythropoietin[J].Experimental hematology,2003,31(4):290-299.
[8]Viviani B,Bartesaghi S,Corsini E,et al.Erythropoietin protects primary hippocampal neurons increasing the expression of brainderived neurotrophic factor[J].Journal of Neurochemistry,2005,93(2):412-421.
[9]Kang SY,Kang JH,Choi JC,et al.Expression of erythropoietin in the spinal cord of lewis rats with experimental autoimmune encephalomyelitis[J].Journal of Clinical Neurology,2009,5(1):39-45.
[10]Ho YJ,Chang YC,Yeh CK.Improving Nanoparticle Penetration in Tumors by Vascular Disruption with Acoustic Droplet Vaporization[J].Theranostics,2016,6(3):392 - 403.
[11]Sato M,Motoyoshi M,Shinoda M,et al.Noriyoshi Shimizu.Low -intensity pulsed ultrasound accelerates nerve regeneration following inferior alveolar nerve transection in rats[J].Eur J Oral Sci,2016,124(3):246 - 250.
