晚期结直肠癌患者血浆cf DNA中 K-RAS突变及与西妥昔单抗耐药的关系研究*
2018-06-12庞雄昊梁文丽李美香
林 琳,庞雄昊,梁文丽,李美香
(广东省深圳市第二人民医院肿瘤科,广东 深圳 518037)
晚期结直肠癌是种异质性很大的疾病,肿瘤细胞遗传的多样性和肿瘤细胞抗原表达的易变性[1]为临床诊治带来很多挑战。临床 K-RAS基因检测的开展,为患者个体化治疗迈出重要一步。多项临床研究证实,对于K-RAS野生型晚期结直肠癌患者,化学治疗联合西妥昔单抗治疗有效率、无疾病进展时间和总生存时间均得到明显改善,但西妥昔单抗治疗最终会出现进展[2]。目前预测西妥昔单抗治疗耐药的指标不多,Musella等[3]研究发现,循环肿瘤细胞的数目可以作为 RAS-BRAF野生型晚期结直肠癌的预后指标,并可预测西妥昔单抗治疗的失败。cfDNA来源于肿瘤细胞的坏死或凋亡,半衰期数小时,能实时反映体内肿瘤状态,并携带肿瘤特异性基因改变,检测手段相对成熟。Morgan等[4]研究发现,相对于病理组织检测 K-RAS突变,通过 PCR kit技术检测晚期结直肠癌患者血浆中携带 K-RAS突变的cfDNA水平,发现敏感性和特异性为31%和97%,可作为组织活检的补充。Thierry等[5]通过定量PCR技术检测晚期结直肠癌患者外周血中携带 K-RAS突变的cfDNA水平与组织学中 K-RAS突变情况,发现cfDNA的敏感性和特异性为92%和98%。因此,通过检测晚期结直肠癌患者外周血血浆携带 K-RAS突变的cfDNA水平在临床是可行的。为揭示检测结直肠癌患者血浆cfDNA的 K-RAS突变情况和活组织检测的差异,确定结直肠癌患者血浆cfDNA中的 K-RAS突变情况与西妥昔单抗治疗效果的关系,解决临床以影像学为主导的药物治疗疗效和耐药判定问题,本研究中探讨了动态检测患者外周血血浆中携带 K-RAS突变的cfDNA与患者预后的关系。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:经CT检查证实可测量的病灶;经病理组织学确诊,组织病理学检测结果为第Ⅳ期mCRC;氟尿嘧啶、奥沙利铂和伊立替康治疗失败;体能状态评分(ECOG)为0~2分;各器官功能不存在明显缺陷;本研究经我院医学伦理委员会批准,所有患者签署知情同意书。
病例选择:选择医院2015年6月至2017年6月收治的经组织病理学确诊的晚期结直肠癌患者100例,男67例,女 33例;年龄 62~78岁,平均(69.48±7.76)岁;结肠癌44例,直肠癌56例;肝脏转移26例,肺转移22例,盆腔转移19例,纵隔淋巴结转移18例,骨转移15例。
1.2 方法
给药方案:西妥昔单抗注射液(Merck KGaA,进口药品注册证号 S20130004,规格每瓶为20 mL∶100 mg)静脉滴注120 min,随后每周250 mg/m2持续静脉滴注60 min,2 个月后改为 500 mg/m2,每 2 周 1 次,与化学治疗同时进行。给药前30 min常规给予组胺受体拮抗剂盐酸异丙嗪注射液(广东南国药业有限公司,国药准字H44022504,规格为每支 2 mL∶50 mg)25 mg 肌肉注射,地塞米松磷酸钠注射液(国药集团容生制药有限公司,国药准字号 H41020036,规格为每支5 mg∶1 mL)5 mg静脉注射,使用西妥昔单抗时行心电监测。西妥昔单抗使用60 min后联合细胞毒药物。
FOLFIRI方案:盐酸伊立替康注射液(江苏恒瑞医药股份有限公司,国药准字H20061276,规格为每支5 mL∶100 mg)180 mg/m2,静脉滴注 30 ~90 min;亚叶酸钙注射液(江苏恒瑞医药股份有限公司,国药准字H20020177,规格为每支 5 mL ∶50 mg)200 mg/m2,静脉滴注 2 h,第 1~2 天;5-氟尿嘧啶(5-FU,西南药业股份有限公司,国药准字 H50020128,规格为每支 10 mL ∶0.25 g)400 mg/m2,静脉注射,第1天,联合5-FU 2 400 mg/m2,持续静脉泵入46 h,14 d为1个周期。所有患者使用化疗方案+表皮生长因子受体(EGFR)单抗治疗。治疗前后,检测患者血液和穿刺组织中样本的 K-RAS突变状态,K-RAS突变型患者使用标准化方案,野生型患者使用西妥昔单抗首次 400 mg/m2持续。RECIST 版本 1.1和 NCI-CTCAE版本4.0用于检查研究中的终点。
血液收集:通过外周血液抽吸,将7.5 mL全静脉血收集在EDTA管(美国BD生物公司)中,保持于4℃冰箱直到分离,在收集后1 h内进行。将全血离心10 min(4℃,820 g),并将血浆级分转移至2 mL冷试管(德国艾本得生物有限公司)中,再次离心 10 min(4 ℃,20 000 g),并在新鲜的2 mL管中回收纯血浆,于-80℃下立即储存,直到cfDNA提取。
DNA提取:根据说明书,使用 QIAamp Circulating Nucleic Acid Kit(德国凯杰生物有限公司)从血浆中提取循环的无细胞DNA。取2 mL血浆进行cfDNA提取,并在50 μL洗脱缓冲液中回收cfDNA,4℃保存。
cfDNA定量:通过使用Qubit 2.0荧光计(美国赛默飞世尔有限公司)的荧光测量法确定cfDNA的总量。通过QIAamp循环核酸试剂盒获得的2 μL DNA洗脱液,并根据说明书使用Qubit dsDNA HS测定试剂盒(美国赛默飞世尔有限公司)测定浓度。
K-RAS突变检测和定量:为了鉴定 K-RAS突变,回顾了FFPE肿瘤样品的HE染色载玻片,选择肿瘤组织进行分析。通过微观解剖去除来自2个未染色、5 μm厚组织切片的相应组织,并通过在TEN缓冲液(1 mmoL EDTA,10 mmoL TRIS - HCl,0.1 moL NaCl,pH 8.0)中孵育将组织裂解,包括蛋白酶K(20 g/L)过夜,62℃。将所得裂解物用于PCR反应,以扩增编码 K-RAS外显子 2(密码子 12/13),外显子 3(密码子 59和 61),以及 K-RAS的外显子4(密码子117和146)的区域基因。将 3 μL 裂解液加入 47 μL PCR 反应中,包括 25 μL PCR Master Mix S(美国赛默飞世尔有限公司),0.5 μL特异性 PCR引物混合物(每个引物25 pmol)和21.5 μL Millipore H2O。循环条件为,95℃ 5 min;2× [95℃ 30 s,62℃ 30 s,72℃ 30 s];2× [95℃ 30 s,60℃ 30 s,72℃30 s];2× [95℃ 30 s,58℃ 30 s,72℃ 30 s];35× [95℃30 s,58 ℃ 30 s,72 ℃ 30 s];72 ℃ 10 min。在 1% 琼脂糖凝胶上分离PCR反应的一部分,以确保 K-RAS区域的成功扩增。不同 K-RAS的突变状态通过使用PyroMark Q24型测序仪(德国凯杰生物有限公司)的热测序确定密码子。根据QIAGEN的pyro-sequencing试剂的使用说明进行热解测序。所有引物的序列可根据要求提供。
1.3 统计学处理
应用Graph Pad Prism 7版本分析。除非另有说明,连续变量的结果以平均值±中值绝对偏差或平均值±标准误差表示,行Student′s t检验或 Mann-Whitney U检验;分类变量的比较行Fisher精确检验生存曲线行Mantel-Cox对数秩检验;相关分析由Pearson或Spearman相关分析进行。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后 K-RAS突变丰度对比
首先,在转移性CRC的初步诊断中,应用了 K-RAS基因热点区域的ARMS-PCR检测cfDNA和肿瘤组织中 K-RAS突变情况。评估了外显子2(密码子12/13)、外显子3(密码子 59和61)和外显子 4(密码子 117和146)的 K- RAS状态,并鉴定了 82.50%(33/40),其中cfDNA和组织中均检测出的 K-RAS突变的一致性为62.50%。使用来自相应患者的 cfDNA的 ARMS-PCR技术对数据进行补充,结果见表1。可见,cfDNA可作为无法取到组织样本时的一种可行的检测方法。
表1 治疗前后cfDNA的突变丰度比较(,%)
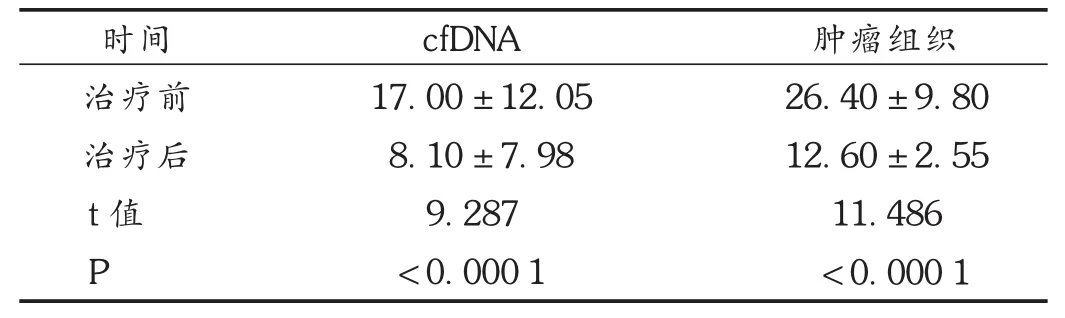
表1 治疗前后cfDNA的突变丰度比较(,%)
时间治疗前治疗后t值P cfDNA 17.00 ± 12.05 8.10 ± 7.98 9.287< 0.000 1肿瘤组织26.40 ± 9.80 12.60 ± 2.55 11.486< 0.000 1
2.2 K-RAS状态与西妥昔单抗耐药间的关系分析
1例患者中,原发肿瘤组织是 K-RAS外显子2-4的野生型,同时cfDNA分析也证实了 K-RAS表达为野生型,给予患者FOLFIRI+西妥昔单抗进行治疗,见图1 A。在疾病进展后,检测到 K-RAS呈现突变状态,且相较于传统的血清学和影像学检测,cfDNA的检测更方便、准确,可实时动态监控患者的疾病状态。另1例患者,肿瘤组织也被确定为 K-RAS外显子2-4的野生型,但cfDNA检测到的 K-RAS 3号外显子突变,即是Q61H,由于组织分析是当时 K-RAS评估的标准,患者接受了FOLFIRI+帕尼单抗(患者自行购买)治疗。结果显示,K-RAS突变在治疗开始后1个月,cfDNA中并没有 K-RAS突变,可能是由于采用细胞毒剂(伊立替康)治疗。约5个月后(即放射学确认的疾病进展前超过2个月),cfDNA中再次检测到相同的突变,详见图1 B。结果表明,与单次cfDNA定量相比,基于cfDNA的 K-RAS筛查在治疗期间早期检测疾病进展有潜在价值,EGFR单抗治疗中 K-RAS的突变状态是导致耐药的重要因素。
2.3 K-RAS状态与预后的关系
根据cfDNA中基因表达水平进行患者的生存分析已被用于多类型的癌症,汇总分析证实,cfDNA中 K-RAS水平升高的总生存期(OS)缩短。在肿瘤中肿瘤体积和肿瘤中cfDNA的含量存在正相关关系。详见图2A。K-RAS的突变丰度在无疾病生存期(PFS)中有着显著差异(P=0.047),见图2B。K-RAS野生型患者和 K-RAS突变型患者OS也存在显著差异,野生型患者中位OS为10.2个月(8.3~11.7)个月,突变型患者的中位 OS 为 5.2 个月(4.6 ~5.9)个月(HR=1.78,P =0.000 6),详见图 2 C。故cfDNA中 K-RAS的状态和患者预后存在明显的相关性。
3 讨论

图1 K-RAS状态与西妥昔单抗耐药的关系

图2 K-RAS状态与预后的关系
随着手术治疗、化学治疗、放射治疗等综合治疗手段的进步,早期结直肠癌患者的预后得到明显改善,但仍有50%~60%的结直肠癌患者确诊时已伴远处转移。化疗药物及生物靶向药物的临床应用,晚期结直肠癌患者OS延长至30多个月以上,且提高了生活质量[6]。
研究表明,患者待检测样品中可分离并分析特定的基因和肿瘤的关系[7]。cfDNA于1948年首次被描述,已作为潜在的癌症患者体征的说明[8-10]。对于动态cfDNA分析,集中在临床相关的2个时间点,即治疗前和治疗后,可通过成像确定。本研究中,治疗前cfDNA中 K-RAS的突变丰度呈明显变化,治疗前后组织中 K-RAS突变丰度明显高于cfDNA中 K-RAS,组织中肿瘤细胞的含量更高,外周血中肿瘤细胞的含量相对低于肿瘤组织,故检测结果中存在细微差异。一致性方面,cfDNA和肿瘤组织中同时检测的 K-RAS突变比例达62.50%,这与以往研究数据[11-12]一致。因此,结直肠癌患者治疗过程中行K-RAS定量对肿瘤采取无创治疗方法具有指导意义。
K-RAS基因的突变对于结直肠癌患者后续治疗方案的选择有重要意义。有研究显示,K-RAS位于EGFR基因下游,对于 K-RAS基因突变的患者,EGFR单抗类药物获益程度不大[13]。本研究中,在EGFR野生型患者,K-RAS治疗前突变为0,但随着治疗的深入,K-RAS基因的突变丰度增加,特别是在再次发生疾病进展时突变丰度明显升高;同时,cfDNA的检测方法相较于传统的影像学和血清学的检测更方便,且可检出突变的时间略微提前。目前,许多研究集中在 K-RAS的发生和突变的复发 K-RAS抗下等位基因EGFR治疗[14-16]。但目前临床仍不清楚该如何处理这些结果。关于组织cfDNA之间发生 K-RAS突变时如何选择,本研究结果显示,K-RAS突变确实可在化疗加抗EGFR抗体的组合下消失,且在疾病进展时被再次检测出。因此,在某些情况下,明显的联合化疗也能抑制结直肠癌中的 K-RAS突变。
基因突变与患者的无疾病生存率及总生存率存在一定的关系。本研究结果显示,K-RAS突变的患者总生存率明显低于 K-RAS野生型患者,且无疾病生存率也展现出类似结果,故对于肿瘤患者热点基因的检测就显得至关重要。晚期结直肠癌患者 K-RAS的状态和临床用药及预后存在明显的相关性。
[1]鞠海星.结直肠癌的遗传异质性与分子分型[J].中华结直肠疾病电子杂志,2015,4(4):17-20.
[2]王 哲,孙玉秀,李皓静,等.西妥昔单抗联合化疗与单纯化疗治疗 k-ras野生型晚期结直肠癌临床观察[J].肿瘤学杂志,2017,23(1):45 - 48.
[3]Musella V,Pietrantonio F,Di BE,et al.Circulating tumor cells as a longitudinal biomarker in patients with advanced chemorefractory,RAS-BRAF wild-type colorectal cancer receiving cetuximab or panitumumab[J].International Journal of Cancer, 2015, 137(6):1467-1474.
[4]Morgan SR,Whiteley J,Donald E,et al.Comparison of KRAS Mutation Assessment in Tumor DNA and Circulating Free DNA in Plasma and Serum Samples[J].Clin Med Insights Pathol,2012,5:15-22.
[5]Thierry AR,Mouliere F,El Messaoudi S,et al.Clinical validation of the detection of KRAS and BRAF mutations from circulating tumor DNA[J].Nat Med,2014,20(4):430 - 435.
[6]García - Alfonso P,Ferrer A,Gil S,et al.Neoadjuvant and conversion treatment of patients with colorectal liver metastasis:the potential role of bevacizumab and other antiangiogenic agents[J].Target Oncol,2015,11:124 - 131.
[7]Thierry AR,Mouliere F,El Messaoudi S,et al.Clinical validation of the detection of KRAS and BRAF mutations from circulating tumor DNA[J].Nat Med,2014,20(4):430 - 435.
[8]Gormally E,Caboux E,Vineis P,et al.Circulating free DNA in plasma or serum as biomarker of carcinogenesis:practical aspects and biological significance[J].Mutat Res, 2007, 635(2-3):105-117.
[9]Jung K,Fleischhacker M,Rabien A.Cell-free DNA in the blood as a solid tumor biomarker- a critical appraisal of the literature[J].Clin Chim Acta,2010,411(21 - 22):1611 - 1624.
[10]Spindler KL,Pallisgaard N,Andersen RF,et al.Circulating free DNA as biomarker and source for mutation detection in metastatic colorectal cancer[J].PLoS One,2015,10(4):e0108247.
[11]Szpechcinski A,Chorostowska - Wynimko J,Struniawski R,et al.Cell-free DNA levels in plasma of patients with non- smallcell lung cancer and inflammatory lung disease[J].Br J Cancer,2015,113(3):476 - 483.
[12]Szpechcinski A,Rudzinski P,Kupis W,et al.Plasma cellfree DNA levels and integrity in patients with chest radiological findings:NSCLC versus benign lung nodules[J].Cancer Lett,2016,374(2):202-207.
[13]张惠锋,王昆华.KRAS基因的突变状态对EGFR单抗治疗结直肠癌的影响[J].世界华人消化杂志,2016,24(18):2850-2855.
[14]Marchese R,Muleti A,Pasqualetti P,et al.Low correspondence between K-ras mutations in pancreatic cancer tissue and detection of K - ras mutations in circulating DNA[J].Pancreas,2006,32:171 - 177.
[15]Yen LC,Yeh YS,Chen CW,et al.Detection of KRAS oncogene in peripheral blood as a predictor of the response to cetuximab plus chemotherapy in patients with metastatic colorectal cancer[J].Clin Cancer Res,2009,15:4508 - 4513.
[16]Spindler KL,Pallisgaard N,Andersen RF,et al.Gemcitabine and capecitabine for heavily pre-treated metastatic colorectal cancer patients-a phaseⅡand translational research study[J].Anticancer Res,2014,34(2):845 - 850.
