电池级碳酸锂精制工艺技术研究*
2018-06-11李鹏武尹晓刚杨锦瑜
李鹏武,尹晓刚,杨锦瑜,程 琥,董 娴,陈 卓
(贵州师范大学化学与材料科学学院,贵州贵阳550001)
近年来,随着科技的不断发展,中国2013—2015年锂电池消费世界占比由43%上升至70%,电池级碳酸锂需求量大幅增加[1-3]。目前,电池级碳酸锂生产工艺技术逐渐成熟。孙哲[4]以89%级碳酸锂为原料,在液固质量比为 25∶1、CO2流速为 4 L/min、氢化温度为20℃、氢化时间为60 min条件下制得电池级碳酸锂,产品纯度为99.5%、回收率为74%。马爱军等[5]在氢氧化锂完成液的碳化过程中加入Bys-201型络合剂去除钙镁硼杂质,在碳化温度为20℃、碳化时间为90 min、CO2流速为2.5 L/min、络合剂用量为3g/L条件下,钙镁硼的提取率均可达到98%以上。彭秋华[6]采用深度碳化法处理碳酸盐型锂精矿生产电池级碳酸锂,采用6次母液循环得到碳酸锂产品纯度为99.7%、回收率92%。可以看出,现有工艺技术仍存在耗时长、流程繁杂、液固比大、成本高以及对环境有影响、后续污水处理难等问题。
为进一步简化电池级碳酸锂生产工艺技术流程、提高生产效率、降低生产成本,笔者优化改进了氢化分解工序技术流程,将电池级碳酸锂氢化分解工序分为4个阶段:氢化前处理、氢化反应、热分解、母液循环。氢化前处理就是通过对工业级碳酸锂经络合洗涤除去杂质,得到杂质含量相对较低的预处理样品。氢化反应、热分解是将难溶Li2CO3按一定液固比调成浆液,通入CO2生成可溶性的LiHCO3溶液,此时可以除去不溶性杂质,将可溶性的LiHCO3溶液经加热分解得到纯度较高的电池级碳酸锂[7-9]。这两个阶段主要是除去碳酸锂中的杂质,提高电池级碳酸锂的纯度。最终通过母液循环来提高产率、降低整体反应的液固比。
1 实验部分
1.1 药品和仪器
药品:碳酸锂(工业级,纯度为98.8%)、CO2气体(工业级)、HCl(优级纯)、碳酸钠(基准试剂)、氨三乙酸(NTA,分析纯)等。
仪器:TAS-990 AFG原子吸收分光光度计;DK-98-Ⅱ电热恒温水浴锅;98-1-C型数字控温电热套;T-50抽滤装置;M2637-H微孔滤纸;JJ-1电动搅拌器;PHS-3 E pH计;AL 104电子天平。
1.2 实验方法
氢化前处理:称取200 g工业级Li2CO3加入到1 000 mL烧杯中,以液固质量比为2∶1加水调浆,同时加入过量杂质数倍的NTA,在25℃水浴中搅拌60 min成洗涤浆液,经微孔滤膜抽滤,再经烘干得到预处理样品。
氢化反应:称取一定量预处理样品于1 000 mL烧杯中,按设定的液固质量比加水调浆,在恒温水浴中加热并通入CO2气体,同时用电动搅拌器搅拌,氢化反应结束后生成氢化液,经过滤得到氢化清液。
热分解:将氢化清液加热、搅拌一定的时间,经过滤、洗涤、烘干得到电池级碳酸锂。
母液循环:热分解滤液补加蒸发水分至氢化反应时的液体体积,再次称取定量的预处理样品调浆,按氢化反应、热分解流程进行母液循环,直至所得精制Li2CO3无法达到标准,结束循环。
电池级碳酸锂精制工艺技术路线图见图1。

图1 电池级碳酸锂精制工艺技术路线图
1.3 检测方法
Li2CO3纯度测定采用GB/T 11064—2013《碳酸锂、单水氢氧化锂、氯化锂化学分析方法》第1部分:碳酸锂量的测定——酸碱滴定法;杂质Ca测定采用GB/T 11064—2013《碳酸锂、单水氢氧化锂、氯化锂化学分析方法》第5部分:钙量的测定——火焰原子吸收光谱法;杂质Mg测定采用GB/T 11064—2013《碳酸锂、单水氢氧化锂、氯化锂化学分析方法》第6部分:镁量的测定——火焰原子吸收光谱法;溶液中pH采用pH计测定。
2 结果与讨论
2.1 氢化前处理
由于工业级碳酸锂中Ca、Mg等杂质含量较高,需要在氢化、热分解前对粗品Li2CO3进行处理,以降低Ca、Mg等杂质含量。经筛选得到最佳螯合剂为NTA、反应温度为25℃。而且NTA的生物降解速率较快,废水处理简单,环境污染小。表1为不同NTA用量洗涤粗品Li2CO3实验结果。实验条件:200 g工业级碳酸锂,2∶1液固质量比调浆,25℃搅拌60 min。由表1看出,Mg的去除效果由大到小为2号、3号、1号,Ca的去除效果由大到小为3号、2号、1号。综合2号和3号实验,6倍NTA用量更为合适,即NTA用量为Ca、Mg杂质总量的6倍。

表1 NTA洗涤粗品Li2CO3实验结果
2.2 氢化反应
在氢化反应中,加热温度、CO2流速、搅拌转速、反应时间等因素对氢化效果有很大的影响。有研究表明:氢化温度为25℃、CO2流速为1 L/min时氢化效果最佳[10-11];搅拌转速宜采用 300 r/min[12-13]。 为节约能源、降低生产成本,实验选取25℃作为氢化反应温度,CO2气体流速选取1 L/min,搅拌转速选择300 r/min。
2.2.1 氢化溶解率、溶液pH与时间的关系
选择液固质量比为 16∶1,分别在 15、30、60、90、120、150、180 min 取氢化液样品,经离心分离,检测上清液中LiHCO3的含量,得到氢化溶解率。图2是氢化溶解率、氢化液pH与氢化时间的关系。由图2看出,当氢化时间小于60 min时Li2CO3的溶解率随时间的增加而增加,60 min后增加的趋势变缓,90 min时达到最大值74%,此后趋于稳定,说明氢化已经达到终点;当氢化时间小于60 min时,氢化液pH随时间的增加逐渐降低,60 min后趋于稳定,180 min后溶液中剩余固体8.1 g,溶解的Li2CO3为23.1 g。因此,当液固质量比为16∶1时Li2CO3不能完全氢化,此时计算出理论液固质量比为21.6∶1,理论氢化时间约为90 min。
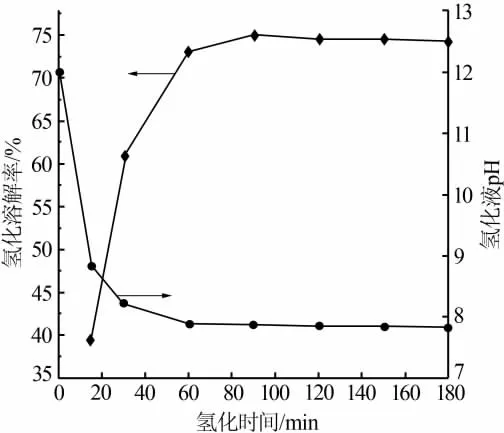
图2 液固质量比为16∶1时氢化溶解率、溶液pH与时间的关系
选择液固质量比分别为 20∶1、25∶1,每 10 min 取样检测,氢化溶解率、氢化液pH与氢化时间的关系见图3。从图3看出,液固质量比为20∶1和25∶1时与16∶1时的变化趋势相同,最大氢化溶解率分别为91.9%、98.7%。因此,液固质量比为25∶1时Li2CO3能完全被氢化。
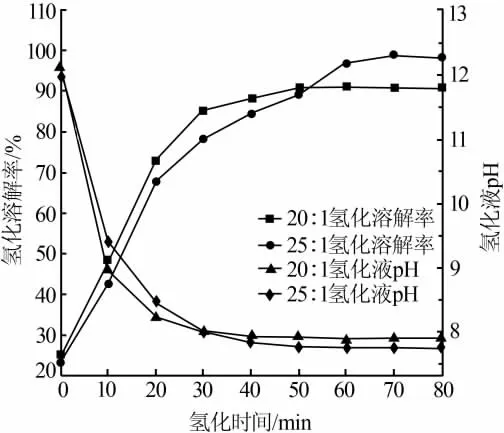
图3 液固质量比为20∶1、25∶1时氢化溶解率、溶液pH与时间的关系
由此得出,由氢化溶解率和氢化液pH的变化趋势所得到的结果相同,氢化反应终点为80 min时氢化液pH为7.8,经计算最佳液固质量比为22.7∶1。
2.2.2 氢化液中Ca、Mg杂质含量变化趋势
在液固质量比为 20∶1、25∶1 的氢化反应中,测定不同时间上清液中Ca、Mg的含量,结果见表2。由表2看出,上清液中Ca、Mg的含量随时间的增加呈波动状态,但整体缓慢升高,可见氢化反应对Ca、Mg没有良好的去除效果。而在液固质量比分别为20∶1、25∶1的环境中,液固质量比越大上清液中Ca、Mg的含量越低。由此可见,液固比对除杂效果有一定的影响,选取合适的液固比对氢化反应较为重要。综上可以得出,氢化反应的最佳液固质量比应≥23∶1,最佳反应时间为80 min。
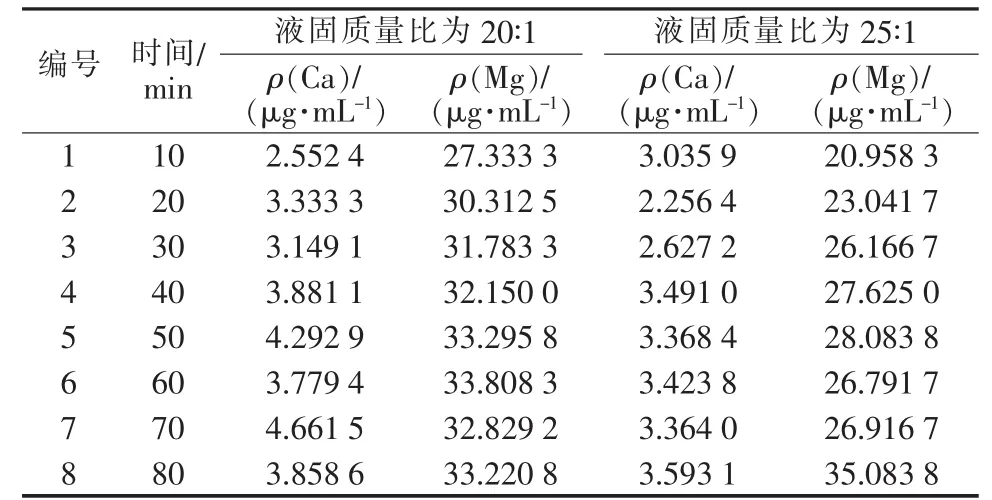
表2 液固质量比为 20∶1、25∶1 时上清液中不同时间钙镁的含量
2.2.3 氢化除杂效果研究
根据表2分析得出,氢化清液中Ca、Mg杂质含量相对较高,需要进一步除杂。经实验验证,在氢化清液中加入EDTA除杂效果较好。表3为未加入EDTA以及加入3、6、9倍钙镁杂质含量的EDTA对氢化液的除杂效果。由表3看出,随着EDTA用量增大氢化液中Ca、Mg含量逐渐下降,当EDTA用量大于3倍杂质含量时Ca含量的变化较慢,当EDTA用量大于6倍杂质含量时Mg含量的变化较慢。因此,EDTA最佳用量为6倍钙镁杂质含量。

表3 不同EDTA用量时氢化液中的钙镁含量
2.3 热分解
2.3.1 热分解条件
热分解过程是Li2CO3精制的重点步骤,也是除去 Ca、Mg、Na、K、B 等杂质的关键步骤,主要工艺条件有热分解温度、搅拌速率、分解时间等。根据LiHCO3的分解温度和有关研究报道,热分解最佳温度是 70~90 ℃[14-15],所以实验采用水浴加热,由 25 ℃升温至90℃恒温蒸发结晶,通过300 r/min搅拌转速加快蒸发结晶。由于水分蒸出量会影响产品纯度,水分蒸发过多无法达到除杂效果,也会造成资源浪费。经多次实验,控制蒸发水分的体积为100 mL较合适,此时回收率为48.4%,未能达到实验要求。
2.3.2 提高热分解效率
为进一步提高Li2CO3收率,实验主要以提高热分解效率进行研究。热分解时在氢化清液中加入乙醇,乙醇体积与Li2CO3收率的关系见图4。由图4看出,随着乙醇体积增加,Li2CO3收率不断升高;当乙醇体积大于5 mL以后,Li2CO3收率升高的趋势变缓。当乙醇体积为5 mL时,Li2CO3收率为59.3%,比空白组提高了10.9%,此时氢化清液与乙醇的体积比为100∶1;当乙醇体积为20 mL时,Li2CO3收率达到最大值60.2%,回收率提高了11.9%,此时氢化清液与乙醇的体积比为25∶1。由此可见,加入乙醇可以提高Li2CO3收率,按100∶1的体积比加入乙醇较合适。
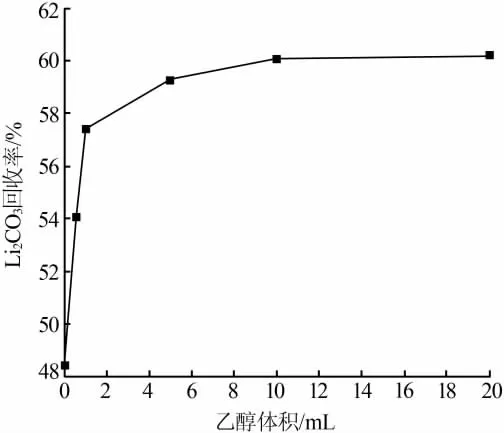
图4 乙醇体积与Li2CO3收率的关系
图5为温度达到90℃时,蒸发水分体积、Li2CO3回收率与时间的关系。由图5看出,在0~50 min,蒸发水分体积与回收率之间呈正相关关系。其中,前10 min是热分解效率最快的阶段,也是LiHCO3分解的最佳时间,10 min后回收率上升趋势减缓;30 min时蒸发水分体积刚好在100 mL左右,此时回收率达到69.5%,提高了21.1%。所以,最佳热分解时间为90℃时30 min。

图5 蒸发体积、Li2CO3回收率与时间的关系
2.3.3 精品洗涤除杂效果
在热分解过程中,蒸发结晶生成的精制Li2CO3中含有 Na2CO3、K2CO3、CaCO3、MgCO3等杂质。实验采取精品洗涤的方法除去可溶性杂质。图6是精品洗涤次数与纯度、损失率的关系。由图6可知,精制Li2CO3经洗涤后纯度有明显提高;随着洗涤次数增加,产品的损失率也不断升高。1次洗涤效果最佳,产品纯度提高了0.2%,但损失率较大(为3.8%)。5次洗涤产品纯度下降,说明4次洗涤已将可溶性杂质全部除去,5次洗涤不会提高产品纯度,只会损失产品。将3、4次洗涤效果进行对比,洗涤4次更优于除去杂质,但考虑到工艺简繁及产品损失,选取洗涤3次较为合适。

图6 精品洗涤次数与纯度、损失率的关系
2.4 母液循环
经过对氢化前处理、氢化反应、热分解3个工序进行探究,按工艺研究所得条件,以500 mL水作为反应溶剂,首次反应液固质量比为25∶1,进行6次母液循环反应。将7次反应所得精制Li2CO3混合,按1.5∶1的液固质量比加水调浆,共洗涤3次,每次洗涤10 min,过滤、烘干得到电池级碳酸锂。最终产品回收率为93%,精制碳酸锂纯度大于99.5%,Ca质量分数为0.000 5%,Mg质量分数小于0.002 0%。
3 结论
1)在电池级碳酸锂除杂研究中,采用氢化前处理、氢化热分解方法对工业级Li2CO3进行除杂,采用NTA在25℃洗涤Li2CO3中的Ca、Mg杂质有较好的效果,采用NTA洗后所得预处理样品经EDTA在氢化分解时深度除杂,最终杂质去除率达到98%以上。2)在氢化反应条件下,实验发现最佳氢化时间为80 min,单次氢化液固质量比应不小于23∶1。热分解过程中,加入乙醇或温度达到90℃均可提高热分解率,热分解所得产品经3次洗涤即为电池级碳酸锂。最终母液循环中,回收率达到93%,整体液固质量比降至11∶1,产品纯度达到99.5%以上,杂质Ca质量分数降至0.0005%,Mg质量分数降至0.0020%。
