三元体系Li+,K+/CO32--H2O 298.15 K稳定相平衡研究*
2018-06-11卜令忠余疆江穆延宗郑绵平
伍 倩,乜 贞,卜令忠,余疆江,穆延宗,郑绵平
(中国地质科学院矿产资源研究所,国土资源部盐湖资源与环境重点实验室,北京100037)
除含锂矿物外,自然界中的另一类锂资源是各种天然水,包括盐湖卤水、盐湖晶间卤水、地下卤水、油田水、地热水、海水等。锂含量高的天然卤水是重要的锂资源[1]。中国青藏高原发育有众多盐湖,其中碳酸盐型盐湖卤水以锂、钾、硼浓度高而著称于世,是重要的盐湖卤水锂资源产地,对卤水中锂、钾等盐类的分离提取将可以大大缓解中国锂、钾资源稀缺的严峻局面[2]。这类碳酸盐型盐湖具有重大经济价值和科学意义,开展盐湖卤水体系的理论和实验相平衡研究是卤水盐类资源综合利用的基础,对盐湖卤水的成因和成矿规律、复杂水盐体系化学行为的理论和实验研究都具有重要意义[3]。
由于碳酸盐型盐湖卤水的组成是一个复杂的八元水盐体系——Na+、K+、Li+/Cl-、SO42-、CO32-、HCO3-、B4O72--H2O,该体系的优点同时又是它的难点,是迄今国际上尚未攻克的体系[4]。笔者针对其中的三元子体系Li+,K+/CO32--H2O,开展298.15 K下稳定相平衡实验研究,获得溶解度数据与对应相图,明确平衡液相的物化参数随溶液组分含量的变化规律,以期完善含锂、钾卤水体系的热力学数据,并为实现富锂、钾卤水的综合开发利用提供参考依据。
1 实验部分
1.1 实验试剂和仪器
试剂:去离子水(pH≈6.6,电导率<1×10-5S/m),实验过程中配制料液和分析用的标准溶液均用此水,在配制所需料液前需煮沸以除去CO2;Li2CO3(纯度>99.9%)、K2CO3(纯度>99.9%)均为 GR 级,其他辅助试剂也均用GR级或基准试剂。
仪器:AL204型电子天平;RU-N-15型超纯水系统;IKA RET控制型加热磁力搅拌器;SOH-150C型SmartLab精密烘箱;DA-130N型手持式数字密度计;F-20A型精密pH计;WZ-202型手持式盐度计;SG78专业型便携式pH/离子浓度/电导率多参数测试仪;WFX-120B型原子吸收分光光度计;WYS-2W型阿贝折光仪;BH-2型数字偏光显微镜;DT5-1型高速台式离心机。
1.2 实验方法
采用等温溶解平衡法[5]进行三元体系 Li+,K+/CO32--H2O 298.15 K稳定相平衡实验。从次一级Li+/CO32--H2O二元体系的共饱点开始,逐渐加入另一种新盐K2CO3。利用电子天平精确称量K2CO3、Li2CO3和去离子水,依次放入锥形瓶中,配制不同组成的系列溶液。将其置入磁力搅拌器中,设定温度并控制在298.15 K(±0.02 K),不断搅拌以达到溶解平衡。定期抽取锥形瓶中的上层清液,测定其中的Li+含量,当连续两次的含量相差不大于0.5%时即认为体系达到平衡。对于析出的湿固相,及时进行镜下鉴定。平衡时间约为45天。
1.3 分析方法[6]
Li+测定采用原子吸收分光光度法;K+测定采用原子吸收分光光度法;CO32-测定采用酸碱滴定法;密度测定采用比重瓶法,辅以数字密度计;电导率、盐度等测定采用多参数测试仪;pH测定采用精密pH计;折光率测定采用阿贝折光仪;平衡固相测定采用湿渣法,辅以镜下鉴定法。
2 实验结果与讨论
2.1 实验平台的优化和改进
水盐体系相平衡实验过程的许多步骤均会影响数据的可靠性,需要采用诸多措施来降低实验误差[7],比如:对环境温度和湿度的控制、溶液混合的均匀程度和达平衡的时长、取样和分析方法的精准性以及对实验数据的处理过程等,都是决定实验获得溶解度数据的准确性和可靠性的关键因素。因此,首先对水盐体系相平衡实验平台做了相应的优化和改进。
1)恒温水浴系统。为尽可能在有限的时间内获得更多可靠有用的实验数据,设计制作了适用于水盐体系相平衡实验的恒温水浴系统。该系统不仅可以同时开展多个不同配比溶液体系的相平衡实验,而且能够使系统内温度保持均一稳定、水浴槽内外部温湿度差较小,从而有效避免了由于环境变化等造成测量结果的误差。优化和改进后的恒温水浴系统见图1。

图1 优化和改进后的恒温水浴系统

图2 采用加工处理后的取样器移取液样
2.2 三元体系Li+,K+/CO32--H2O 298.15 K稳定相平衡实验结果
表1为采用上述方法取得的三元体系Li+,K+/CO32--H2O 298.15 K溶解度数据。表2为对应平衡溶液物化参数。根据实验数据绘制了三元体系Li+,K+/CO32--H2O 298.15 K稳定相图及局部放大图见图3和图4。根据平衡液相组成及对应电导率、pH和密度数据绘制了物化参数-组分含量变化图,见图5。
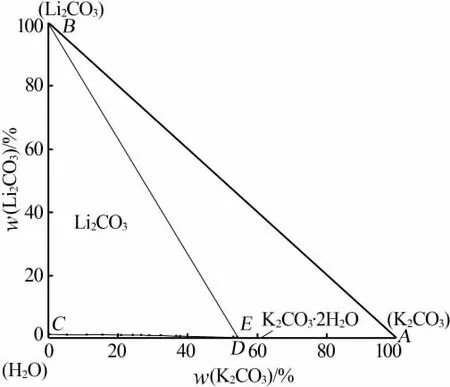
图3 三元体系Li+,K+/CO32--H2O 298.15 K稳定相图
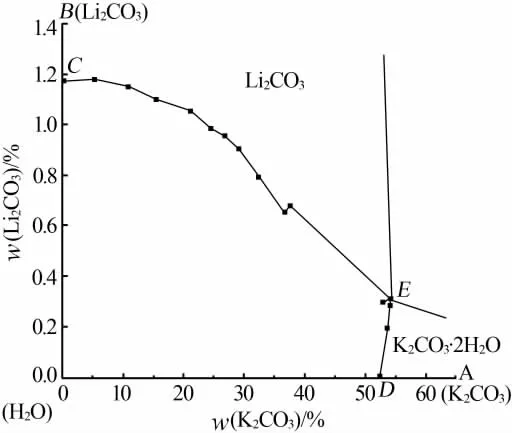
图4 三元体系Li+,K+/CO32--H2O 298.15 K稳定相图的局部放大图
表1、图3和图4表明,三元体系Li+,K+/CO32--H2O在298.15 K下的稳定相图属于简单共饱型,没有任何形式的复盐或固溶体出现,也未发生脱水作用。相图中的两条单变量溶解度曲线CE和ED分别对应单盐Li2CO3和K2CO3在298.15 K下的溶解度曲线,两个单盐结晶相区BCE和ADE分别表示单盐Li2CO3和K2CO3在298.15 K下的固相结晶区,且这两种盐在共饱点E处达到共饱平衡,形成的两种盐分别为Li2CO3和K2CO3·2H2O。此时在平衡液相的组成中Li2CO3占0.306 8%、K2CO3占54.219 0%。从图3和图4还可以看到,Li2CO3的结晶区明显偏大故其溶解度较小,而K2CO3的结晶区较小故其溶解度较大。随着K2CO3的不断加入平衡液相中Li2CO3的质量分数逐渐减小,但随着Li2CO3的不断加入平衡液相中K2CO3的质量分数反而略有增大,最后均稳定在共饱点E处,故可以认为K2CO3对Li2CO3有显著的盐析效应,而Li2CO3对K2CO3则有一定的盐溶效应。溶液中的盐析、盐溶作用是电解质溶液中各种组分之间微观离子相互作用的宏观外在表现,其过程可涉及电解质溶液理论中的多种作用如离子缔合、离子水化和离子互吸等。K2CO3的溶解度最大,一般会对溶液中其他离子产生盐析作用。研究表明,溶液中离子之间的静电作用是盐效应产生的主要原因[8],由此可以推断K2CO3与水分子由于静电作用而具强烈的缔合作用,使溶液中自由水减少,导致了盐析作用,使其他盐的溶解度大幅降低[9]。当然,今后还需要基于电解质溶液理论来进一步揭示和预测盐湖自然蒸发过程中的盐溶和盐析作用以及盐类矿物的结晶析盐规律,为盐湖资源的综合开发利用提供必要的基础数据[10]。
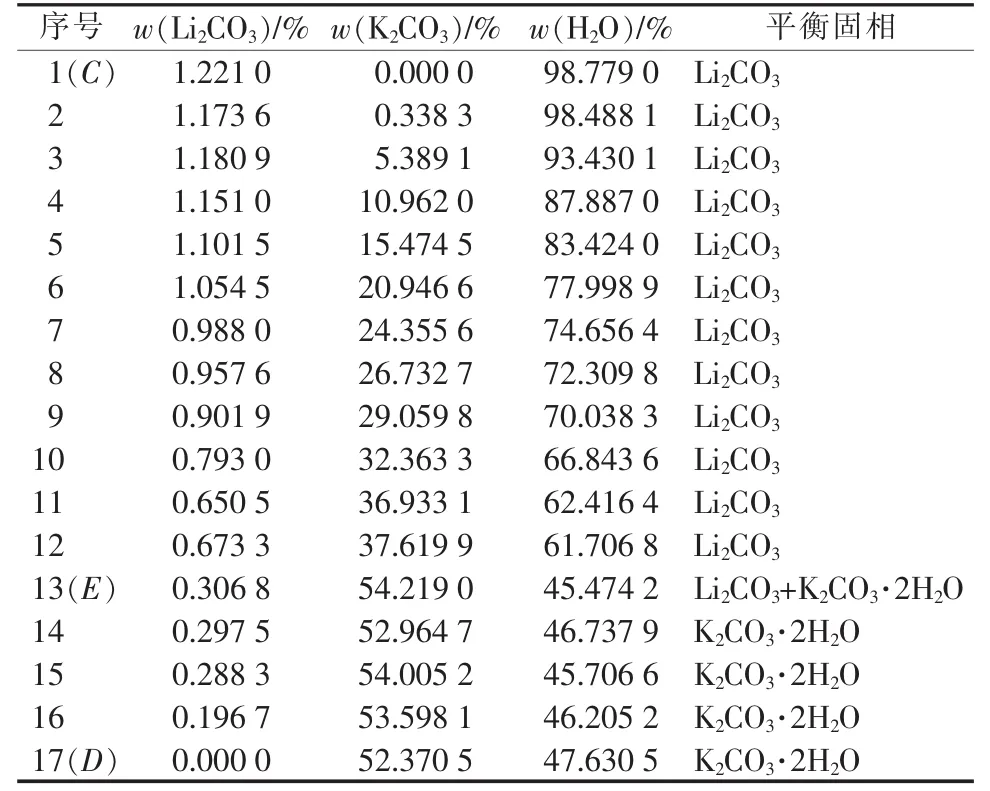
表1 三元体系Li+,K+/CO32--H2O 298.15 K溶解度数据
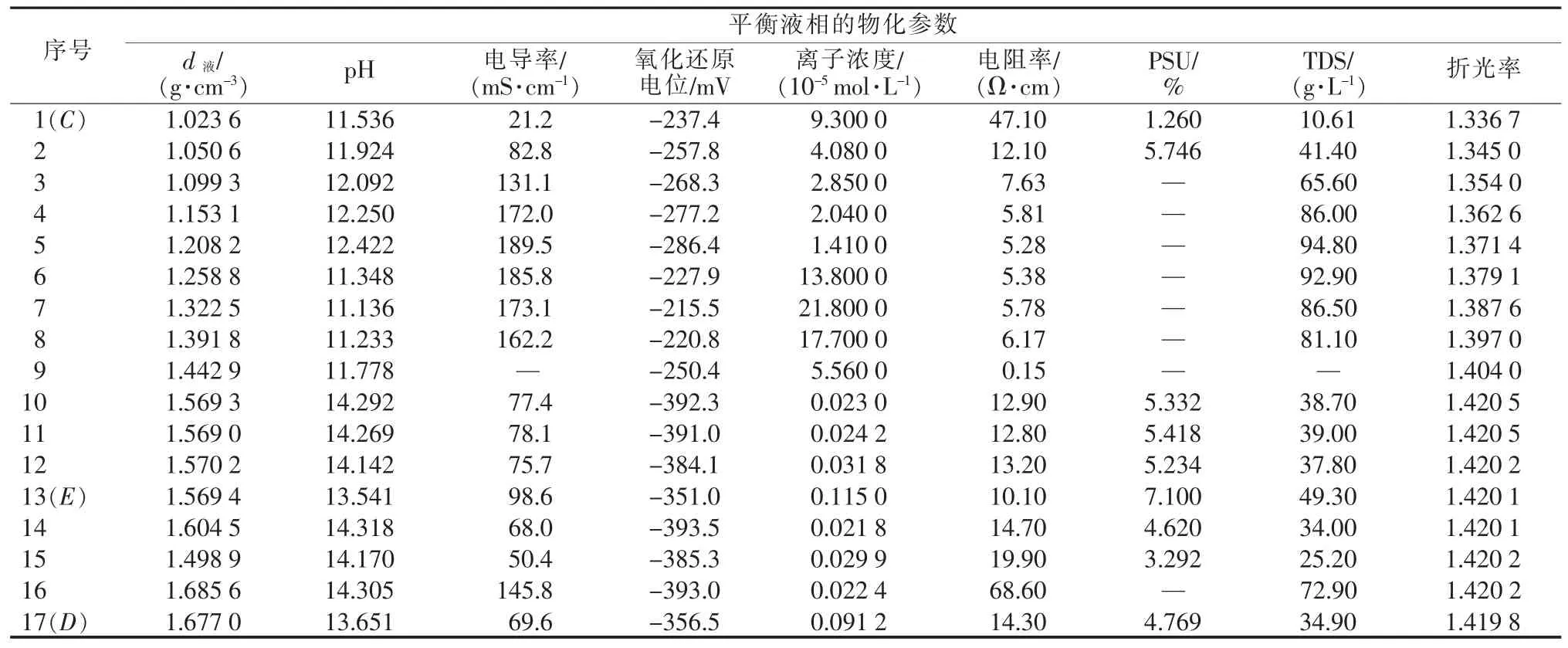
表2 三元体系Li+,K+/CO32--H2O 298.15 K平衡液相的物化参数
由于298.15 K下K2CO3的溶解度远大于Li2CO3的溶解度,因此平衡液相中K2CO3的含量是影响平衡液相物化性质的主要原因。三元体系Li+,K+/CO32--H2O在298.15 K下的物化参数随K2CO3含量的变化见图5。由图5可以看到,随着溶液中K2CO3含量的变化,平衡液相的密度和折光率呈现出相似的变化规律,即单变量曲线CE上对应的平衡液相的密度和折光率均随K2CO3含量的增加而不断增大,单变量曲线ED上对应的平衡液相的密度和折光率则随K2CO3含量的增加而略有减小,在共饱点E处附近达到最大值。平衡液相的pH在变化过程中则出现了几处特殊的拐点,即在K2CO3含量达到15.47%之前先缓慢增大,之后有所下降,直到K2CO3含量达到29.06%时又开始陡然升高,而后呈现不断降低并逐渐趋于平稳的趋势。采用磁力搅拌器法获得的溶解度数据相对平稳、波动幅度较小,整体数值较溶解度数据手册中的参考数据略低。
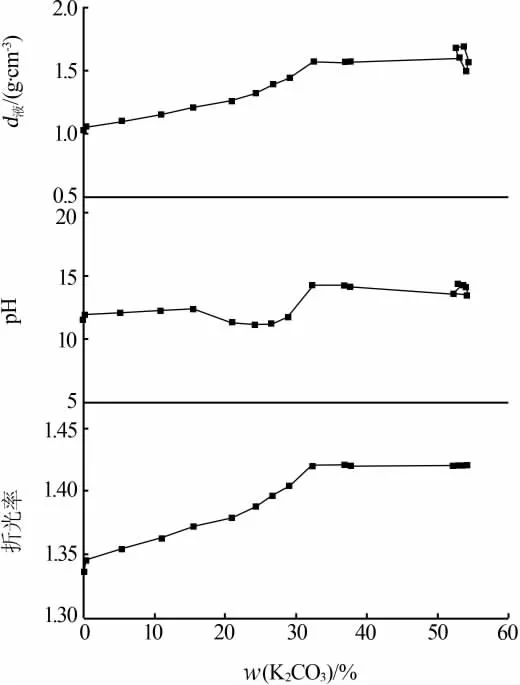
图5 平衡液相的物化参数(密度、pH、折光率)-K2CO3组分含量变化图
3 结论
1)采用等温溶解平衡法获得了三元体系Li+,K+/CO32--H2O在298.15 K下的溶解度数据以及平衡液相的密度、pH、折光率等物化参数。2)三元体系Li+,K+/CO32--H2O在298.15 K下的稳定相图属于简单共饱型,由1个共饱点、2条单变量溶解度曲线和2个单盐结晶区组成,既无复盐也无固溶体生成,也未发生脱水作用。3)K2CO3对Li2CO3有显著的盐析效应,而Li2CO3对K2CO3则有一定的盐溶效应。平衡液相的密度、折光率随溶液中K2CO3含量的增加均呈现先不断增大后逐渐减小的变化趋势。
致谢:实验过程中得到中国科学院青海盐湖研究所宋彭生研究员的指导和帮助,在此表示衷心的感谢!
参考文献:
