颅咽管瘤显微外科手术对患者血钠代谢紊乱影响及相关因素分析
2018-06-09周忠清张云馨
李 颖, 周忠清,张云馨
首都医科大学三博脑科医院1.重症监护室;2.神经外科八病区,北京 100010
颅咽管瘤(craniopharyngioma,CP)属于颅内最常见的先天性、原发性良性占位病变,但具有侵袭性,多发于儿童三脑室以下至鞍区膈以上部位,临床多采用手术治疗[1]。由于CP解剖结构复杂,不易完成手术全切,且术中易造成下丘脑-垂体柄-垂体轴结构功能损伤,从而导致下丘脑术后内分泌失调,抗利尿激素代谢紊乱,血容量不足、血压降低,血浆渗透压出现代偿性升高,同时,肾小球增加对水分的吸收,最终导致血钠代谢紊乱[2-3]。纠正水电解质紊乱,提高治疗效果,是神经外科医师术后必须面对又亟需解决的难题。目前,国内关于CP手术后血钠代谢紊乱发生规律及影响因素的研究较少。本研究对接受显微外科手术治疗的CP患者术后血钠代谢紊乱情况及影响因素进行分析,旨在为降低CP术后并发症发生率,提高治疗效果提供理论依据。现报道如下。
1 资料与方法
1.1 一般资料 选取自2013年12月至2017年6月接受显微手术切除的CP患者196例,根据颅咽管瘤QST外科分型[4]进行分组。其中,鞍膈下型(Q型)组35例,鞍上脑室底外型(S型)组39例,鞍上脑室底内型(T型)122例。Q型组患者男性17例,女性18例;平均年龄(41.08±9.76)岁;平均病程(16.74±7.31)个月;最大瘤体直径(2.99±0.82)cm。S型组患者男性21例,女性18例;平均年龄(40.82±6.98)岁;平均病程(17.15±9.42)个月;最大瘤体直径(3.26±0.97)cm。T型组患者男性67例,女性55例;平均年龄(42.13±7.24)岁;平均病程(16.49±7.88)个月;最大瘤体直径(3.31±1.15)cm。3组患者性别、年龄、病程及最大瘤体直径比较,差异均无统计学意义(P>0.05),具有可比性。纳入标准:(1)病理检查确诊为CP;(2)首次发病;(3)临床资料完整。排除标准:(1)合并有严重的肾功能不全者;(2)合并糖尿病、心肌梗死、冠心病、高血压等严重疾病者;(3)围术期死亡或严重颅内感染者;(4)长期服用利尿剂患者。
1.2 研究方法
1.2.1 术前检查 患者术前接受内分泌和电解质检查,并行头颅CT及磁共振检查确定肿瘤大小、发病部位。按照Yasargil分类法将CP肿瘤分为小型(直径<2 cm)、中型(2~4 cm)、大型(4~6 cm)及巨大型(直径>6 cm)。
1.2.2 显微外科手术 根据术前影像学检查、肿瘤类型及患者具体情况分别采用不同的手术路径,包括额纵裂、改良翼点、额底、经额部-胼胝体-透明隔4种入路方式。患者经气管插管+静吸复合麻醉后,尽量采取全切除(切除全部肿瘤及囊壁,术后经影像学复查未见肿瘤及钙化阴影)、次切除(切除95%以上肿瘤病灶)或大部分切除(切除60%~95%以上肿瘤病灶)。
1.2.3 术后观察 记录术后24 h尿量及每小时尿量;检测尿渗透压及尿钠含量;检测血渗透压及血钠含量,并对患者进行随访观察。
1.3 诊断标准 血钠代谢紊乱诊断[5]:(1)低血钠症,血钠<135 mmol/L(严重低血钠症,血钠<120 mmol/L);(2)高血钠症,血钠>150 mmol/L。
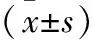
2 结果
2.1 患者术前及术后血钠紊乱情况比较 Q型组患者术前血钠紊乱发生率为31.4%(11/35),明显高于S型组的12.8%(5/39)及T型组的3.3%(4/122),且组间两两比较,差异均有统计学意义(P<0.05)。术后低血钠症发生率,Q型组为34.3%(12/35),T型组为43.4%(53/122),均高于S型组的15.4%(6/39),且组间两两比较,差异均有统计学意义(P<0.05)。术后高血钠症发生率,Q型组为8.6%(3/35),T型组为4.9%(6/122),均低于S型组的28.2%(11/39),且组间两两比较,差异均有统计学意义(P<0.05)。术后交替性血钠紊乱发生率,Q型组为22.9%(8/35),S型组为23.1%(9/39),均高于T型组的4.9%(6/122),差异有统计学意义(P<0.05)。见表1。
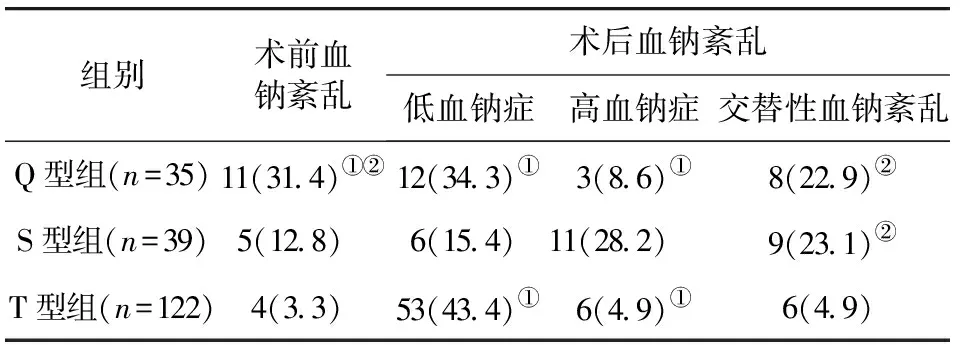
表1 患者术前及术后血钠紊乱情况比较/例(百分率/%)
注:与S型比较,①P<0.05;与T型比较,②P<0.05
2.2 术后14 d血钠紊乱发生情况分析 196例患者中,术后2 d血钠紊乱发生率最高;术后7~8 d时,血钠紊乱发生小高峰;最低血钠出现中位时间点为第8天。见图1。
2.3 术后血钠紊乱与临床特征相关性分析 单因素分析结果显示,术后血钠代谢紊乱发生与患者年龄、性别、QST肿瘤分型无明显相关性(P>0.05);与肿瘤体积、术前尿崩、术前血钠代谢紊乱发生情况呈相关性(P<0.05)。见表2。
2.4 术后血钠紊乱与手术因素相关性分析 单因素分析显示,术后血钠代谢紊乱发生与手术入路方式无明显相关性(P>0.05);与垂体柄保留情况及肿瘤切除程度呈相关性(P<0.05)。见表3。

图1 术后14 d血钠紊乱发生情况分析
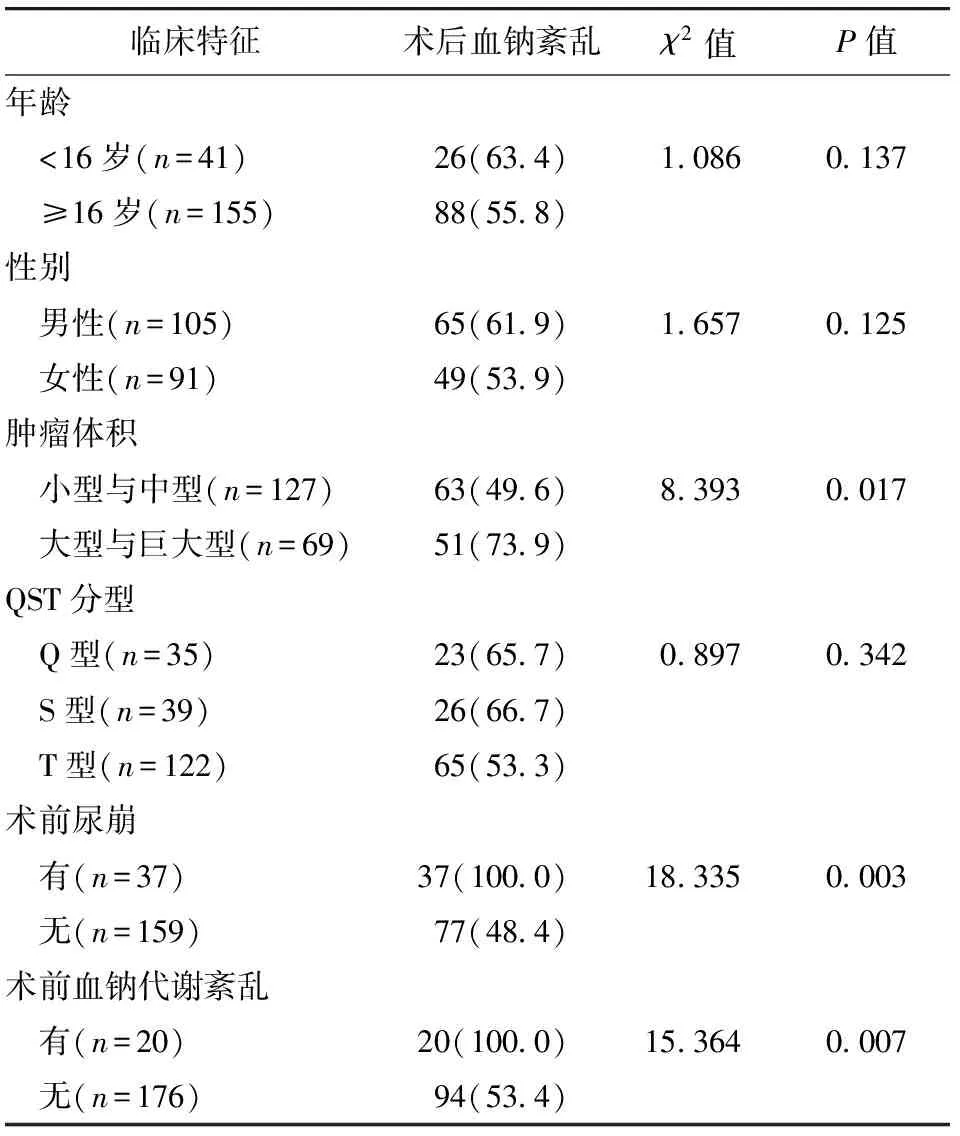
表2 术后血钠紊乱与临床特征相关性分析/例(百分率/%)
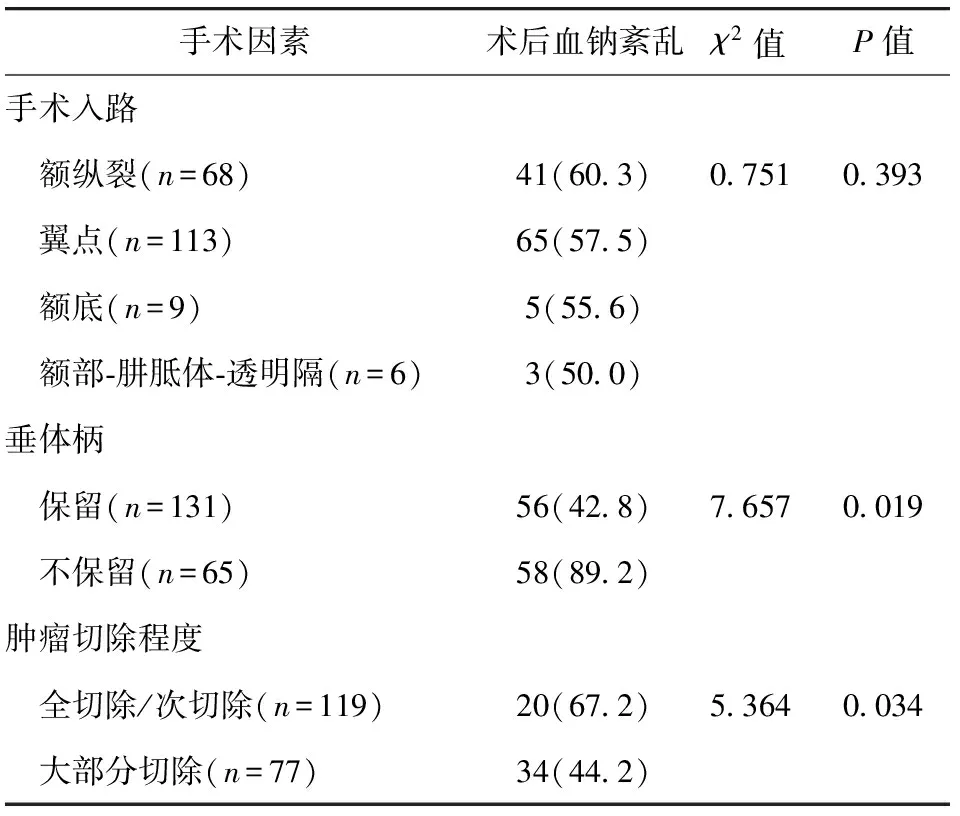
表3 术后血钠紊乱与手术因素相关性分析/例(百分率/%)
2.5 术后血钠紊乱多因素分析 对CP患者肿瘤体积、术前尿崩、术前血钠代谢紊乱、垂体柄保留情况及肿瘤切除程度进行Logistic多因素回归分析,结果显示,术前尿崩、术前血钠代谢紊乱、垂体柄保留情况及肿瘤切除程度为血钠代谢紊乱的独立危险因素(P<0.05)。见表4。
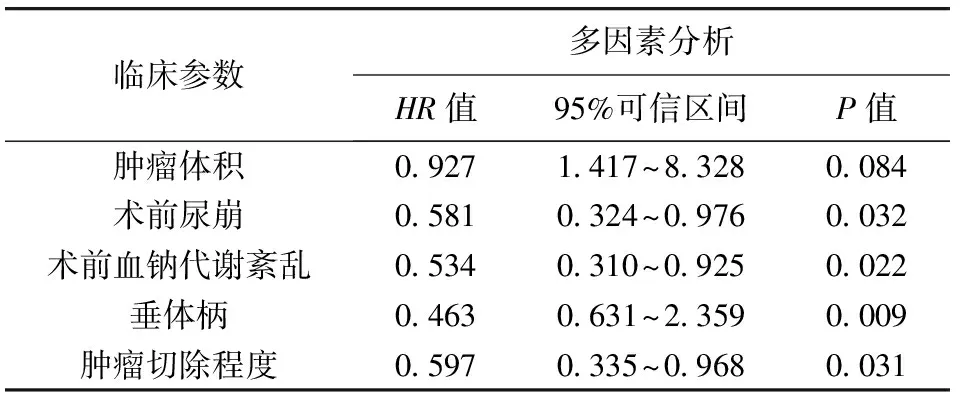
表4 术后血钠紊乱Logistic多因素回归分析
3 讨论
CP虽然属于良性肿瘤,但多发于下丘脑及垂体部位,对内分泌系统功能会产生一定影响。目前,外科手术治疗是临床上常选择的治疗手段,但由于CP发生部位解剖结构复杂,手术操作难度系数高,术中易损伤下丘脑、脑垂体及周围正常组织,从而导致术后内分泌失调和水电解质紊乱,影响患者预后及生活质量[6]。血钠代谢紊乱是CP患者术后常见并发症之一[7],探讨其发生规律及影响因素,对提高治疗效果、预防及降低术后并发症发生率都具有重要意义。
血钠代谢紊乱的发生机制与CP术后抗利尿激素水平波动有关[8]。一般在术后前3 d,因手术创伤影响,下丘脑、垂体组织水肿,抗利尿激素分泌受抑制,血钠水平会暂时性升高;而术后3~8 d,下丘脑、垂体组织水肿逐渐消失,抗利尿激素与尿量水平逐渐恢复,患者则会逐渐表现出低血钠症[9-10]。而后,多数患者血钠水平会慢慢恢复至正常,但也有部分患者发生永久性尿崩症[11]。目前,QST分型是我国临床上常使用的分型方法之一,在手术方案的确定及手术入路方式的选择方面具有重要的指导意义[4,12]。
本研究结果显示,3组患者术前血钠紊乱发生率及术后各种类型血钠紊乱发生率均存在不同程度的差异,这可能与不同分型肿瘤所处位置不同及周围组织结构差异有关。本研究通过分析CP患者术后血钠代谢紊乱的影响因素发现,术前尿崩、术前血钠代谢紊乱、垂体柄保留情况及肿瘤切除程度与CP患者术后发生血钠代谢紊乱呈相关性,是术后血钠代谢紊乱发生的独立危险因素。因此,术前明确肿瘤的大小、位置、影像学分型及周围组织的解剖结构,选择合理的手术入路和切除方式,并密切监测患者水电解质水平和激素水平,及时给予预防和纠正紊乱情况,对于降低术后血钠代谢紊乱发生率具有重要作用[13-15]。手术中尤其需注意保护三脑室腹前区与垂体柄,建议沿蛛网膜层分离肿瘤与下丘脑组织,并尽量减少电凝的使用频率,以免因温度过高损伤局部正常脑组织。
综上所述,CP术后血钠代谢紊乱发生率较高,临床医师应密切注意患者术后状态;术前尿崩、术前血钠代谢紊乱、垂体柄保留情况及肿瘤切除程度与CP患者术后发生血钠代谢紊乱密切相关,是术后血钠代谢紊乱发生的独立危险因素。
参考文献:
[1] Sughrue ME,Yang I,Kane AJ,et al.Endocrinologic,neurologic,and visual morbidity after treatment for craniopharyngioma[J].J Neurooncol,2011,101(3):463-476.
[2] Müller HL.Craniopharyngioma and hypothalamic injury:latest insights into consequent eating disorders and obesity[J].Curr Opin Endocrinol Diabetes Obes,2016,23(1):81-89.
[3] Daubenbüchel AM,Müller HL.Neuroendocrine disorders in pediatric craniopharyngioma patients[J].J Clin Med,2015,4(3):389-413.
[4] 中华医学会神经外科学分会小儿神经外科学组.颅咽管瘤治疗专家共识(2016)[J].中华医学杂志,2017,97(17):1283-1289.
[5] 刘卫东,黄光富,袁利民,等.颅咽管瘤切除术后的并发症处理[J].中华神经医学杂志,2006,5(3):285-287.
[6] Tosaka M,Sato K,Amanuma M,et al.Superficial siderosis of the central nervous system caused by hemorrhagic intraventricular craniopharyngioma:case report and literature review[J].Neurol Med Chir(Tokyo),2015,55(1):89-94.
[7] Zada G,Kintz N,Pulido M,et al.Prevalence of neurobehavioral,social,and emotional dysfunction in patients treated for childhood craniopharyngioma:a systematic literature review[J].PLoS One,2013,8(11):e76562.
[8] Coy S,Du Z,Sheu SH,et al.Distinct patterns of primary and motile cilia in Rathke's cleft cysts and craniopharyngioma subtypes[J].Mod Pathol,2016,29(12):1446-1459.
[9] Sterkenburg AS,Hoffmann A,Gebhardt U,et al.Survival,hypothalamic obesity,and neuropsychological/psychosocial status after childhood-onset craniopharyngioma:newly reported long-term outcomes[J].Neuro Oncol,2015,17(7):1029-1038.
[10] Park SW,Jung HW,Lee YA,et al.Tumor origin and growth pattern at diagnosis and surgical hypothalamic damage predict obesity in pediatric craniopharyngioma[J].J Neurooncol,2013,113(3):417-424.
[11] Martinez-Barbera JP,Andoniadou CL.Concise review:paracrine role of stem cells in pituitary tumors:a focus on adamantinomatous craniopharyngioma[J].Stem Cells,2016,34(2):268-276.
[12] Kundu S,Dewan K,Varshney H,et al.An atypical rare case of extracranial craniopharyngioma[J].Indian J Otolaryngol Head Neck Surg,2014,66(1):122-125.
[13] Qari FA,AbuDaood EA,Nasser TA.Diabetes insipidus following neurosurgery at a university hospital in Western Saudi Arabia[J].Saudi Med J,2016,37(2):156-160.
[14] Santra S,Chakraborty J,Das B.Cerebral salt wasting syndrome in craniopharyngioma[J].Indian J Anaesth,2013,57(4):404-405.
[15] Lubuulwa J,Lei T.Pathological and topographical classification of craniopharyngiomas:a literature review[J].J Neurol Surg Rep,2016,77(3):e121-e127.
(收稿日期:2018-01-08)
