低T3综合征对左心疾病相关肺动脉高压患者再住院及死亡的影响研究
2018-06-08聂美玲刘乐马涵英
聂美玲,刘乐,马涵英
低T3综合征是指既往无甲状腺疾病患者由于严重的全身性疾病引起循环甲状腺激素水平发生异常改变,包括游离三碘甲状腺原氨酸(FT3)/三碘甲状腺原氨酸(T3)水平减低,反三碘甲状腺原氨酸(rT3)水平升高,促甲状腺激素(TSH)水平正常或轻度减低[1]。这种异常改变在严重感染、烧伤、恶性肿瘤、体外循环手术中均可发生,并普遍认为与病情严重程度相关,提示预后不良[2-5]。
肺动脉高压是一种以肺循环血流受限,肺血管阻力进行性增高,最终导致右心衰竭及死亡的严重疾病[6]。左心疾病相关肺动脉高压(PH-LHD)为其中最常见的类型,预后极差[7],因此发现影响PH-LHD预后不良的危险因素,及时采取适当治疗,对改善患者预后有重要意义。已有研究发现合并低T3综合征的心血管疾病患者常预后更差[8-9],但就低T3综合征对PH-LHD预后影响尚不十分清楚。本研究纳入154例PH-LHD患者行回顾性研究,探讨低T3综合征预测PH-LHD患者再住院及死亡的价值,以探讨低T3综合征对PH-LHD患者预后的影响,为临床治疗提供参考。
1 资料与方法
1.1 研究对象 选取2015年首都医科大学附属北京安贞医院收治的154例PH-LHD患者,其中男74例(48.0%),女80例(52.0%);年龄50~69岁,平均年龄(59.2±13.9)岁。根据患者入院后首次测得FT3水平分为低 T3综合征组[1]〔FT3<3.800 pmol/L,TSH正常或减低(参考范围:0.340~5.600 mU/L),n=41〕及甲状腺功能正常组〔FT3(参考范围:3.800~6.000 nmol/L)、游离甲状腺素(FT4)(参考范围:7.900~14.400 nmol/L)、TSH均在正常范围,n=113〕。
1.2 PH-LHD诊断标准 (1)静息状态下经胸超声心动图测得肺动脉收缩压(SPAP)>40 mm Hg(1 mm Hg=0.133 kPa)[10]。(2)符合2015欧洲心脏病学会(ESC)/欧洲呼吸学会(ERS)指南[7]中PH-LHD临床分类。同时符合以上两点诊断为PH-LHD。
1.3 排除标准 (1)甲状腺原发疾病病史;(2)胺碘酮治疗史;(3)特发性肺动脉高压;(4)慢性阻塞性肺疾病;(5)结缔组织病;(6)慢性血栓栓塞性疾病病史;(7)恶性肿瘤病史;(8)妊娠;(9)临床资料不完整。
1.4 研究方法
1.4.1 基本信息收集 记录患者性别、年龄、身高、体质量、吸烟史、入院24 h纽约心脏病协会(NYHA)分级、入院后首次超声心动图测得SPAP值(SPAP>70 mm Hg为重度肺动脉高压[11])及左室射血分数(LVEF)、住院期间是否行心脏瓣膜手术、既往病史(冠心病、风湿性心脏病、扩张型心肌病、高血压、2型糖尿病、心房颤动/心房扑动)。体质指数(BMI)=体质量(kg)/身高2(m2),其中 BMI<18.5 kg/m2为体质量减轻[12]。
1.4.2 实验室数据采集 记录患者入院后首次甲状腺功能,包括FT3、FT4、TSH,收集脑钠肽(BNP)、血清清蛋白(ALB)、血红蛋白(Hb)、红细胞分布宽度(RDW-CV)、超敏C反应蛋白(hs-CRP)等实验室检查结果。根据公式:估算肾小球滤过率(eGFR)〔ml·min-1·(1.73 m2)-1〕=186×Scr(mg/dl)-1.154× 年龄-0.203×0.742(女性),计算eGFR,其中eGFR<90 ml·min-1·(1.73 m2)-1为 eGFR 减低。
1.4.3 随访及定义 于2017年1月对患者进行电话随访,并获得患者及其亲属知情同意,记录患者出院后到随访日期的再住院及死亡情况。
1.5 统计学方法 采用SPSS 22.0软件进行统计学分析,计量资料以(x ±s)表示,两组间比较采用t检验;计数资料的分析采用χ2检验;采用Kaplan-Meier方法绘制两组患者再住院及死亡曲线,Log-rank检验比较两组患者再住院及死亡情况;采用单因素及多因素Cox比例风险回归模型分析患者死亡的影响因素;利用受试者工作特征(ROC)曲线分析血清FT3及BNP预测患者预后的价值,DeLong检验比较两组ROC曲线下面积(AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 甲状腺功能正常组和低T3综合征组性别、年龄、BMI<18.5 kg/m2、NYHA分级、重度肺动脉高压、冠心病、风湿性心脏病、扩张型心肌病、2型 糖 尿 病、Hb、eGFR<90 ml·min-1·(1.73 m2)-1所占比例比较,差异均无统计学意义(P<0.05);两组吸烟史、LVEF<45%、心脏瓣膜手术、高血压、心房颤动/心房 扑 动、BNP>400 ng/L、ALB、RDW-CV、hs-CRP>5 mg/L所占比例比较,差异均有统计学意义(P<0.05,见表1)。
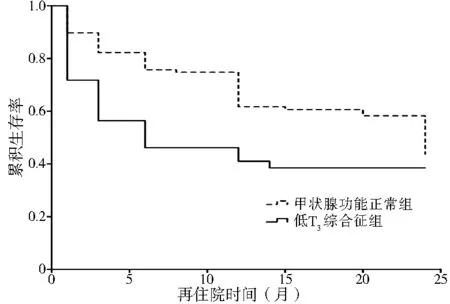
图1 两组再住院率比较Figure 1 Comparison of re-hospitalization rate between the low T3 syndrome group and normal thyroid function group
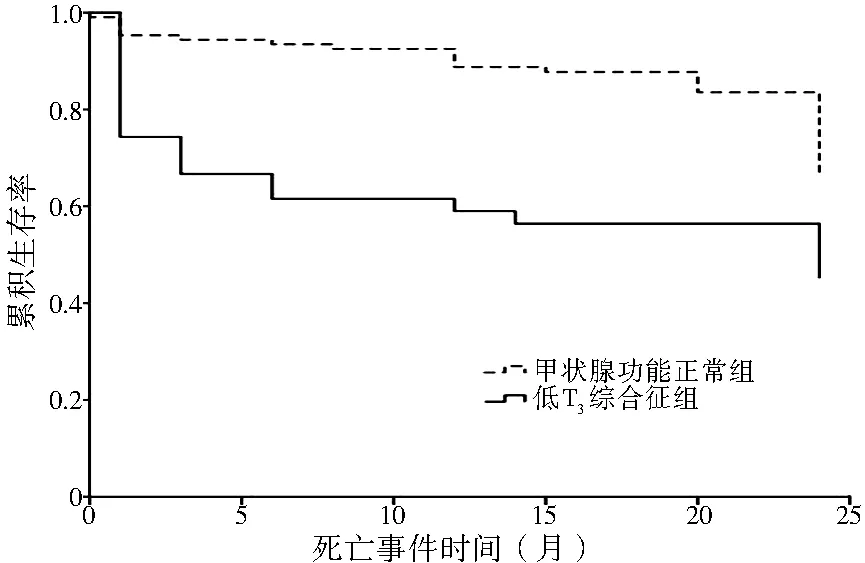
图2 两组死亡率比较Figure 2 Comparison of the mortality between the low T3 syndrome group and normal thyroid function group

表1 低T3综合征组与甲状腺功能正常组临床基线资料比较Table 1 Comparison of the baseline characteristics between low T3 syndrome group and normal thyroid function group
2.2 患者出院后再住院和死亡情况 154例患者中,由于电话变更,共失访8例(5.2%),其中低T3综合征组失访2例(4.9%),甲状腺功能正常组失访6例(5.3%),两组失访率比较,差异无统计学意义(χ2=0.011,P>0.05)。146例患者中,68例(46.6%)患者再住院,35例(24.0%)患者死亡,其中低T3综合征组再住院24例(61.5%),死亡18例(46.2%);甲状腺功能正常组再住院44例(41.1%),死亡17例(15.9%),低T3综合征组再住院率及死亡率均高于甲状腺功能正常组,差异有统计学意义(χ2=7.283,P=0.01;χ2=15.288,P<0.01,见图1、2)。
2.3 Cox比例风险回归模型分析 以PH-LHD患者是否死亡为因变量(赋值:是=1,否=0),以临床有意义变量作为自变量〔年龄、吸烟史(赋值:是=1,否=0)、重度肺动脉高压(赋值:是=1,否=0)、LVEF<45%(赋值:是=1,否=0)、心脏瓣膜手术(赋值:是=1,否=0)、心房颤动/心房扑动(赋值:是=1,否=0)、高血压(赋值:是=1,否=0)、BNP>400 ng/L(赋值:是=1,否=0)、ALB、RDW-CV、hs-CRP>5 mg/L(赋值:是=1,否=0)、低T3综合征(赋值:是=1,否=0)〕进行单因素及多因素Cox比例风险回归模型分析,结果显示,BNP>400 ng/L和低T3综合征是PH-LHD患者死亡的独立危险因素(见表2、3)。低T3综合征与PH-LHD患者出院后再住院无明显相关性〔HR=0.849,95%CI(0.441,1.637),P=0.625〕。

表2 LH-PHD患者出院后死亡事件发生影响因素的单因素Cox比例风险回归模型分析Table 2 Univariate Cox regression analyses of risk factors associated with mortality among PH-LHD patients

表3 LH-PHD患者出院后死亡事件发生影响因素的多因素Cox比例风险回归模型分析Table 3 Multivariate Cox regression analyses of risk factors associated with mortality among PH-LHD patients

图3 FT3及BNP对PH-LHD患者死亡率预测的ROC曲线Figure 3 ROC curves for FT3 and BNP for predicting the mortality of PHLHD patients
2.4 ROC曲线分析 血清FT3预测LH-PHD患者死亡的 AUC为 0.759〔95%CI(0.664,0.854)〕,最佳临界值为FT3<4.195 pmol/L;BNP预测患者死亡的AUC为 0.800〔95%CI(0.710,0.891)〕,最佳临界值为BNP>600 ng/L。DeLong检验结果显示,两者AUC比较,差异无统计学意义(Z=0.693,P=0.488,见图3)。
3 讨论
肺动脉高压是一种以肺血管阻力进行性升高为特征,最终导致患者右心衰竭的致死性疾病,PH-LHD作为最常见的PH类型,具有患病率高、预后差等特点[13]。已有大量研究发现,低T3综合征在心血管疾病患者中普遍存在,与全因死亡及心源性死亡风险独立相关[8-9]。PH-LHD作为一种高发病率和高病死率的心血管疾病,患者是否合并甲状腺激素浓度异常改变,以及低T3综合征对患者预后有提示作用的相关研究甚少。因此探讨低T3综合征与PH-LHD患者预后的关系,对发现临床死亡高危的肺动脉高压患者,早期强化治疗,对于改善预后具有重要临床意义。
本研究结果显示,PH-LHD患者低T3综合征发病率为26.6%,与血清ALB降低、hs-CPR升高、BNP升高、LVEF降低有关,且低T3综合征组死亡率及再住院率明显升高,与既往研究结果[14-16]基本一致。既往研究普遍认为低T3综合征与高龄有关[17],本研究中低T3综合征组平均年龄高于甲状腺功能正常组,但差异不显著,可能与PH-LHD患者普遍年龄偏大,年龄差异不大有关。本研究中低T3综合征组高血压患病率高于甲状腺功能正常组,可能是高血压增加PH-LHD患者左室后负荷,进一步加重心功能恶化,间接导致低T3综合征的发生。本研究中低T3综合征组患者住院期间心脏瓣膜手术率低于甲状腺功能正常组,可能与低T3综合征组患者心功能水平、营养状况等一般情况较差,不能耐受手术有关。本研究中低T3综合征组心房颤动/心房扑动发病率低于甲状腺功能正常组,可能与本研究排除了部分使用胺碘酮治疗的心房颤动/心房扑动患者有关。
WANG等[18]认为合并低T3综合征的心血管疾病患者全因死亡及心源性死亡风险增加,推荐心血管疾病患者监测甲状腺功能水平变化。本研究结果发现血清BNP水平升高及低T3综合征是PH-LHD患者出院后死亡的独立危险因素,低T3综合征与PH-LHD患者出院后再住院率则无明显相关性。甲状腺激素在调节生长发育、物质及能量代谢方面起重要作用,T3对心肌细胞有活性作用,与心肌细胞特殊核受体结合,调节肌钙蛋白结构及相关调节基因,增强心肌收缩力[19],增加肌浆网Ca2+-ATP酶水平,促进心肌舒张[20],同时T3能够松弛血管平滑肌,增强内皮功能,从而降低血管阻力[21]。因此,当血清FT3水平降低,心脏收缩功能减退,心脏射血分数降低,血管阻力增加,从而进一步加重PHLHD患者病情,影响预后。另一方面,既往研究发现低T3综合征时血清白介素6(IL-6)升高[22],动物实验证实IL-6可上调血管内皮生长因子,促进血管平滑肌细胞增殖,肺动脉壁增厚,远端小动脉肌化,肺血管重构,血管阻力增加,促进肺动脉高压进展,均可能是低T3综合征提示PH-LHD患者预后不良的机制[23]。现代研究认为BNP水平升高提示心功能恶化,是心血管疾病患者死亡的独立危险因素[24],本研究结果与既往研究结果一致。
SZWEJKOWSKI等[25]研究发现心力衰竭患者SPAP≥48 mm Hg发生死亡、心脏移植的风险将提高3倍,本研究中低T3综合征组重度肺动脉高压(SPAP>70 mm Hg)患者所占比例高于甲状腺功能正常组,但Cox回归分析中重度肺动脉高压与患者预后无明显相关,可能与本研究中重度肺动脉高压患者较少有关,不能就此认为肺动脉压力水平升高与PH-LHD患者预后无关。ROC曲线分析显示,FT3及BNP AUC分别为0.759及0.800,应用DeLong检验两者AUC比较无明显差异,表明血清FT3水平与血清BNP均可较好地提示预后。预测出院后死亡事件的FT3最佳临界值为FT3<4.195 pmol/L,提示PH-LHD患者甲状腺激素水平偏低,即便处于正常范围,仍提示预后不良,应重视甲状腺激素水平监测,以便及早发现危重患者,提高预后。
对低T3综合征患者是否进行干预仍存在争议。CUROTTO GRASIOSI等[26]研究发现补充甲状腺激素可改善心功能水平。CHOI等[5]则认为预防性口服T3替代治疗虽然可以降低低T3综合征发生率,但预后无明显改善。目前对低T3综合征使用甲状腺激素替代治疗尚无专家共识及指南推荐,需要有足够说服力的研究证明积极处理低T3综合征是否会提高患者预后。
低T3综合征是PH-LHD患者死亡的独立危险因素之一,监测血清甲状腺激素水平能较好地预测PH-LHD患者出院后死亡率。甲状腺功能作为临床上简便易行的实验室检查,常规检测T3及FT3水平对PH-LHD患者进行危险分层及预后判断具有重要意义。但对低T3综合征是否进行干预尚仍存在争议。本研究为单中心研究,样本量相对不足;未将随访期间甲状腺激素水平的改变纳入分析,甲状腺激素水平是动态变化的,未来研究应连续监测甲状腺激素水平以弥补不足。
本文无利益冲突。
[1]KRYSIAK R,KEDZIA A,KOWALCZE K,et al.Euthyroid sick syndrome:an important clinical problem[J].Wiad Lek,2017,70(2 pt 2):376-385.
[2]BOELEN A,KWAKKEL J,FLIERS E.Beyond low plasma T3:local thyroid hormone metabolism during inflammation and infection[J].Endocr Rev,2011,32(5):670-693.
[3]GANGEMI E N,GARINO F,BERCHIALLA P,et al.Low triiodothyronine serum levels as a predictor of poor prognosis in burn patients[J].Burns,2008,34(6):817-824.DOI:10.1016/j.burns.2007.10.002.
[4]GAO R,LIANG J H,WANG L,et al.Low T3syndrome is a strong prognostic predictor in diffuse large B cell lymphoma[J].Br J Haematol,2017,177(1):95-105.DOI:10.1111/bjh.14528.
[5]CHOI Y S,SHIM J K,SONG J W,et al.Efficacy of perioperative oral triiodothyronine replacement therapy in patients undergoing off-pump coronary artery bypass grafting[J].J Cardiothorac Vasc Anesth,2013,27(6):1218-1223.DOI:10.1053/j.jvca.2013.01.027.
[6]MCLAUGHLIN V V,ARCHER S L,BADESCH D B,et al.ACCF/AHA 2009 expert consensus document on pulmonary hypertension:a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association:developed in collaboration with the American College of Chest Physicians,American Thoracic Society,Inc.,and the Pulmonary Hypertension Association[J].Circulation,2009,119(16):2250-2294.DOI:10.1161/CIR CULATIONAHA.109.192230.
[7]GALIE N,HUMBERT M,VACHIERY J L,et al.2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension:the Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology(ESC) and the European Respiratory Society(ERS):Endorsed by:Association for European Paediatric and Congenital Cardiology(AEPC),International Society for Heart and Lung Transplantation(ISHLT)[J].Eur Heart J,2016,37(1):67-119.DOI:10.1093/eurheartj/ehv317.
[8]ROTHBERGER G D,GADHVI S,MICHELAKIS N,et al.Usefulness of serum triiodothyronine(T3) to predict outcomes in patients hospitalized with acute heart failure[J].Am J Cardiol,2017,119(4):599-603.DOI:10.1016/j.amjcard.2016.10.045.
[9]ÖZCAN K S,OSMONOV D,TOPRAK E,et al.Sick euthyroid syndrome is associated with poor prognosis in patients with ST segment elevation myocardial infarction undergoing primary percutaneous intervention[J].Cardiol J,2014,21(3):238-244.DOI:10.5603/CJ.a2013.0108.
[10]MCQUILAN B M,PICARD M H,LEAIVTT M,et al.Clinical correlates and reference intervals for pulmonary artery systolic pressure among echocardiographiclally normal subjects[J].Circulation,2001,104(23):2797-2802.
[11]杨娅,房芳,李嵘娟,等.超声掌中宝心血管系统[M].北京:科学技术文献出版社,2017:209.
[12]中华医学会内分泌学分会肥胖学组.中国成人肥胖症防治专家共识[J].中华内分泌代谢杂志,2011,27(9):711-717.DOI:10.3760/cma.j.issn.1000-6699.2011.09.003.Obesity Group,Department of Endocrinology,Chinese Medical Association.An expert consensus on the prevention and control of adult obesity in China[J].Chinese Journal of Endocrinology and Metabolism,2011,27(9):711-717.DOI:10.3760/cma.j.issn.1000-6699.2011.09.003.
[13]GUAZZI M,BORLAUG B A.Pulmonary hypertension due to left heart disease[J].Circulation,2012,126(8):975-990.
[14]DE ALFIERI W,NISTICÒ F,BORGOGNI T,et al.Thyroid hormones as predictors of short- and long-term mortality in very old hospitalized patients[J].J Gerontol A Biol Sci Med Sci,2013,68(9):1122-1128.DOI:10.1093/gerona/glt012.
[15]BOELEN A,VAN BEEREN M,VOS X,et al.Leptin administration restores the fasting-induced increase of hepatic type 3 deiodinase expression in mice[J].Thyroid,2012,22(2):192-199.DOI:10.1089/thy.2011.0289.
[16]DE VRIES E M,KWAKKEL J,EGGELS L,et al.NFκB signaling is essential for the lipopolysaccharide-induced increase of type 2 deiodinase in tanycytes[J].Endocrinology,2014,155(5):2000-2008.DOI:10.1210/en.2013-2018.
[17]董燕,乔莉,龚晨,等.年龄与老年人低T3综合征的相关性[J].中国老年学杂志,2016,36(20):5011-5013.DOI:10.3969/j.issn.1005-9202.2016.20.031.DONG Y,QIAO L,GONG C,et al.The relationship between age and low T3syndrome in the elderly people[J].Chinese Journal of Gerontology,2016,36(20):5011-5013.DOI:10.3969/j.issn.1005-9202.2016.20.031.
[18]WANG B,LIU S,LI L,et al.Non-thyroidal illness syndrome in patients with cardiovascular diseases:a systematic review and meta-analysis[J].Int J Cardiol,2017,226:1-10.DOI:10.1016/j.ijcard.2016.10.039.
[19]WANG W,GUAN H,GERDES A M,et al.Thyroid status,cardiac function,and mortality in patients with idiopathic dilated cardiomyopathy[J].J Clin Endocrinol Metab,2015,100(8):3210-3218.DOI:10.1210/jc.2014-4159.
[20]JISKRA J.Hypothyroidism in patients with heart disease[J].Vnitr Lek,2017,63(9):566-571.
[21]NAPOLI R,GUARDASOLE V,ANGELINI V,et al.Acute effects of triiodothyronine on endothelial function in human subjects[J].J Clin Endocrinol Metab,2007,92(1):250-254.DOI:10.1210/jc.2006-1552.
[22]ZYGNER W,GÓJSKA-ZYGNER O,BASKA P,et al.Low T3syndrome in canine babesiosis associated with increased serum IL-6 concentration and azotaemia[J].Vet Parasitol,2015,211(1/2):23-27.DOI:10.1016/j.vetpar.2015.04.023.
[23]FURUYA Y,SATOH T,KUWANA M.Interleukin-6 as a potential therapeutic target for pulmonary arterial hypertension[J].Int J Rheumatol,2010,2010:720305.DOI:10.1155/2010/720305.
[24]MIRSAEIDI M,OMAR H R,BAUGHMAN R,et al.The association between BNP,6MWD test,DLCO% and pulmonary hypertension in sarcoidosis[J].Sarcoidosis Vasc Diffuse Lung Dis,2016,33(4):317-320.
[25]SZWEJKOWSKI B R,ELDER D H,SHEARER F,et al.
