血管生成素-1对猪慢性缺血心肌中功能性 新生血管增生的促进作用
2018-06-07WinstonNgShimEugeneKwangweiSim
李 伟 Winston Ng Shim Eugene Kwangwei Sim△
(1上海市胸科医院心脏外科 上海 200030; 2徐州市中心医院心脏外科 徐州 221009;3新加坡国立大学医院心胸血管外科 新加坡 119077)
缺血性心脏病是严重危害人类健康的主要公共卫生问题之一。部分慢性心肌缺血患者尽管接受了药物或其他再血管化手段的治疗,但其症状仍不能得到有效解除。而一些患有严重的、弥漫性的冠状动脉病变的患者并不适合经皮冠状动脉成形术或冠状动脉旁路手术,其心肌缺血症状严重地影响生活质量。治疗性血管再生可以补充传统再血管化治疗的不足,使那些不适合接受传统再血管化治疗的患者获得心肌再血管化的机会。
血管生成素-1(angiopoietin-1,ANG-1)作为内皮细胞特异性的TIE-2 酪氨酸受体激酶的激动剂配体被首先发现,随后相继发现ANG-2 和ANG-4等其他家族成员。ANG-1在胚胎期心脏发育过程中的重要作用已被证实[1]。然而,其在缺血心肌血管再生中的作用尚未阐明。本研究通过考察缺血心肌中新生血管的形成和心肌血液灌注改善等方面,以了解由腺病毒介导的ANG-1和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)基因转移在猪慢性心肌缺血模型中促进血管再生的远期治疗作用。
材 料 和 方 法
复制缺陷腺病毒载体的构建携带ANG-1、VEGF及空白基因的载体通过E1、E3联合缺失的复制缺陷型5型腺病毒构建 (加拿大Microbix Biosystems公司)。基因转移(或空白基因)由人类巨细胞病毒早期启动子/增强剂介导。构建的腺病毒在人胚胎肾-293细胞中增殖和纯化[5]。腺病毒感染使用前,病毒颗粒的浓度通过分光光度计(美国Thermo Fisher Scientific公司)在260 nm波长条件下确定,并应用极限稀释法测定人胚胎肾细胞HEK293中病毒的感染滴度(PFU,集落形成单位)[2]。
猪慢性心肌缺血模型的建立和AdANG-1、AdVEGF基因转移全身麻醉、气管内插管完成后,将实验动物猪(Yorkshire猪,体重30~35 kg)取右侧卧位,并维持循环稳定。经左前第4肋间小切口进胸、打开心包,显露左心室游离壁。钝、锐结合游离冠状动脉回旋支近段。将内径2.0~2.5 mm的Ameroid血管压缩环 (美国Research Instruments SW公司) 套绕在回旋支近段,关闭切口,完成建立慢性心肌缺血模型的手术。
4周后第2次开胸手术,在回旋支动脉分布的慢性缺血心肌区域注射承载不同转基因的腺病毒溶液。心肌注射时用直径0.45 mm的注射针头,注射深度3~4 mm,每个心脏模型行10个部位的心肌内注射,每个注射部位每次注射0.1 mL含不同转基因的腺病毒溶液(共含约1×1010PFU的重组腺病毒)。并在每个注射部位附近以7-0聚丙烯缝线作标记以利于切取心肌标本时能够准确定位。根据转移基因的不同,将所有26只猪分为3组:AdANG-1组(n=9)、AdVEGF组(n=10) 和空载体对照组(n=7)。前2组中的腺病毒分别承载ANG-1、VEGF基因,空载体对照组的腺病毒不含转移基因。另取6只未行慢性心肌缺血手术的健康猪作为正常对照组。

免疫组织化学分析基因移植12周后将动物处死并用4%的甲醛溶液灌注固定心脏。全层切取3 cm×1 cm左心室前侧壁心肌组织块并以石蜡包埋,制作厚度为5μm的心肌石蜡切片以备免疫组化染色。切片经0.05% 蛋白酶 (美国Sigma-Aldrich公司),3%过氧化氢和5%羊血清处理后,分别用抗-von Willebrand factor (vWF)抗体(丹麦DakoCytomation公司)和抗-平滑肌肌动蛋白(smooth muscle actin,SMA)抗体(美国Sigma公司) 对内皮细胞和平滑肌细胞染色,与抗-人ANG-1抗体(美国USBiological公司)或抗-人VEGF抗体(美国NeoMarkers公司)在4 ℃条件下过夜培养。
形态学分析和微血管密度检测基因移植后12周,微血管的增生情况通过计数缺血心肌中vWF染色的微血管密度来评估。管腔清晰可见、直径小于20 μm的微血管对ANG-1和VEGF的刺激具有良好的反应性,计为染色阳性。
SMA染色阳性的小动脉按管腔直径(Lumen diameter,LD)大小分为较大(50 μm 基因表达的RT-PCR分析缺血心肌样本的ANG-1和VEGF基因表达通过逆转录聚合酶链反应(RT-PCR)检测 (实验结束时从各个实验动物组中随机抽样3只)。实验动物在基因移植后1、 3、4周处死,采集缺血心肌样本,去除多余脂肪组织,放置于冷PBS溶液。RNA样品用TRI 试剂 (美国Molecular Research Center公司)抽提。RT-PCR反应参数为:94 ℃、30 s,57 ℃、60 s,72 ℃、60 s,共35个循环。ANG-1基因特异性和载体特异性的引物为5’-CGGTGAATATTGGCTGGGGAATGA-G-3’和5’-CCATTATAAGCTGCAATAAACAA-G-3’,VEGF基因特异性和载体特异性的引物为5’-GATCCAGCCTGGGGATCAGTCTTCG-3’和5’-CCATTATAAGCTGCAATAAACAAG-3’。 腺病毒介导的基因转移注射部位产生轻微的炎症反应在Ameriod血管压缩环近端回旋支动脉周围的心肌组织中观察到了纤维组织增生,但所有实验动物注射部位的心肌中均未发现心肌梗塞或活动性炎症。 和正常对照组(1.56±0.07)相比,AdANG-1组促血管生成效应明显,导致左心室心肌灌注(3.25±0.16,P<0.001)迅速在手术4周之后恢复。在手术12周之后,AdANG-1组持续保持了左心室心肌灌注增强的效果(2.77±0.28,P<0.05,图2)。形成鲜明对比的是,Ad-VEGF组和空载体对照组在手术后4周仍然保持缺血状态。手术后12周,这两组试验动物的左心室心肌灌注和正常对照组保持一致。 There was no significant difference in the depressed regional perfusion among animal groups before initiation of treatment.vs.Healthy animals,(1)P<0.005,(2)P<0.001. 图1Ameroid血管压缩环放置4周后各组实验动物心肌缺血区血流量与健康对照组的对比 和空载体对照组相比,AdVEGF组在4周(1.09±0.13vs. 1.20±0.03,P=0.905) 和 12周(1.86±0.69vs.1.32±0.04,P=0.715) 局部血流均无明显差异,而AdANG-1组心肌灌注明显增加,4周时P<0.001,12周时P<0.05 (图2)。 The therapeutic effect of ANG-1 was sustainable with continuous elevated ventricular perfusion in the left circumflex territory.vs.Healthy animals,(1)P<0.05,(2)P<0.001. 图2基因治疗后4周和12周时各组左室缺血心肌的局部血流量对比 ANG-1促进血管再生并增强缺血心肌的毛细血管前小动脉的形成石蜡包埋的切片经抗vWF抗体和抗SMA抗体免疫组化染色,血管组织表型正常,无血管瘤样结构出现,并且大部分血管结构由直径小于20 μm的血管组成(图3A)。相比于空载体对照组(13.53±0.92),AdANG-1组 (19.61±1.76,P<0.05)和AdVEGF 组(18.17±1.43,P<0.05)左心室微血管密度(计数/0.572 mm2心肌组织)都明显增加(图3B)。 A:AdANG-1 and AdVEGF treated myocardium showed enhanced neovascularization with increase VWF positive vessels.Arrows indicated positively stained microvessels.Scale bar:100 lm.B:ANG-1 and VEGF significantly increased microvascular density in the left ventricle free wall.Microvascular density was computed based on microvessels with lumen sizes less than 20 lm.vs.Healthy animals,(1)P<0.01. 图3各组动物左室缺血区微血管密度的对比 直径20~50 μm的毛细血管前小动脉数量(小动脉/0.572 mm2心肌组织)在各治疗组中均无明显差异,但AdANG-1组与正常对照组相比,数量显著增多(P<0.001)。直径50~100 μm毛细血管前小动脉的数量,AdANG-1组较正常对照组与空载体对照组均明显增加(P<0.05),而AdVEGF组与与空载体对照组相比无明显变化(P=0.892,图4)。除此之外,相比于空载体对照组(195.01±14.09)或者正常对照组(167.18±13.25),平均小血管面积(mm2/血管/0.572 mm2心肌组织)在AdANG-1组明显增加(329.25±19.56,P<0.001),在AdVEGF组中无明显变化(183.97±11.73)。 A:AdANG-1 promoted arteriogenesis in the ischemic myocardium.Arrows indicated α-SMA positive arterioles.Scale bar:50 lm.B:ANG-1 promoted large-size arterioles formation that supported stability and integrity of the vasculature.vs.Healthy animals,(1)P<0.05,(2)P<0.001.LD:Lumen diameter. 图4AdANG-1治疗组缺血心肌中新生微动脉的形成、扩张和维持 ANG-1和VEGF基因表达基因移植后1、 3、4周,左心室心肌都可以检测到ANG-1和VEGF基因表达,而右心室样本中检测不到(图5)。免疫组化染色进一步证实了左心室心肌中有基因表达的蛋白产物(图6) 。两种基因表达都成点状局域性分布,和局部腺病毒注射位点相吻合。 A:ANG-1;B:VEGF.Lanes 1-3 represented gene expression 1,3 and 4 weeks after gene transfer into the left ventricle.Lane 4 represents control samples from right ventricle.M:Molecular marker. 图5外源性人ANG-1和VEGFmRNA在缺血心肌中的一过性表达 The punctuated positive brown staining pattern was consistent with localized gene expression.Scale bar:25 lm. 图6心肌内腺病毒注射位点在3周后ANG-1和VEGF蛋白质表达的免疫组化染色 各类成血管生长因子一般通过调控内皮细胞的增殖和迁移而介导血管的再生。在特定的成血管阶段,各个成血管因子具有不同的特定功能。例如,在血管再生的晚期,成纤维细胞生长因子参与侧枝血管或小动脉的形成过程,而VEGF被认为是新生毛细血管形成的最初启动者[3]。形成功能完整的新生血管需要多个主要的血管再生因子按一定顺序进行持久而协调的相互作用。在慢性缺血的过程中,VEGF和其受体VEGFR的表达至少持续2周,提示VEGF/VEGFR系统在缺血性心肌血管再生的过程中起着主要调控作用[3]。所以,在这一时期适当地给予其他治疗性物质可以加强这一血管再生作用。尽管ANG-1并不促进细胞的有丝分裂,但它与VEGF一样具有促进血管再生的特点。两种生物因子均能诱导血管内皮的生发并能提高内皮细胞的存活[4]。尽管VEGF被认为在血管再生的早期是一种最强效的促进因子,但有证据表明ANG-1在该时期同样发挥着关键作用。ANG-1通过介导内皮细胞与其支持细胞的相互作用,与VEGF协同促进再生血管形成成熟的血管结构[5]。这种相互协同作用在保持血管的长期稳定和结构的完整性方面同样发挥着作用。此外,ANG-1是第1个被确认具有强大的抗血管渗透能力的生长因子,这种能力即使在VEGF、炎症因子等可介导血管渗透的物质存在时也能够发挥作用。ANG-1通过调控内皮细胞之间的连接复合体来调节血管的渗透性,进而保持血管的完整性[6]。缺血心肌自身ANG-1的表达不足严重影响这一血管再生进程,故通过基因转移的方法加强ANG-1的表达对血管的再生进程可能非常有益。本研究中AdANG-1组心肌中微血管密度的显著增高证明了这一推断。AdANG-1组微血管密度比AdVEGF组有更大的提高(但差异无统计学意义)也说明了ANG-1在介导血管再生中的强大作用(图3B)。 在大鼠的急性心梗模型中,ANG-1显著提高了毛细血管前小动脉的密度、缩小了梗塞面积并提高了心脏功能。此外,ANG-1被认为可促进形成由管腔较大的成熟血管组成的血管网络,进而改善血流动力学效果[3]。同时,我们的研究也提示ANG-1提高了微血管的密度,显著增加直径50~100 μm的毛细血管前小动脉的形成,进而提高缺血心肌中的微血管截面积(图4B)。AdANG-1组动物的缺血心肌组织血液灌注得到改善,血管再生反应强烈,这种效果直到基因移植后12周仍在持续。AdVEGF组及空载体组动物由于没有足够的毛细血管前小动脉,其缺血心肌的灌注没有得到明显的改善。而在AdANG-1组,由于ANG-1对新生微血管的成熟和稳定作用,形成了较大的微血管,从而改善了缺血心肌组织的血液灌注。ANG-1组心肌组织的局部血流量在基因移植后12周较基因移植后4周有所减少,但仍然明显高于其他组的局部血流量水平,可以理解为这是心肌组织对基因移植后持续较高的局部血流量的自身平衡反应。至于引起更理想的生理反应需要的AdANG-1剂量需另加评估。 尽管VEGF在血管再生过程中具有重要的作用,但在本实验中其对缺血心肌的血流恢复贡献甚微。基因移植后4周和12周,AdVEGF组和空载体组的心肌局部血流量之间无明显差异,两组心肌的局部血流量在实验结束时均恢复到接近正常水平。提示基因移植后外源性的VEGF并不能提高缺血心肌的灌注,其对实验结束时心肌局部血流恢复正常的作用甚微。与AdANG-1组的局部血流量恢复相比,AdVEGF组在基因移植后4周心肌依然维持缺血状态(图2)。基因移植后12周,AdVEGF组的局部血流恢复程度与正常对照组的心肌相当,这可能与自身侧枝血管对长期缺血的代偿有关。但由于侧枝血流全部代偿冠状动脉完全闭塞所引起的血流消失的可能性极小,故这种代偿并不会必然导致心肌功能的恢复。 Schwarz等[3]观察到,在大鼠的心梗区给予VEGF后,尽管微血管得以增生,但局部血流量并没有显著改善。造成这种现象的原因之一可能是:由VEGF单独介导的新生血管扩张不够充分且其功能不佳(图4B)。另外一个可能的原因为:尽管在AdVEGF组和AdANG-1组心肌的微血管密度均有类似的提高,但后者在基因移植后VEGF水平的提高引起新生血管渗透性增加,导致组织水肿进而影响组织的血液灌注流量。已经阐明ANG-1不仅能够增强VEGF的血管再生反应,同时也能抵消VEGF的致血管渗透效应[7]。此外,ANG-1只有在内源性VEGF水平提高时才能增强组织的灌注,在应用外源性VEGF时并不能改善缺血组织中的侧枝血流[8]。了解不同生长因子所介导的微血管的特性,可以解释本研究中VEGF组缺血心肌中灌注流量与血管密度之间的非同步关系。 外源性基因ANG-1和VEGF的短暂表达足以对下游的血管再生链式反应起到放大作用,该作用已被本研究中缺血心肌血管再生的增强所证明[9]。成血管生长因子在血管再生过程中的控制性表达是非常重要的,VEGF过度或不协调表达可导致血管瘤形成,这些血管不能和正常血管建立有效连接[10],故在恢复缺血区域的血流灌注方面无法起到有效作用。本研究的AdANG-1组和AdVEGF组缺血心肌中,均未探测到异常的血管结构,这表明在基因移植后不久形成的血管结构是稳定的,特别是在AdANG-1组,尽管基因的表达很短暂,但AdANG-1所促成的再生血管功能直到术后12周仍然稳定。 心肌在基因移植后12周未见明显的炎症反应。相对于正常对照组动物,空载体对照组动物的心肌有轻微的血管增生,提示由炎症所引起的血管增生在空载体移植后的早期就已经发生。此外,与外科手术相关的创伤及其炎症反应对血管再生的作用不能完全除外。 本研究应用治疗性基因移植的方法,进行ANG-1和VEGF基因在猪慢性心肌缺血模型上的长期效果对比研究。研究结果提示,ANG-1对缺血心肌具有强大的促血管再生作用,并得到组织学和心脏功能等方面的证据支持。ANG-1而非VEGF促进了新生血管的再生,改善了缺血心肌的血流灌注恢复。ANG-1作为促血管再生因子在促进缺血心肌的再血管化和改善心肌血流灌注方面起到重要作用。ANG-1在促进远期功能性微血管再生方面较VEGF的优势对慢性缺血性心脏病的再血管化治疗具有重要意义。 参 考 文 献 [1] SURI C,JONES PF,PATAN S,etal.Requisite role of angiopoietin-1,a ligand for the TIE2 receptor,during embryonic angiogenesis[J].Cell,1996,87(7):1171-1180. [2] SHIM WS,TEH M,BAPNA A,KIM I,etal.Angiopoietin 1 promotes tumor angiogenesis and tumor vessel plasticity of human cervical cancer in mice[J].ExpCellRes, 2002,279(2):299-309. [3] SAMUEL SM,AKITA Y,PAUL D,etal.Coadministration of adenoviral vascular endothelial growth factor and angiopoietin-1 enhances vascularization and reduces ventricular remodeling in the infarcted myocardium of type 1 diabetic rats[J].Diabetes,2010,59(1):51-60. [4] KIM I,KIM HG,SO JN,etal.Angiopoietin-1 regulates endothelial cell survival through the phosphatidylinositol 3c/-kinase/Akt signal transduction pathway[J].CircRes,2000,86(1):24-29. [5] YAMAUCHI A,ITO Y,MORIKAWA M,etal.Pre-administration of angiopoietin-1 followed by VEGF induces functional and mature vascular formation in a rabbit ischemic model[J].JGeneMed,2003,5(11):994-1004. [6] NGOK SP,GEYER R,LIU M,etal.VEGF and Angiopoietin-1 exert opposing effects on cell junctions by regulating the Rho GEF Syx[J].JCellBiol,2012,199(7):1103-1115. [7] ZHAO Y,LI Z,WANG R,etal.Angiopoietin 1 counteracts vascular endothelial growth factor-induced blood-brain barrier permeability and alleviates ischemic injury in the early stages of transient focal cerebral ischemia in rats[J].NeurolRes,2010,32(7):748-755. [8] SMITH AH,KULISZEWSKI MA,LIAO C,etal.Sustained improvement in perfusion and flow reserve after temporally separated delivery of vascular endothelial growth factor and angiopoietin-1 plasmid deoxyribonucleic acid[J].JAmCollCardiol,2012.59(14):1320-1328. [9] SHIN SH,LEE J,AHN DG,etal.Co-delivery of vascular endothelial growth factor and angiopoietin-1 using injectable microsphere/hydrogel hybrid systems for therapeutic angiogenesis[J].PharmRes,2013,30(8):2157-2165. [10] CHIDIAC R,ZHANG Y,TESSIER S,etal.Comparative phosphoproteomics analysis of VEGF and angiopoietin-1 signaling reveals ZO-1 as a critical regulator of endothelial cell proliferation[J].MolCellProteomics,2016.15(5):1511-1125.
结 果
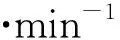
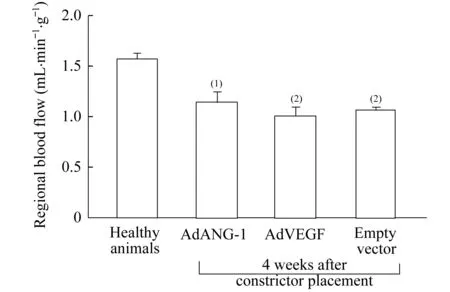
Fig1Contrastofregionalbloodflowamonggroupsofhealthanimalsanddifferent-vector-treatedanimals4weeksafterarterialconstrictionwithAmeroidconstrictor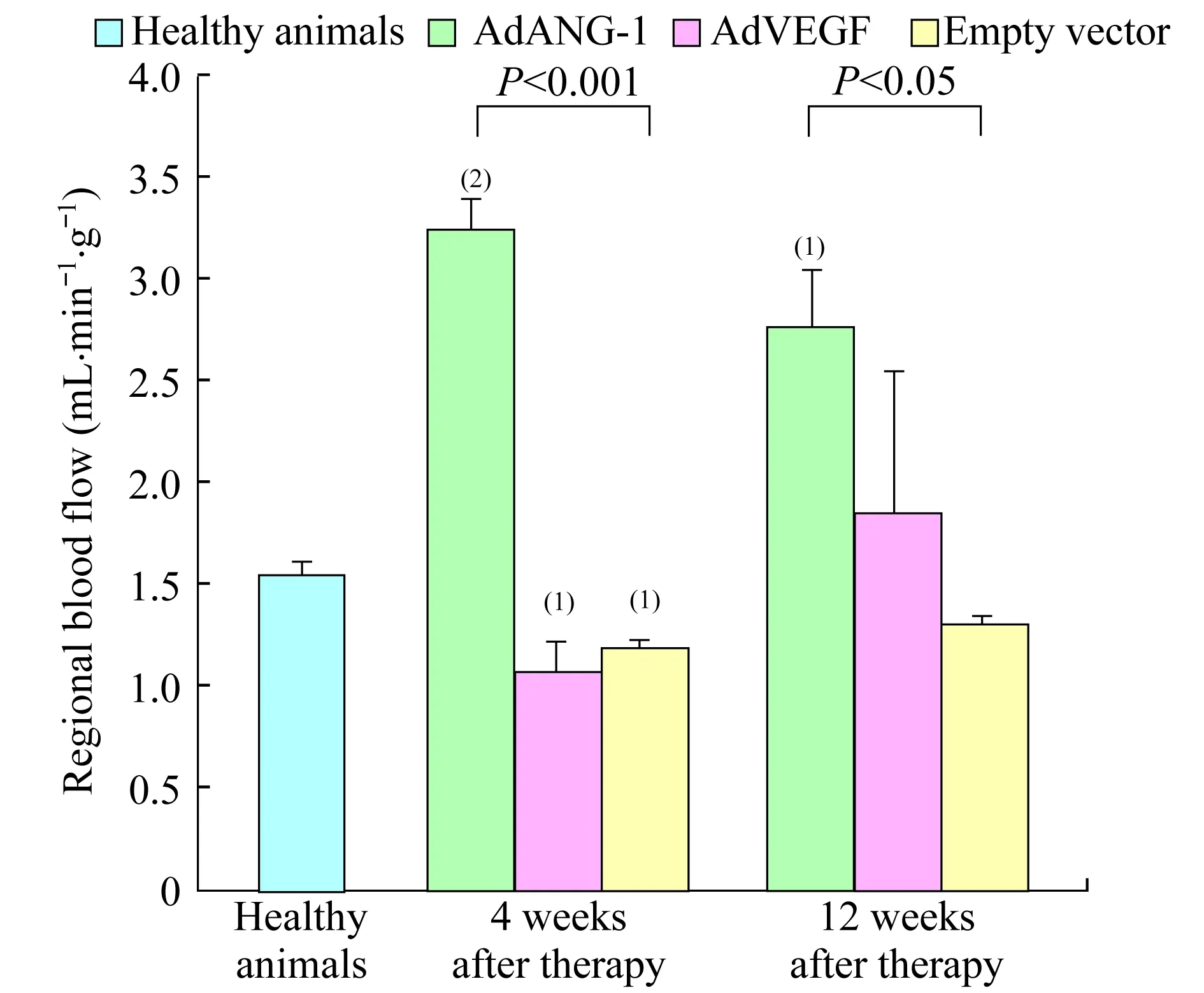
Fig2Contrastofregionalbloodflowamonggroupsofdifferent-vector-treatedanimals4and12weeksaftergenetherapy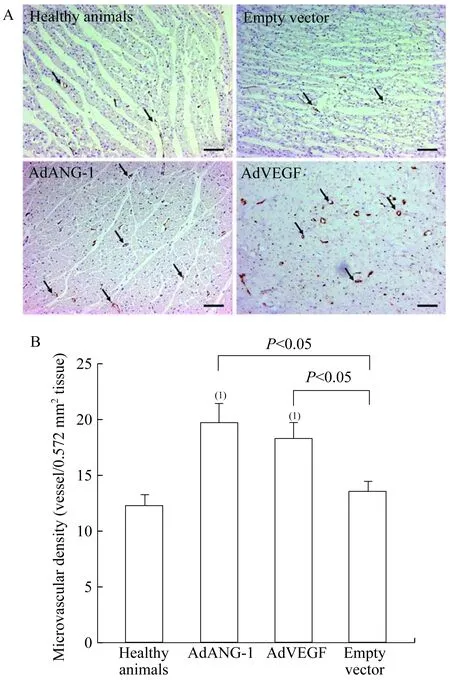
Fig3Contrastofmicrovasculardensityamonggroupsofdifferent-vector-treatedanimals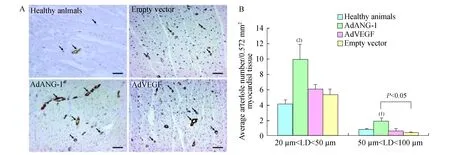
Fig4NeovascularizationinAdANG-1treatedmyocardiumwassustainedbyarterioleformationandvesselexpansion
Fig5TransientexpressionoftheexogenoushumanANG-1andVEGFmRNAwassufficienttosupportangiogenesisintheischemicmyocardium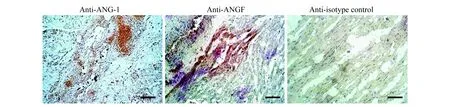
Fig6ImmunohistochemicalstainingofANG-1andVEGFproteinexpressionsinthemyocardium3weeksfollowingintramyocardialgenetransfer讨 论
