αB-Crystallin在非小细胞肺癌增殖迁移中 的作用及其临床意义
2018-06-07胥丰恺祝巧良卢春来
古 杰 胥丰恺 祝巧良 王 琳 葛 棣 卢春来
(复旦大学附属中山医院胸外科 上海 200032)
肺癌是全球发病率、死亡率双第一的恶性肿瘤[1]。据我国国家癌症中心的最新数据显示,肺癌仍然稳居我国肿瘤排行榜单第1位,肺癌的死亡率在40%以上,远超其他肿瘤[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)包括肺鳞癌、腺癌、大细胞癌等,占据肺癌每年新增病例的2/3以上,其中近70%确诊病例为晚期患者,并伴有肿瘤转移,5年生存率低于5%[3]。鉴于NSCLC已然成为威胁全民生存健康的共同问题。目前肺癌的治疗手段包括化疗、放疗、靶向药物、手术及免疫治疗,然而总体治疗效果并不理想,患者最终死于肺癌的远处转移。因此,深入研究肺癌发生、发展及其侵袭转移的相关机制,进一步寻找新的治疗靶点,以期在早期阶段有效控制肺癌生长,同时牵制肺癌侵袭转移,可能为缓解我国居高不下的肺癌发病及死亡率,提高患者的生存率,提供新的思路。
αB-Crystallin属于小热休克蛋白家族,最早在脊椎动物晶状体内发现,后发现在多种组织内均有表达[4-6]。αB-Crystallin功能广泛,具有分子伴侣作用,在细胞增殖、分化、凋亡和血管新生等多种生命活动发挥重要作用[7-8]。已报道αB-Crystallin在多种肿瘤内表达异常,如喉癌、肾透明细胞癌、乳腺癌等,其表达异常与肿瘤复发转移及不良预后密切相关[9-11]。本文通过细胞体外实验研究其在NSCLC增殖迁移中的作用,进一步通过免疫组化技术,探讨其与NSCLC临床病理特征及预后的关系。
材 料 和 方 法
细胞培养人NSCLC细胞系A549 (中国科学院细胞库),培养于含有10%胎牛血清、2 μmol/L 谷氨酰胺、100 IU/mL 青霉素、100 μg/mL硫酸链霉素的DMEM培养液中,放置于37 ℃、5% CO2细胞培养箱中培养。
RNA干扰A549细胞生长至对数生长期时,将细胞消化后铺板,待细胞融合度达到30%~50%时,采用脂质体转染方法给予细胞siRNA转染以下调胞内αB-Crystallin的水平,转染方法按照Lipo2000说明书,针对αB-Crystallin的mRNA不同靶点设计siRNA,其中si-αB-Crystallin-1的靶序列为:5’-TTGCCATTAATAGAGACCTCAAA-3’,si-αB-Crystallin-2的靶序列为:5’-GCCATTAA-TAGAGACCTCAAACA-3’。siRNA-NC为非特异性非相关的RNA片段,作为对照组。
细胞迁移实验取对数生长期的A549细胞,按照5 × 104个/孔的密度将A549细胞置于24孔板内,培养24 h后经脂质体转染siRNA,转染后24 h进行Transwell实验检测细胞的迁移能力。 具体如下:将细胞重悬并用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗去除血清,之后将细胞重悬于200 μL无血清DMEM培养液,并接种于Transwell上室(8 μm 聚碳酸酯膜,6.5 mm 小室,美国Costar公司),下室内加入600 μL含20%血清的DMEM培养液,培养24 h后取出上室,用棉签擦去上室培养液与未穿透的细胞,并用4%多聚甲醛室温固定20 min,之后以0.4% 结晶紫染色15 min,清洗去除多余染液后,放置于倒置显微镜下随机选取5个视野统计细胞迁移数量。
CCK-8检测细胞活力按照5×103个/孔的密度,将A549细胞置于96孔板内培养24 h,转染siRNA,分别在转染后0、24、48、72、96 h进行细胞活力检测,具体步骤按照CCK-8说明书进行:将CCK-8试剂与无血清培养液进行1∶9混合,弃去细胞培养液,分别于对应孔中加入100 μL CCK-8混合液,37 ℃孵育1~2 h,采用酶标仪检测450 nm的吸光值(D),计算并统计细胞相对增殖活力。
细胞总蛋白提取与Westernblot检测siRNA转染48 h后收集细胞总蛋白。具体如下:将细胞培养液去除,加入遇冷的PBS清洗2遍,加入含有蛋白酶抑制剂(radio-immunoprecipitation assay,RIPA)的裂解液,放置于冰上裂解细胞10 min。用细胞刮刀刮下裂解的细胞,将其转移至离心管中,4 ℃ (13.8×g)离心10 min后取上清液,获得总蛋白。在总蛋白溶液中加入SDS加样缓冲液,100 ℃煮沸10 min,以使蛋白变性,获得用于Western blot检测的总蛋白样品。将5~10 μg样品加入十二烷基硫酸钠-聚丙烯酰胺凝胶上样孔,电泳分离蛋白样品,蛋白分离后将凝胶中的蛋白转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。 转印后使用TBST(Tris-Hcl,NaCl,Tween-20)溶液配制的5%脱脂牛奶封闭液于室温下封闭PVDF膜2 h,不洗直接加入对应一抗,并放置于4 ℃孵育过夜。过夜后以TBST洗涤PVDF膜4次,每次10 min,之后加入辣根过氧化物酶标记的二抗,室温孵育1.5 h,以TBST洗涤4次后,采用ECL试剂显色。应用抗体如下:β-actin (1∶5 000,HRP-60008,美国Proteintech公司);αB-Crystallin (1∶1 000,ab13497,美国Abcam公司)。
组织标本选取2005年在复旦大学附属中山医院胸外科行根治性手术的208例肺癌患者石蜡标本,收集患者临床病理资料,包括病理类型、年龄、性别、是否吸烟(连续或累计吸烟6个月或以上),肿瘤大小、肿瘤分化程度及淋巴结转移个数。将208例患者癌及癌旁组织制作组织芯片[12]。
免疫组化组织芯片经加热及二甲苯常规脱蜡后经梯度乙醇及蒸馏水水化,之后使用柠檬酸抗原修复液对其进行微波修复,修复后经PBS漂洗4次,每次5 min,去除修复液。 滴加3% H2O2,室温孵育15 min以消除内源性过氧化物酶,经4次PBS漂洗后滴加山羊血清封闭液,室温孵育1 h。之后加入经山羊血清封闭液稀释的αB-Crystallin一抗 (1∶100,ab13497,美国Abcam公司),4 ℃孵育过夜,过夜后PBS漂洗4次,每次5 min,漂洗后滴加辣根过氧化物酶标记的二抗,室温孵育1 h,经PBS漂洗4次,每次5 min,漂洗后滴加二氨基联苯胺显色液,于显微镜下观察显色反应程度,之后进行苏木精复染,并经梯度酒精脱水,二甲苯透明后,使用中性树胶封片,以备后续阅片及存储。
染色结果判定免疫组化染色后由2名医师独立阅片,阅片方法采取随机选取5个高倍视野(×400),结果判定方法参照既往文献进行[13],即根据染色强度及阳性细胞比例进行评判。染色强度:全阴性计0分,轻度染色计1分,中度染色计2分,强染色计3分;阳性比例:全阴性计0分;阳性比例1%~29%,计1分;阳性比例30%~59%,计2分;阳性比例≥60%,计3 分。按阳性细胞比例×染色强度评分,≤3分计为低表达,>3分计为高表达。
统计学方法统计软件为SPSS 13.0。细胞实验每项重复3次,采用t检验比较差异有无统计学意义。不同分组间比较用χ2检验。生存分析采用Kaplan-Meier法并进行Log-rank检验。多因素分析采用Cox多因素回归分析。P<0.05为差异有统计学意义。
结 果
下调αB-Crystallin表达水平抑制NSCLC增殖和迁移能力转染SiRNA-αB-Crystallin后,A549细胞系中αB-Crystallin的蛋白表达水平显著下调(图1A);CCK-8实验结果显示:干扰αB-Crystallin后48 h起增殖能力显著低于对照组(P<0.05,图1B)。Transwell实验结果显示:干扰αB-Crystallin后,A549细胞系的迁移能力较对照组显著下降(P<0.05,图1C)。
NSCLC组织中αB-Crystallin表达与患者临床病理特征的关系分析208例NSCLC组织标本中αB-Crystallin表达的表达情况,αB-Crystallin表达主要定位于细胞质内(图2),根据上述评分标准判断:高表达106例(51.0%),低表达102例(49.0%)。癌旁组织中仅22例为高表达(10.5%),肿瘤组织中的αB-Crystallin表达明显高于正常癌旁组织。αB-Crystallin表达水平与淋巴结转移显著相关(P<0.05,表1),而与患者年龄、性别、肿瘤大小、病理类型、肿瘤分化程度及分期无明显相关性。
αB-Crystallin表达与患者预后的关系Kaplan-Meier曲线(图3)显示,αB-Crystallin高表达组患者术后总生存时间明显低于αB-Crystallin低表达组,差异有显著统计学意义(P<0.01)。单因素分析结果显示肿瘤大小、淋巴结转移、pTNM分期 和αB-Crystallin表达水平为NSCLC不良预后因素(P<0.01)。多因素分析结果显示肿瘤的肿瘤大小、淋巴结转移和αB-Crystallin表达水平为NSCLC独立不良预后因素(P<0.05,表2)。
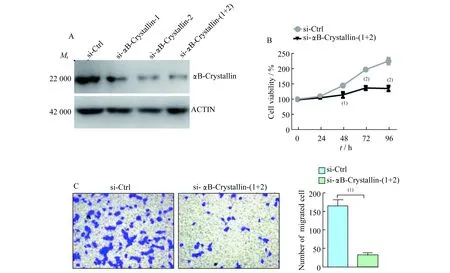
A:The effect of the knockdown was validated through Western blot analyses.B:The proliferation ability was assessed with CCK-8 assay at 24,48,72,and 96 hours after transfection.C:The migration ability was assessed with Transwell (original magnification,×100).(1)P<0.01,(2)P<0.001.
图1下调αB-crystallin后A549细胞系迁移与增殖能力下降
Fig1InterferenceofαB-crystallinexpressionimpairedthemigrationandproliferationofA549cells
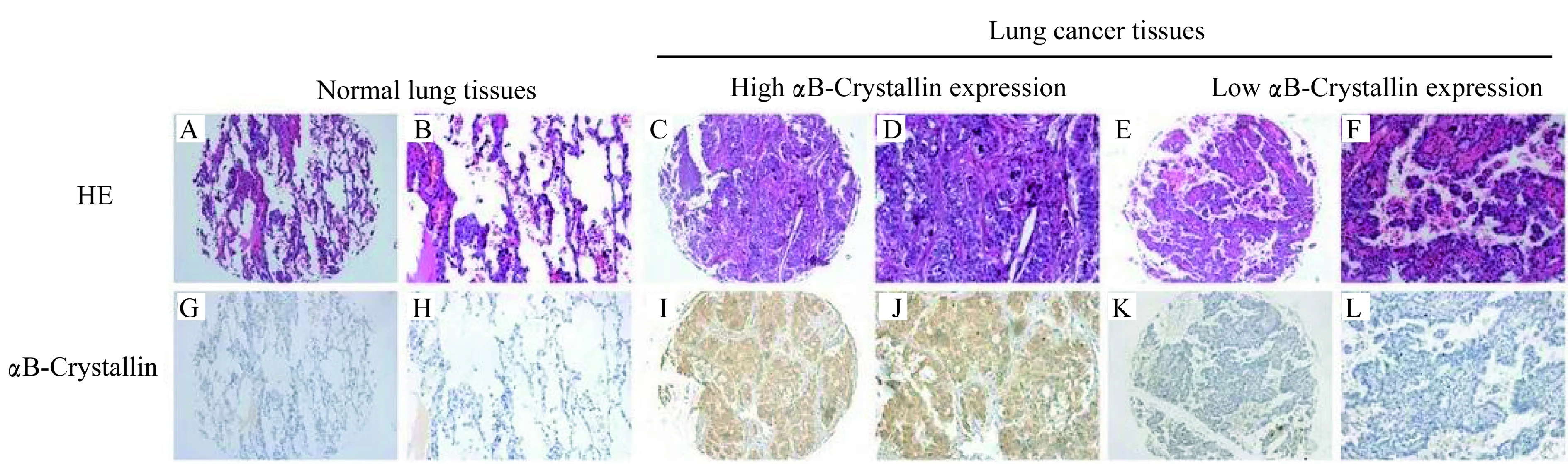
A and B:The HE staining of normal lung tissues.C-F:The HE staining of lung cancer tissues.G and H:Negative expression of αB-crystallin in normal lung tissues.I and J:High αB-crystallin expression.K and L:Low αB-crystallin expression (A,C,E,G,I and K:×100; B,D,F,H,J and L:×400).

图2 αB-crystallin在NSCLC组织及癌旁组织内的表达Fig 2 Immunohistochemical staining for αB-crystallin in NSCLC tissues and normal lung tissues
aPvalue was analyzed by squamous cell carcinomavs.adenocarcinomas;bOther including adenosquamous carcinoma,large-cell carcinoma,mucoepidermoid carcinoma and carcinosarcoma.
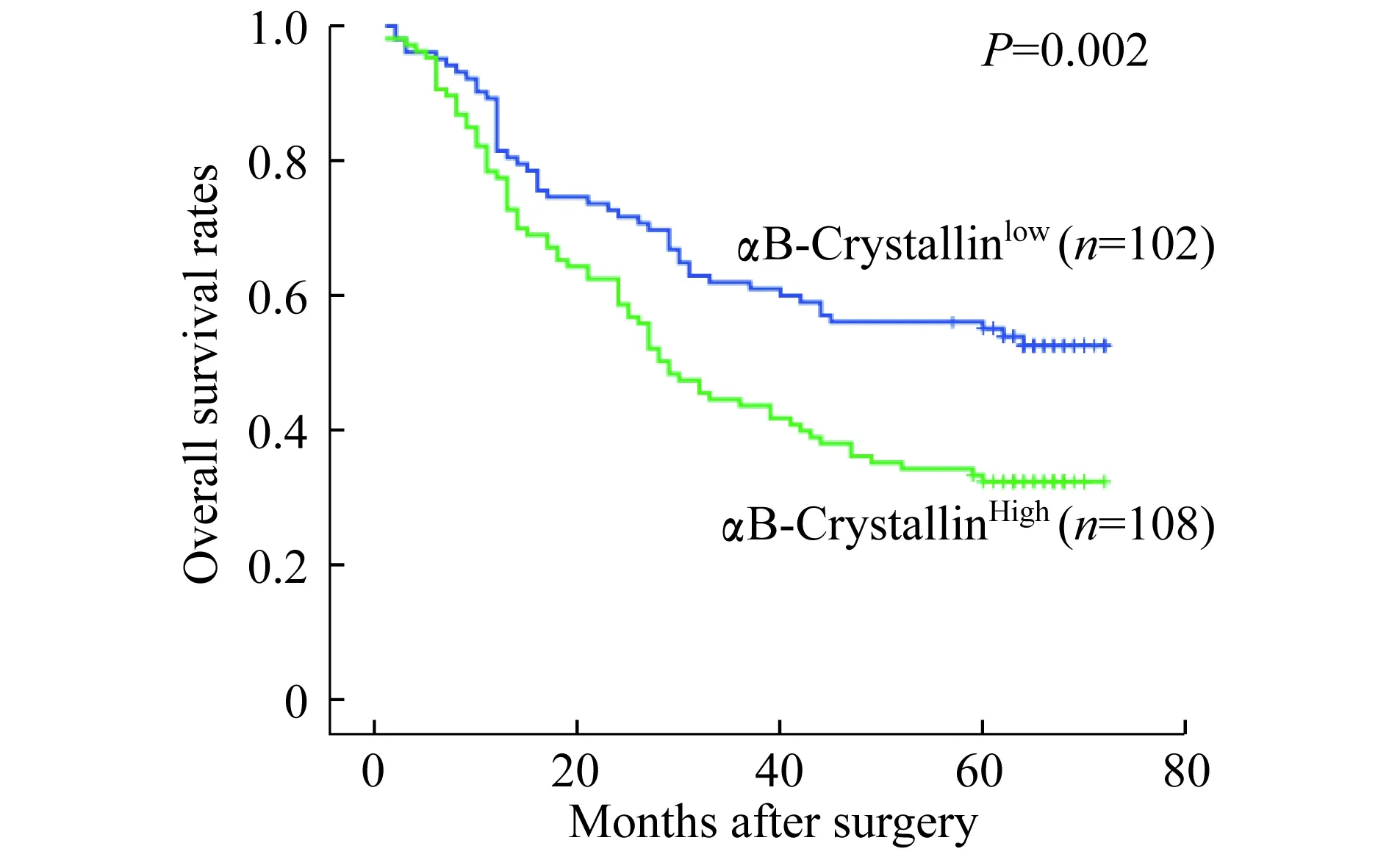
图3 αB-crystallin表达与患者总生存期关系Fig 3 Prognostic signicance assessed by Kaplan-Meier survival estimates and log-rank tests
讨 论
肺癌的发生发展是一个复杂的生物学过程,尽管多种因素被报道可以诱导肺癌的发生发展,但是遗传基因的异常仍然被认为是诱导肺癌产生的根本原因[14]。目前已发现肺癌中存在多种基因突变或过表达,由此驱动了肺癌的研究进展,其中最著名的是表皮生长因子受体(epidermal growth factor receptor,EGFR)的突变。在我国非吸烟女性患者中约有50%~60%的病例携带有EGFR突变位点[15]。针对EGFR基因突变的靶向药物,也已成功用于肺癌的临床治疗。然而,患者耐药的不断产生以及非突变患者无靶向药物的临床现状,提示肺癌发病的机制还需要更深层的解析,也迫使我们去寻求更为有效的治疗策略和靶点。在本研究中,我们 发现在肺癌组织中显著上调的αB-Crystallin与患者的生存具有显著负相关性,通过体外细胞实验,我们证实了下调αB-Crystallin,可抑制肺癌细胞的增值和迁移,提示其可能在肺癌临床治疗中具有潜在的应用价值。
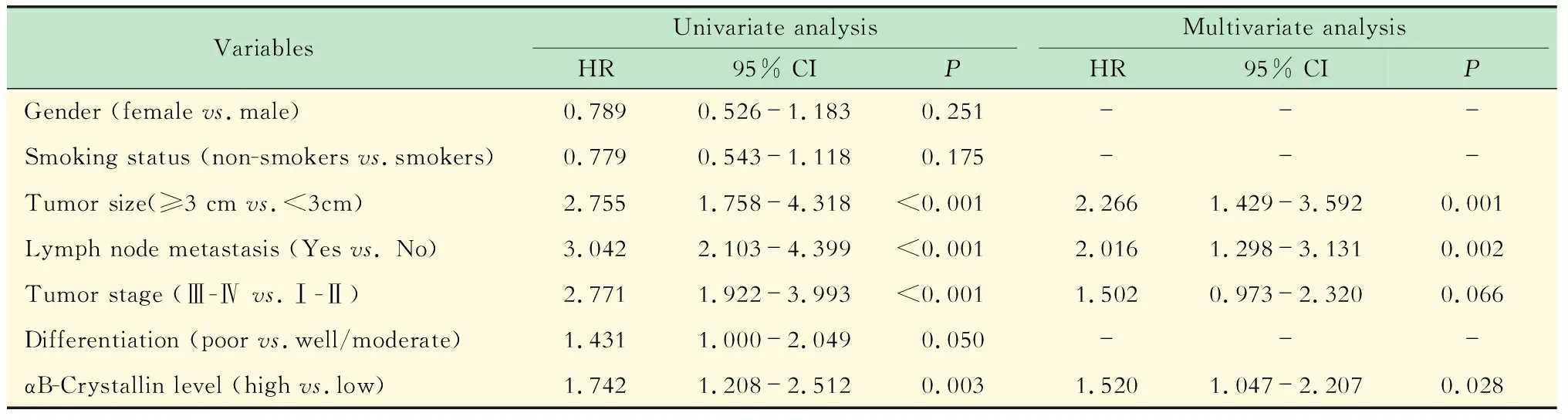
表2 NSCLC患者预后的单因素及多因素分析Tab 2 Univariate and Multivariate analysis of factors associated with OS in NSCLC patients
OS:Overall survival.
αB-Crystallin可被氧化应激、缺氧等外界刺激诱导产生。其相对分子质量(Mr)为20 000,可辅助蛋白质正确折叠、移位,抑制蛋白的变性降解,进而参与调控细胞增殖凋亡、细胞衰老等多种病理生理过程,在机体内发挥重要保护性作用[6]。以往研究显示,αB-Crystallin的表达在多种肿瘤中存在异常,并与肿瘤的复发转移,患者生存密切相关。Mao等[16]通过免疫组化检测109例喉癌组织内αB-Crystallin的表达情况,发现αB-Crystallin的表达与喉癌患者肿瘤分化及不良预后密切相关。Malin等[17]发现乳腺癌患者αB-Crystallin高表达与患者脑转移密切相关。Shi等[18]发现αB-Crystallin通过促进肿瘤上皮间质转换促进了结肠癌的进展。我们通过对208例NSCLC患者癌组织及癌旁组织中的αB-Crystallin蛋白的表达检测发现,αB-Crystallin在癌组织内的表达显著高于癌旁组织,并可作为NSCLC的独立不良预后指标,与前述研究相一致。同时我们发现淋巴结转移患者组织中有较高的αB-Crystallin表达。淋巴结转移是肺癌转移的一个重要途径,也是影响患者术后生存的重要因素。虽然患者淋巴结转移可经术后辅助化疗、放疗等手段得到明显控制,但后期复发率依然很高。我们的结果提示αB-Crystallin可能参与了淋巴结转移过程,因此,抑制αB-Crystallin的表达有可能成为抑制淋巴结转移的新途径。
增殖和迁移是肿瘤细胞的两个重要生物学特征。Goplen等[19]发现αB-Crystallin抑制胶质细胞瘤的凋亡,促进了肿瘤的增殖。Huang等[11]发现αB-Crystallin在肝癌内表达升高,αB-Crystallin与14-3-3ζ结合,抑制了后者的降解,通过上皮间质转化促进了肿瘤迁移。在本研究中我们也发现降低αB-Crystallin表达水平,NSCLC细胞系的增殖活力下降,迁移能力均降低,结果表明αB-Crystallin调控肺癌进展的机制,可能主要是影响了肺癌细胞的增殖和迁移能力。
因此,鉴于αB-Crystallin对NSCLC生长及细胞迁移的显著调控作用,可作为潜在干预靶点,通过调节αB-Crystallin的表达,可能有效控制肺癌进展。αB-Crystallin在208例肿瘤患者中均表现为不同程度的表达上调,而且并不依赖于吸烟这一导致EGFR等多基因突变的关键因素,提示其调节肿瘤生长的作用可能具有个体广泛性和独立于其他靶点的特性,这对于无EGFR突变的肺癌患者的靶向治疗带来了希望,并可能改善目前靶向药耐药的临床现状。通过开发针对αB-Crystallin的靶向抑制剂,联合已有的靶向药治疗,可能成为提高NSCLC整体疗效、缓解肺癌恶化的新策略。
参 考 文 献
[1] TORRE LA,BRAY F,SIEGEL RL,etal.Global cancer statistics,2012[J].CACancerJClin,2015 ,65(2):87-108.
[2] ZHENG R,ZENG H,ZHANG S,etal.Estimates of cancer incidence and mortality in China,2013[J].ChinJCancer,2017,36(1):66.
[3] FERLAY J,SHIN HR,BRAY F,etal.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].IntJCancer,2010,127(12):2893-2917.
[4] DUBIN RA,WAWROUSEK EF,PIATIGORSKY J.Expression of the murine alpha B-crystallin gene is not restricted to the lens[J].MolCellBiol,1989 ,9(3):1083-1091.
[5] MALIN D,PETROVIC V,STREKALOVA E,etal.αB-crystallin:Portrait of a malignant chaperone as a cancer therapeutic target[J].PharmacolTher,2016,160:1-10.
[6] CARVER JA,GROSAS AB,ECROYD H,etal. The functional roles of the unstructured N- and C-terminal regions in αB-crystallin and other mammalian small heat-shock proteins[J].CellStressChaperones,2017,22(4):627-638.
[7] ITO H,KAMEI K,IWAMOTO I,etal.Regulation of the levels of small heat-shock proteins during differentiation of C2C12 cells[J].ExpCellRes,2001,266(2):213-221.
[8] DIETERICH LC,HUANG H,MASSENA S,etal.αB-crystallin/HspB5 regulates endothelial-leukocyte interactions by enhancing NF-κB-induced up-regulation of adhesion molecules ICAM-1,VCAM-1 and E-selectin[J].Angiogenesis,2013,16(4):975-983.
[9] HO PY,CHUEH SC,CHIOU SH,etal.alphaB-Crystallin in clear cell renal cell carcinoma:Tumor progression and prognostic significance[J].UrolOncol,2013,31(7):1367-1377.
[10] MOYANO JV,EVANS JR,CHEN F,etal. AlphaB-crystallin is a novel oncoprotein that predicts poor clinical outcome in breast cancer[J].JClinInvest,2006,116(1):261-270.
[11] HUANG XY,KE AW,SHI GM,etal.αB-crystallin complexes with 14-3-3ζ to induce epithelial-mesenchymal transition and resistance to sorafenib in hepatocellular carcinoma[J].Hepatology,2013,57(6):2235-2247.
[12] 古杰.C5aR在非小细胞肺癌侵袭转移中的作用及其机制研究[D].复旦大学,2013:36-37.
[13] 卢春来,纪元,葛棣.CXCR4在食管鳞形细胞癌中的表达及临床意义[J].复旦学报(医学版),2008,35(2):224-227.
[14] POPPER HH.Progression and metastasis of lung cancer[J].CancerMetastasisRev,2016 ,35(1):75-91.
[15] XIA N,AN J,JIANG QQ,etal.Analysis of EGFR,EML4-ALK,KRAS,and c-MET mutations in Chinese lung adenocarcinoma patients[J].ExpLungRes,2013,39(8):328-335.
[16] MAO Y,ZHANG DW,LIN H,etal.Alpha B-crystallin is a new prognostic marker for laryngeal squamous cell carcinoma[J].JExpClinCancerRes,2012 ,31:101.
[17] MALIN D,STREKALOVA E,PETROVIC V,etal.αB-crystallin:a novel regulator of breast cancer metastasis to the brain[J].ClinCancerRes,2014 ,20(1):56-67.
[18] SHI C,YANG X,BU X,etal.Alpha B-crystallin promotes the invasion and metastasis of colorectal cancer via epithelial-mesenchymal transition[J].BiochemBiophysResCommun,2017 ,489(4):369-374.
[19] GOPLEN D,BOUGNAUD S,RAJCEVIC U,etal.αB-crystallin is elevated in highly infiltrative apoptosis-resistant glioblastoma cells[J].AmJPathol,2010 ,177(4):1618-1628.
