不同部位苦荞粉中3种黄酮类成分含量的比较
2018-06-07刘永翔陈朝军陈中爱唐健波
卢 扬, 刘永翔, 李 俊, 王 辉, 陈朝军, 陈中爱, 唐健波, 刘 辉
(贵州省农业科学院生物技术研究所,贵州贵阳 550006)
苦荞是一种蓼科荞麦属植物,因其有高含量的淀粉(71.6%~72.61%)以及抗氧化物质黄酮,兼具药食两用的效果。苦荞的栽培主要集中在我国西南地区,包括四川、云南、贵州等省(区),四川省的凉山州被认为是苦荞种植的发源之地,是当前世界上苦荞麦分布最集中、种植面积最大的产区[1]。贵州省威宁县地处贵州西北部,高海拔、苦寒环境适合苦荞的种植,播种面积达5.33万hm2以上,是贵州省重要的苦荞生产基地,也是国内苦荞生产极其重要的原料供应基地[2]。
由于苦荞丰富的氨基酸成分,以及具有降血压、降血脂、抗氧化作用的黄酮类物质[3-4],已经被开发成形式多样的产品,包括苦荞茶、苦荞面条、苦荞沙琪玛等。贵州省威宁县的苦荞加工可追溯到600多年前,威宁县生产的荞酥成为明朝开国皇帝朱元璋的御用贡品。经过多年的发展和工艺改进,目前贵州省威宁县的苦荞加工产品有荞酥、苦荞米、苦荞酒、苦荞饭等。而经过特殊工艺精制而成的苦荞粉,是面条、馒头、饺子、糕点等食品的添加原料,且由于工艺不复杂、营养成分损失少等特点,非常适合“三高”人士作为主食食用。2014年,农业部发布了NYT 894—2014《绿色食品 荞麦及荞麦粉》行业标准,对苦荞粉中的总黄酮、水分、黄曲霉毒素、重金属等提出了不同限度要求,其中总黄酮含量采用分光光度法以芸香苷含量为标准进行测定。但是,单一成分的测定不能真实反映苦荞粉中总黄酮含量的实际水平,达不到综合评价的效果。本研究采用高效液相色谱法,同时测定3个不同部位的苦荞粉(籽粒粉、芽苗菜粉、荞麦叶粉)中3种主要黄酮类活性成分芸香苷、槲皮素和山奈酚含量,并对其进行比较研究,以期为苦荞粉的应用和质量控制提供依据。
1 材料与方法
1.1 仪器与试剂
MS105DU电子天平,购自上海闵胜科技有限公司;LC-20A高效液相色谱仪,二极管阵列检测器为SPD-M 20A,自动进样器为SIL-20A,高压输液泵为LC-20A,购自日本岛津公司。色谱柱为Agilent ZORBAX Extend-C18(5 μm,250 mm,4.6 mm),购自美国Thermo公司;电热恒温水浴锅(HWS-26),购自上海一恒科学仪器有限公司;LGJ-10B真空冷冻干燥机,购自杭州创意真空冷冻干燥设备厂;CS-700超微粉碎机,购自广州市旭朗机械设备有限公司;UV-2450紫外可见分光光度计,购自日本岛津公司。
芸香苷、槲皮素、山奈酚标准品,均购自中国医药集团化学试剂有限公司。甲醇、乙酸为色谱纯,购自贵州金摩尔化学有限公司。黔苦1号苦荞种子、苦荞芽苗菜由贵州省生物技术研究所提供,苦荞叶片采自贵州省威宁县试验地。
1.2 试验方法
本试验于2016年8—12月在贵州省农业科学院生物技术研究所农业生物技术重点实验室及贵州省威宁县农业科学院试验地完成。苦荞品种为黔苦6号。
1.2.1 不同来源苦荞粉的获得 籽粒粉:参照濮生财等的方法[5]制得。芽苗菜粉的制作:选择籽粒饱满的荞麦种子放在平皿中,加入适量清水浸泡10 h后,将种子转移至另一个干燥平皿中放置16 h左右。然后将种子均匀地码在铺有纱布的带孔塑料盆中,将纱布盖上,每天撒适量清水于纱布上,使其保持湿润。约7 d后,种子经过发芽、生根、长叶,将上层纱布打开,维持10 h左右,使叶片可以获得足够光照,保证芽苗菜有充足的水分。在第13天左右,收集苦荞芽苗菜500 g,于-30 ℃冰箱预冷冻12 h,然后在真空冷冻干燥器中将芽苗菜冻干,并用超微粉碎机将其打成粉末,即得芽苗菜苦荞粉。荞麦叶粉的制作:荞麦叶片采自贵州省威宁县试验地,制粉过程与芽苗菜粉制作过程一致。
1.2.2 色谱条件 色谱柱为Agilent ZORBAX Extend-C185 μm,4.6 mm×250 mm,流速为1.0 mL/min,柱温为35 ℃,进样量为20 μL,检查波长为365 nm,流动相A:甲醇,流动相B:0.1% 乙酸,进样量为20 μL,根据表1进行梯度洗脱。

表1 梯度洗脱程序
1.2.3 溶液样品的制备 标准使用液的制备:分别精确称取10 mg对照品芸香苷、10 mg槲皮素、10 mg山奈酚于25 mL量瓶中,用甲醇定容,配成浓度分别为400 μg/mL的对照品贮备液。
分别量取5 mL芸香苷、3 mL槲皮素、2 mL山奈酚的对照品贮备液于10 mL容量瓶中,分别制成芸香苷、槲皮素、山萘酚浓度约为200、120、80 μg/mL的混合对照品使用液,然后用甲醇进行稀释,经0.45 μm滤膜过滤,进样20 μL,进行高效液相色谱(high performance liquid chromatography,简称HPLC)分析,绘制标准曲线图。
供试样品溶液制备:分别精确称取苦荞粉样品约1 g,于85 ℃用90%甲醇索氏提取,旋转蒸发浓缩于100 mL量瓶中,加甲醇定容,取1 mL于10 mL量瓶中,加甲醇稀释至刻度。吸取上述样品,经0.45 μm滤膜过滤,进样20 μL,进行色谱分析,用外标法计算样品中的芸香苷、槲皮素、山萘酚含量。
2 结果与分析
2.1 系统性试验
分别精确吸取混合标准使用液、苦荞供试品溶液各 20 μL,用LC-20A高效液相色谱仪进行测定,获得液相色谱分离图。由图1可以看出,芸香苷、槲皮素及山奈酚与其相邻色谱峰的分离度均大于1.5,理论塔板数、各色谱峰面积均超过10 000,溶剂对谱峰几乎无干扰。
2.2 波长的选择
通过UV-2450日本岛津紫外可见分光光度计,在190~380 nm范围内分别对混合对照品溶液中的芸香苷、槲皮素和山奈酚色谱峰进行紫外扫描,结果显示,上述3种成分均在280、365 nm附近有最大吸收,因此本研究选择280、365 nm 2个波长,对样品进行检测。由于365 nm紫外光获得的HPLC谱峰较好,因此最后选择吸收波长为365 nm的紫外光对样品进行检测。
2.3 流动相选择
在试验过程中,采用甲醇-水、甲醇-0.1%磷酸、甲醇-0.1%乙酸作为流动相,结果发现以甲醇-水、甲醇-0.1%磷酸作为流动相的色谱峰存在拖尾现象,没有达到理想的分离效果。而以甲醇-0.1%乙酸溶液作为流动相以后,可明显改善HPLC色谱峰峰形,分离效果较好。因此,本研究最终选择甲醇-0.1%乙酸溶液为流动相。
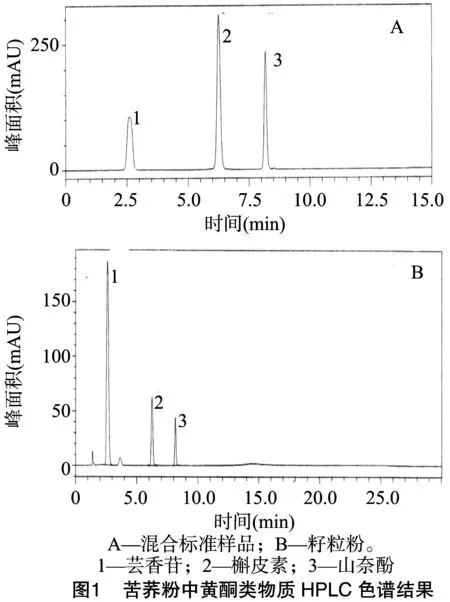
2.4 线性关系分析
分别精确量取适量混合标准品溶液,用甲醇进行稀释,使各成分的浓度达到如下水平:芸香苷,0.5、1、5、25、50、100、200 μg/mL;槲皮素,0.3、1.5、3、15、30、60、120 μg/mL;山萘酚,0.2、1、2、10、20、40、80 μg/mL。将各溶液注入液相色谱仪,按照设定色谱条件进行HPLC测定。平行进样测定3次,以峰面积平均值y与进样量x(μg)进行线性回归,得回归方程(表2)。
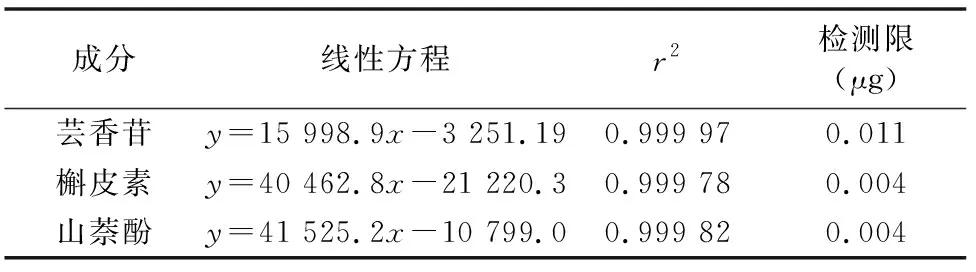
表2 芸香苷、槲皮素、山奈酚线性回归方程
结果表明,所得线性方程的相关系数均在0.99以上,表明曲线具有很好的线性关系。以2倍基线噪声所对应的浓度计算出本方法中芸香苷、槲皮素、山奈酚的检出限分别为 0.011、0.004、0.004 μg,表明本方法的线性范围较宽。
2.5 精密度试验
精确吸取“1.2.3”节中的混合标准品溶液20 μL,按设定的色谱条件连续进样6次,测得芸香苷、槲皮素、山奈酚峰面积相对标准偏差(RSD)分别为0.29%、0.27%、0.28%(n=6),表明仪器精密度良好。
2.6 重复性试验
取同一批样品芽苗粉,按照“1.2.2”节中的方法,平行制备4份供试样品溶液,分别进样测定。结果表明,芸香苷、槲皮素、山奈酚平均含量分别为25.27、0.31、0.021 mg/g,相对标准偏差分别为2.22%、1.63%、2.37%(n=6),表明本法重复性良好。
2.7 稳定性试验
取芽苗粉,按照“1.2.3”节中的方法,配制供试样品溶液,分别于制备后0、12、24、48 h进样测定。结果表明,芸香苷、槲皮素、山奈酚峰面积RSD分别为1.06%、1.31%、1.42%(n=6),表明48 h内,供试样品溶液可保持稳定性。
2.8 加样回收率试验
在同一组容量瓶中,分别加入等量的芽苗粉样品,然后再分别加入不同量的芸香苷、槲皮素、山奈酚标准混合溶液,测定其回收率。结果表明,苦荞粉中芸香苷回收率为 97.77%~99.17%,槲皮素回收率为93.97%~97.99%,山奈酚回收率为96.76%~98.59%,RSD分别为0.71%、2.09%、0.94%(表3),符合定量分析中准确度的要求,回收效果较好。
2.9 3种苦荞粉中黄酮类物质含量测定
采用HPLC法,对芽苗粉、荞麦叶粉、籽粒粉中的芸香苷、槲皮素、山奈酚进行测定,利用外标法计算其含量。表4结果表明,芸香苷在各种苦荞粉中的含量高于槲皮素、山奈酚;芸香苷、槲皮素在芽苗粉中的含量均高于荞麦叶粉、籽粒粉,而山奈酚在籽粒粉中的含量最高,其次是芽苗粉,在荞麦叶粉中山奈酚含量最低。
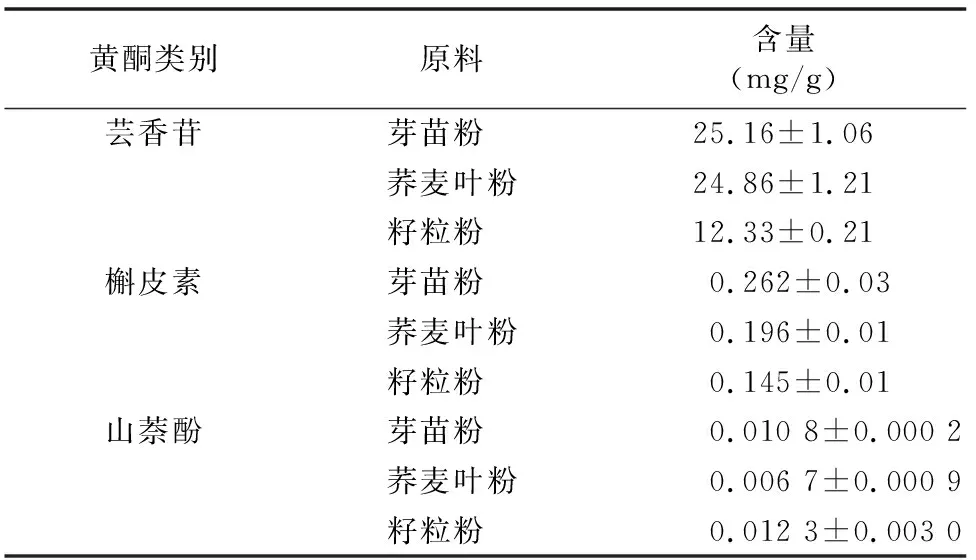
表4 不同来源苦荞粉中黄酮类物质含量(n=4)
3 讨论与结论
采用HPLC法,对用苦荞籽粒、芽苗菜、荞麦叶制作成的苦荞粉中的芸香苷、槲皮素、山奈酚进行精确定量分析,结果表明,芸香苷、槲皮素含量在芽苗粉中的含量最高,在籽粒粉中含量最低。有研究发现,苦荞籽粒在萌发过程中,一些活性成分如芸香苷、槲皮素、D-手性肌醇等的含量会显著上升,特别是芸香苷,含量可上升十几倍[6-8]。一般荞麦种子在萌发过程中,苯丙氨酸解氨酶(PLA)活性上升,而黄酮类物质的含量随着PLA活性增强而上升[9],因此,苦荞籽粒萌发成芽苗菜后,芽苗菜中的芸香苷、槲皮素含量显著上升。赵玉平等测定和分析了苦荞麦不同器官中的黄酮含量差异,结果发现苦荞叶片中的芸香苷、槲皮素含量显著高于籽粒[10-11]。因此可见,本试验结果与前人的研究结果一致。
本研究表明,苦荞籽粒粉中的山奈酚含量最高,然后是芽苗粉,荞麦叶粉中的含量最低。这与夏清等的研究结果[12-13]类似,具体的原因有待进一步分析。
综上所述,本研究建立的HPLC检测体系,可应用于苦荞粉中芸香苷、槲皮素、山奈酚的精确定量分析,方法简便快速,结果准确,且节省了时间,可用于苦荞粉的质量控制。
参考文献:
[1]曹吉祥,韩怡峰. 凉山苦荞产业现状与发展对策[J]. 中国农技推广,2014,30(10):9-11.
[2]马关次,唐 艳,陈 丹,等. 威宁县苦荞产业发展现状及发展思路的研究[J]. 内蒙古科技与经济,2015(24):14-15.
[3]李 飞,任 清,季 超,等. 苦荞籽粒黄酮的提取纯化及抗氧化活性研究[J]. 食品科学技术学报,2015,33(6):57-64,82.
[4]彭德川,徐家钰,陈 思,等. 不同量黑苦荞茶对小鼠血糖及糖耐量的影响[J]. 食品研究与开发,2008,29(9):4-6.
[5]濮生财,鲁 璐,焦 威,等. 不同品种苦荞中的4种活性黄酮含量[J]. 应用与环境生物学报,2015,21(3):470-476.
[6]侯建霞. 苦荞麦中活性成分及其在萌发过程中变化的研究[D]. 无锡:江南大学,2007.
[7]祖 悦,张晓军,蒋 丹,等. 荞麦芽苗菜培养过程中芦丁含量变化研究[J]. 牡丹江师范学院学报(自然科学版),2015(4):48-50.
[8]石 磊,刘 超,梁 霞,等. 萌发荞麦中芦丁和槲皮素含量变化的研究[J]. 食品研究与开发,2016,37(15):30-33.
[9]唐 宇,赵 钢. 荞麦中苯丙氨酸解氨酶活力与黄酮含量的关系[J]. 西南科技大学学报(哲学社会科学版),1998(1):9-12.
[10]赵玉平,肖春玲. 苦荞麦不同器官总黄酮含量测定及分析[J]. 食品科学,2004,25(10):264-266.
[11]邵美红,林 兵,孙加焱,等. 不同品种苦荞麦不同器官总黄酮含量的比较分析[J]. 植物资源与环境学报,2011,20(1):86-87.
[12]夏 清,黄艳菲,李 波,等. HPLC法测定荞麦不同种不同部位槲皮素和山柰酚的含量[J]. 中药材,2014,37(7):1149-1151.
[13]张冬梅. 苦荞芽菜培养及其次生代谢产物黄酮的代谢调控[D]. 西安:陕西科技大学,2012.
