金银花黄酮合成酶LjFNS基因克隆及序列分析
2018-06-07杨总应蒋向辉
杨总应, 蒋向辉
(凯里学院化学与材料工程学院,贵州凯里 556011)
金银花(Lonicerajaponica)别称忍冬,2015年版《中华人民共和国药典》规定其为忍冬科忍冬属忍冬干燥花蕾或带初开的花[1]。金银花原产于我国山东、河北、河南等省,近年来在湖南、贵州、四川等省均有引种栽培。金银花性味甘寒,具有清热解毒、去风热等功效,近年来研究发现,金银花在降血脂、调节人体免疫与抗病毒方面有特殊的疗效[2]。随着以金银花为主要原料的一系列药用与保健产品的开发,金银花的市场价值越来越重要。金银花含有140多种化合物,挥发油类、绿原酸类、黄酮类、三萜类是其主要成分,其中黄酮类化合物有木犀草素-7-O-α-D-葡萄糖苷、木犀草素-7-O-β-D-半乳糖苷、5-羟基-3′,4′,7-三甲氧基黄酮、槲皮素-3-O-β-D-葡萄糖苷、金丝桃苷等[3-4]。
笔者所在实验室曾以金银花为试验材料,采用差异表达的方法克隆得到LjFNS基因的中间序列(GenBank登录号JQ716370.1),测序后利用美国国立生物技术信息中心(national center for biotechnology information,简称NCBI)的Blast分析软件进行序列相似性搜索,发现该序列与拟南芥基因组中的细胞色素P450基因的序列相似。为了进一步研究该基因在金银花生长发育中的功能,本研究采用染色体步移方法,以金银花为试验材料,克隆得到该基因的基因组序列和编码序列(coding sequence,简称CDS),在对序列进行生物信息学分析的基础上,采用实时荧光定量PCR(qPCR)的方法分析LjFNS在金银花茎、叶与花等不同组织以及幼叶、老叶、白花与黄花等不同发育时期的表达特性。
1 材料与方法
1.1 试验材料
本试验中采用的金银花采自怀化学院药用植物园,金银花植株于2012年引自河南省新乡市,经怀化学院刘光华教授鉴定为忍冬属植物金银花。
1.2 试验方法
1.2.1 基因组序列的克隆 参照蒋向辉等关于植物叶片DNA提取的改良CTAB法[5]提取金银花总DNA,用1%琼脂糖凝胶进行电泳检测。用4种不同的限制性内切酶(AatⅡ、BamH Ⅰ、ClaⅠ、FseⅠ,购自美国NEB公司)酶切基因组DNA,用1.5%琼脂糖凝胶电泳检测酶切结果。酶切产物采用DNA回收试剂盒进行回收纯化,在回收的DNA片段两头分别接上接头AD1(5′-GATCCGAGTGGCTTACAGCGATAG CGGATGACGGGACAGGTAGCTAATA-3′)和AD2(3′-H2N-CGGCTTGT-PO4-5′),构建4种不同酶切产物的Genome Walker DNA文库,分别命名为FNS-1、FNS-2、FNS-3和FNS-4。分别以4个不同的文库DNA为模板,进行巢式PCR扩增,第1轮PCR引物为接头引物AP1(5′-CTGCCGAGTGGCTTAGGCCAGT-3′)与特异性引物GSP1(L1:5′-AGGTTGCCGTTAGTTCCGGATTTGATT-3′和R1:5′-TCGCCGTGACCGGATGGTCGAAGTAGCT-3′),PCR扩增程序:94 ℃ 30 s,72 ℃ 5 min,5个循环;94 ℃ 30 s,67 ℃ 5 min,29个循环;67 ℃延伸5 min。用DNA回收试剂盒回收第1轮PCR产物,稀释50倍后,以此为模板进行第2轮PCR扩增,扩增引物为接头引物AP2(5′-TTACGGCTGATGGC TTTGA-3′)与特异性引物GSP2(L2:5′-GTACGTGATT AGCCAGTAGGACGTGGA-3′和R2:5′-TTGCAGGGTCA GGTAAAGTGTGGTACG-3′),PCR扩增程序:94 ℃ 45 s,72 ℃ 3 min,5个循环;94 ℃ 45 s,65 ℃ 3 min,21个循环;65 ℃ 延伸5 min。同样采用DNA提取试剂盒回收第2轮PCR产物,将回收片段连接至T载体后送上海伯豪生物技术有限公司进行测序,将测序所得DNA序列提交至NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行序列比对并拼接,以拼接DNA序列为参考,设计LjFNS基因全长克隆引物LjFNS-F(5′-ATGTCTTGGCTTTATCTTTTAGACA-3′)、LjFNS-R(5′-AATACGATAGAATGCGGAACTCG-3′),进一步以金银花总DNA为模板扩增LjFNS基因全长序列。
1.2.2 编码序列预测与克隆 利用NCBI中的Blast分析软件,对克隆得到的LjFNS基因组序列进行比对,对编码序列进行预测。以金银花初开的花为材料,采用Invitrogen公司的TRIzol试剂盒提取金银花总RNA,并逆转录合成cDNA第1链,以cDNA为模板,用引物LjFNSF(5′-ATGTCTTGGCTTTA TCTTTTAGACA3′)、LjFNSR(5′-UUAACGATAGAATGCG GAACTAG-3′)对LjFNS基因的CDS全长进行克隆。
1.2.3 生物信息学分析 用DNAMAN软件与GENEDOC软件相结合进行LjFNS基因DNA序列的组成分析以及与相似基因的同源性比对分析。采用Protparam在线数据库预测LjFNS基因编码蛋白的氨基酸序列、分子量、等电点、稳定性和亲水性等理化性质;采用SignalP在线软件进行蛋白质的信号肽分析;采用Wolfpsort在线数据库进行LjFNS基因编码蛋白的亚细胞定位预测;采用TMHMM在线软件进行LjFNS基因编码蛋白跨膜结构域与功能域的分析。
1.2.4 组织表达特异性分析 采用Invitrogen公司的TRIzol试剂盒分别提取金银花幼叶、老叶、幼茎、绿蕾、白花和黄花的总RNA,并进行逆转录合成cDNA,用于实时荧光定量PCR分析。检测LjFNS基因表达的定量PCR引物为LjFNS-Q-F(5′-CGTACTCAAACTCACCGAAAG-3′)和LjFNS-Q-R(5′-GCATTCAATTGCTGTTCTCCTGT-3′)。以苜蓿β-Actin基因为内参,定量PCR引物为Actin-F(5′-AGGGAGTCGTGAAAGGTTGTC-3′)和Actin-R(5′-TTCCTGGTCTCGTAGTAGAGTTCG-3′)。采用购自TaKaRa公司的SYBR Premix ExTaqTM试剂盒,将各组织的cDNA稀释适当倍数(通常为100 ng/μL以下)作为模板,使用Mx3000P(Stratagene)荧光定量PCR仪进行qPCR反应,反应体系总体系为25 μL,其中SYBR Premix ExTaqTM(5×)5 μL,Rox Reference Dye Ⅱ(10×)2.5 μL,正反向引物(10 μmol/L)各0.5 μL,cDNA1 μL,ddH2O 16.5 μL,反应程序为95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,38个循环。qPCR检测重复5次,采用Mx3000P软件对结果进行处理分析。
2 结果与分析
2.1 LjFNS基因全长序列的克隆
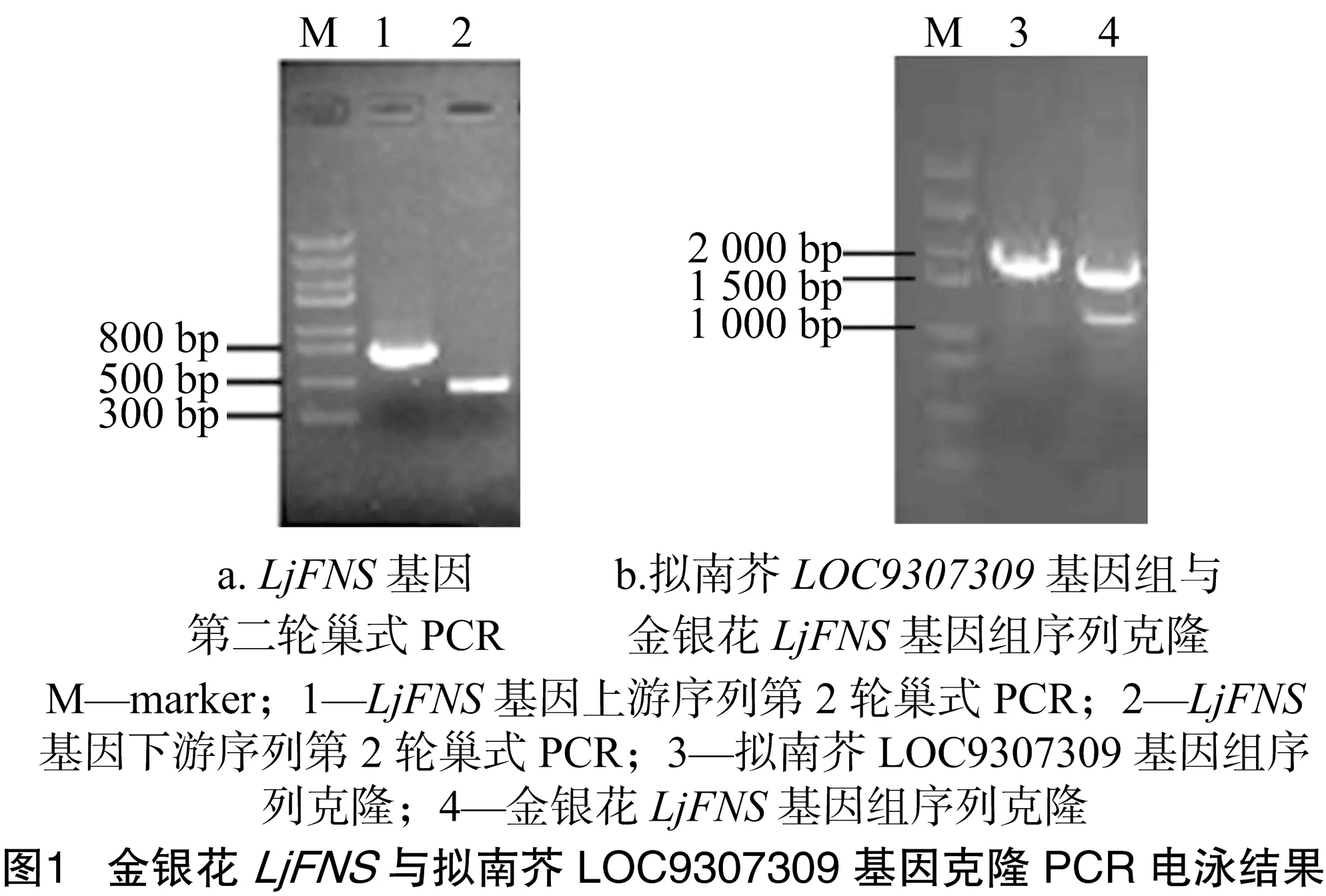
采用上游特异引物GSP1与接头引物AP1、下游特异引物GSP2与接头引物AP2,分别以4个酶切产物DNA文库为模板进行巢式PCR扩增,用文库FNS-1能扩增出上游的清晰条带,用文库FNS-2能扩增出下游的清晰条带(图1-a)。回收纯化PCR产物,利用特异引物GSP2和接头引物AP2进行测序。将克隆到的上游片段称为FNS-F,下游片段称为FNS-R,并将这2个DNA序列提交到NCBI数据库进行序列比对分析,其中下游片段与金银花LjFNS基因的中间序列(GenBank登录号:JQ716370.1)有重叠,随后将FNS-F、FNS-R与LjFNS基因的中间序列进行序列拼接,并将拼接结果在NCBI中进行序列比对,结果显示,此拼接序列与LOC9307309基因序列相似度达89%,推测此序列编码的基因可能是与拟南芥LOC9307309同源的基因,将其命名为LjFNS。
根据拼接序列设计得到LjFNS基因全长引物LjFNSF与LjFNSR,以金银花基因组DNA为模板,克隆得到1个全长为1 701 bp的序列(图1-b),其与拼接结果一致,证明克隆到的是金银花LjFNS基因全长序列。随后以金银花cDNA为模板,利用引物LjFNSF与LjFNSR进行扩增。对扩增片段进行测序,结果表明,PCR扩增到的目的片段含有1 593 bp完整开放阅读框(ORF),比其基因组序列少1段108 bp的内含子序列。此外,氨基酸序列相似度达89%。随后,利用GENEDOC多序列比对与分析软件对LjFNS与LOC9307309的CDS序列和氨基酸序列进行比对,由图2可以看出,LjFNS与LOC9307309的编码序列高度相似,推测LjFNS与LOC9307309是同源基因。
2.2 LjFNS基因生物信息学分析
利用NCBI中的Blast分析软件,对克隆得到的LjFNS基因组序列进行比对,结果显示,该基因组全长为1 701 bp,有2个内含子和3个外显子,编码序列长1 593 bp,编码530个氨基酸。LjFNS编码蛋白的理化性质预测显示,其蛋白序列长度为530个氨基酸,分子式为C2 676H4 223N737O735S25,含缬氨酸(Val)最多,占比达12.1%,不含吡咯赖氨酸(Pyl)、酪氨酸(Tyr)(表1),等电点(pI)为9.03,分子量为58.036 8 ku,其不稳定性系数为37.11(<50.00),通常归于稳定性蛋白一类,氨基酸残基侧链带完全正电荷的赖氨酸、精氨酸与组氨酸总和为69个,氨基酸残基侧链带完全负电的谷氨酸与天冬氨酸总和为54个,蛋白带正电荷,为碱性蛋白质。脂肪族氨基酸指数为57.49,芳香族氨基酸与杂环族氨基酸指数的总和为87.49,多环类氨基酸较多,这可能与其催化黄酮类物质的合成功能有关。LjFNS蛋白亲水性系数为 -0.062,该蛋白归于疏水性蛋白一类。用SignalP在线软件对LjFNS蛋白的信号肽分析发现,该蛋白中膜锚定信号较强,该蛋白属于膜蛋白。采用Wolfpsort在线软件对LjFNS蛋白进行亚细胞定位分析结果显示,该蛋白定位于叶绿体膜、内质网膜和液泡膜。采用TMHMM在线分析发现,LjFNS蛋白具有跨膜结构域,其跨膜区域定位于第112~138位氨基酸区域,而第17~32位氨基酸定位于膜内区域,其余氨基酸定位于膜外区域。用 SMART软件对LjFNS蛋白的功能域进行分析, 结果显示, 该蛋白含有亚铁血红素配合基结合位点,这是细胞色素P450家族的保守性区域,推测LjFNS蛋白属于细胞色素P450家族。

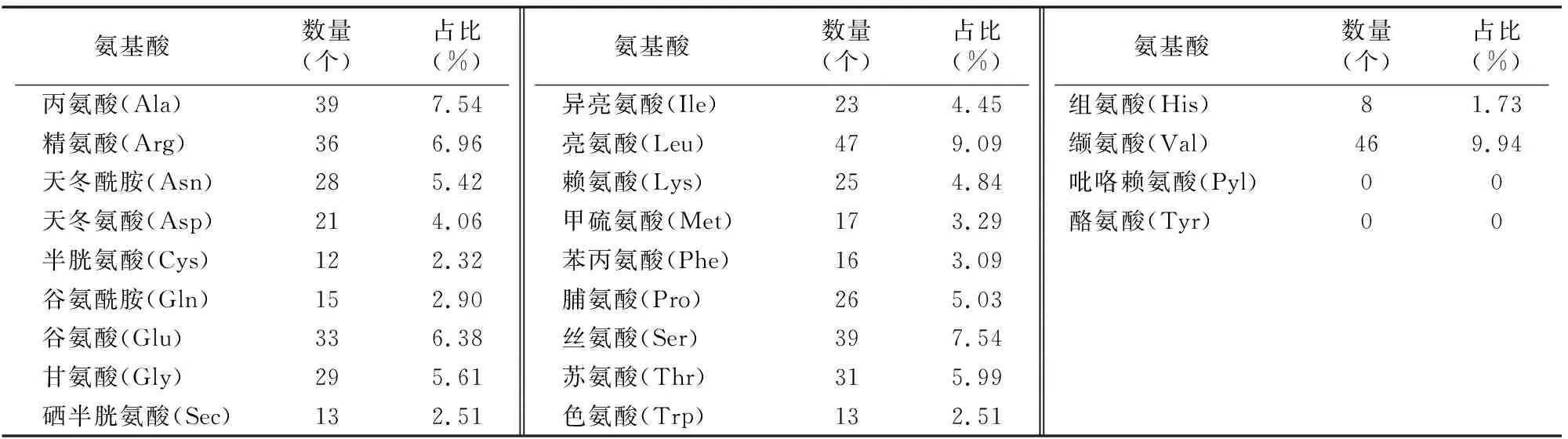
表1 LjFNS蛋白的氨基酸组成
2.3 LjFNS基因的组织特异性表达
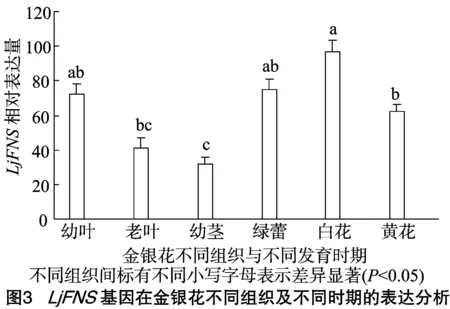
分别提取金银花幼叶、老叶、幼茎、绿蕾、白花和黄花的总RNA,用实时荧光定量PCR方法分析LjFNS基因在金银花的茎、叶和花等不同组织以及幼叶、白花与黄花等不同发育时期的表达特性。由图3可以看出,该基因在各个组织中均有表达,但在白花中的表达量最高,其次为绿蕾与幼叶中的表达量,在白花与黄花之间的表达量差异达到了显著水平(P<0.05)。在幼茎中LjFNS基因表达量最低,黄花中LjFNS基因表达量明显高于幼茎中的表达量,差异达到了显著水平(P<0.05)。由结果可知,LjFNS在金银花中的表达表现出组织表达特异性与时间表达特异性,该基因的表达可能与花的发育紧密相关。
3 讨论
植物细胞色素 P450 是最大的酶家族之一[6], 它们在植物的生长发育与次生代谢过程中起着十分重要的作用,近年来,随着对植物次生代谢机制研究的不断深入,越来越多的P450蛋白陆续被发现,植物P450蛋白在植物次生代谢产物的合成、逆境生理的调控中的作用越来越被重视[7-9]。但至目前为止,有关植物细胞色素P450蛋白方面的研究仍主要集中于相关基因的克隆及基因功能预测等方面,在P450功能鉴定与转基因方面的研究还相对较少,从已有的有关P450在植物次生代谢产物合成中的功能研究结果看出,植物P450主要参与生物碱、萜类、黄酮、脂肪酸等代谢产物的合成[10],近年来有关植物P450参与的植物体内代谢催化机制方面的研究也越来越多[11]。
细胞色素P450是一类含血红素结合亚基的多功能氧化酶[12],是分子量约为55 ku(40~60 ku)的血红素-硫铁蛋白,有1个特征性的血红素结合区域,主要为其C末端存在FxxGxRxCxG序列(其中x表示任意氨基酸)[6],通常依据此序列来判定未知蛋白是否属于P450家族。P450在生物体内主要以可溶性和与膜结合2种形态存在[13],从目前已经鉴定的植物P450蛋白来看,以内质网结合型蛋白为主,内质网结合型蛋白在氨基端有1个特征性的疏水性螺旋,该螺旋以亮氨酸为主,该螺旋将蛋白定位于内质网膜上[6]。黄酮合成酶属于植物细胞色素P450单加氧酶家族,它可以通过催化使圣草素转变为木犀草素,在金银花主要活性成分的合成中起着十分重要的作用[14]。
本研究采用改进的染色体步移方法,首次从金银花中克隆得到LjFNS的基因组和CDS序列,序列同源性分析表明,金银花LjFNS基因编码的CDS序列与拟南芥LOC9307309基因CDS序列相似度达89%。有研究表明,拟南芥LOC9307309属于细胞色素P450家族,它在调节植物器官发育方面起着非常重要的作用[15-16];还有研究表明,P450表达量的高低与黄酮类成分含量紧密相关[17],推测LjFNS基因的表达可能参与调控金银花黄酮类成分的合成。在本研究中采用qPCR的方法对LjFNS在金银花中的组织表达特异性与时间特异性的分析结果显示,LjFNS在白花中的表达量最高,该基因的表达可能与花的发育紧密相关。本研究从金银花中发现了1个新的细胞色素P450家族成员并进行了相关功能预测的表达特性分析,为进一步开展LjFNS在金银花的发育与有效成分合成过程中的功能研究奠定了基础。
参考文献:
[1]蒋向辉,冯仕彪. 金银花丙酮酸激酶基因的克隆与表达特性分析[J]. 西北植物学报,2015,35(12):2373-2378.
[2]Wu J,Wang X C,Liu Y,et al. Flavone synthases fromLonicerajaponicaandL.macranthoidesreveal differential flavone accumulation[J]. Scientific Reports,2016,6:19254.
[3]Li N,Ruan W H,Yang Y Y,et al. Research progress of componential analysis on honeysuckle[J]. Sci-Tech Information Development & Economy,2011,21:178-181.
[4]Gordon M H,Wishart K. Effects of chlorogenic acid and bovine serum albumin on the oxidative stability of low density lipoproteinsinvitro[J]. Journal of Agricultural and Food Chemistry,2010,58(9):5828-5833.
[5]蒋向辉,刘良科,佘朝文. 葛属11份种质基于核rDNA ITS序列的亲缘关系分析[J]. 江苏农业科学,2015,43(7):46-49.
[6]贺丽虹,赵淑娟,胡之璧. 植物细胞色素P450基因与功能研究进展[J]. 药物生物技术,2008,15(2):142-147.
[7]涂 珺,朱 平,程克棣. 植物细胞色素P450基因的异源表达系统研究进展[J]. 中国生物工程杂志,2003,23(7):32-37.
[8]Katsumata T,Fukazawa J,Magome H A,et al. Involvement of the CYP78A subfamily of cytochrome P450 monooxygenases in protonema growth and gametophore formation in the mossPhyscomitrellapatens[J]. Bioscience Biotechnology and Biochemistry,2011,75(2):331-336.
[9]Mizutani M,Ohta D. Diversification of P450 genes during land plant evolution[J]. Annual Review of Plant Biology,2010,61(1):291-315.
[10]Schuler M A. Plant cytochrome P450 monooxygenases[J]. Critical Review in Plant Sciences,1996,15(3):235-284.
[11]杨致荣,毛 雪,杨致芬,等. 细胞色素P450基因及其在植物改良中的应用[J]. 遗传,2003,25(2):237-240.
[12]赵 剑,杨文杰,朱蔚华. 细胞色素P450与植物的次生代谢[J]. 生命科学,1999,11(3):127-131.
[13]Kort E F,Kvesitadze G,Ugrekhelidze D. Organic toxicants and plants[J]. Ecotoxicology and Environmental Safety,2000,47:1-26.
[14]郭欣慰,黄丛林,吴忠义,等. 植物类黄酮生物合成的分子调控[J]. 北方园艺,2011(4):204-207.
[15]Wang J W,Schwab R,Czech B,et al. Dual effects of miR156-targetedSPLgenes and CYP78A5/KLUH on plastochron length and organ size inArabidopsisthaliana[J]. The Plant Cell,2008,20(5):1231-1243.
[16]Eriksson S,Stransfel D L,Adamski N M. KLUH/CYP78A5-dependent growth signaling coordinates floral organ growth inArabidopsis[J]. Current Biology,2010,20(6):527-532.
[17]Durst F,Nelson D R. Diversity and evolution of plant P450 and P450-reductases[J]. Drug Metabolism and Drug Interactions,1995,12(3):189-206.
