母体因素导致妊娠晚期胎儿生长受限的预测及新生儿转归
2018-06-07韩素慧
黄 隽,韩素慧
(中日友好医院 妇产科,北京 100029)
胎儿生长受限 (fetal growth restriction,FGR)是产科常见并发病,其发生率各家报道不一,在3%~10%左右,是继早产导致新生儿死亡及严重并发症的第二大主要原因,并且FGR与成年后神经发育水平、心血管疾病、内分泌疾病的发生发展相关。由于目前对于FGR的早期诊断缺乏敏感和特异性指标,治疗方面无明显有效手段,因此,增加对其影响因素尤其是可改变因素的研究,对早期诊断、干预并改善FGR预后并减少医疗财政开支等方面有重要意义[1~3]。
1 资料和方法
1.1 研究对象
选取中日友好医院产科2013年10月~2017年10月进行规律产检并分娩的妊娠晚期FGR患者 (新生儿出生体重低于相应孕周胎儿体重的第十百分位数)47例、孕期拟诊FGR分娩后排除产妇 (新生儿出生体重高于相应孕周胎儿体重第十百分位数)42例、对照组产妇(孕期胎儿生长发育符合孕周,新生儿出生体重在第十到第九十百分位数之间)45例。研究对象纳入标准:(1)中国籍,在我院规律产检并分娩孕产妇;(2)无吸烟、酗酒、毒品史;(3)单胎。 除外标准:(1)胎儿或者新生儿染色体异常或存在重大畸形。(2)有明确宫内感染证据者。(3)合并帆状胎盘者。
1.2 评价指标和方法
收集临床资料及相关检验结果。符合入选标准的孕产妇收集其基本资料,包括年龄、身高、孕前体重、孕期体重增长、孕期合并症、孕期并发症,孕晚期白蛋白、前白蛋白、纤维蛋白原,新生儿Apgar评分、是否入住儿科、新生儿合并症以及儿科住院时间。
1.3 统计学方法
统计学分析应用SPSS 19.0软件,计量资料组间比较采用t检验或者秩和检验,以最低位优先法(LSD)行两两比较。计数资料比较采用卡方检验,同时行二元非条件Logistic回归分析。

表1 各组母体因素比较
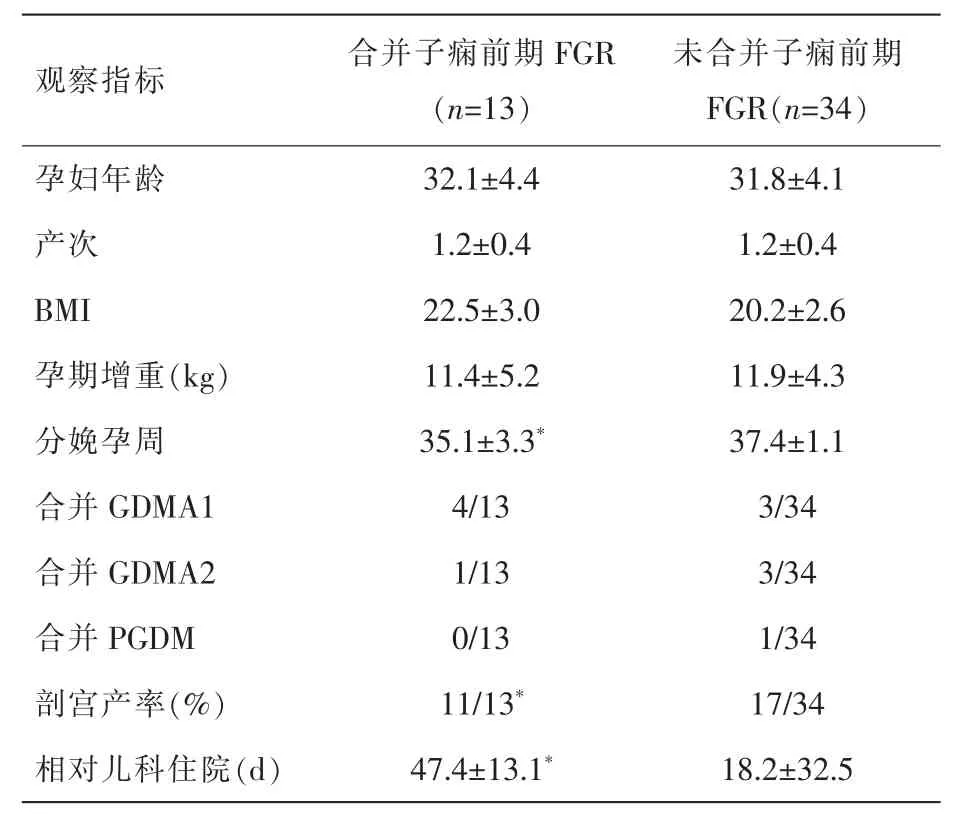
表3 合并/未合并子痫前期FGR组内比较
2 结果
2.1 各组孕产妇母体情况
表1示,FGR组与疑诊FGR组、非FGR组相比较,其年龄、体重指数(body mass index,BMI)、分娩孕周、剖宫产率、子痫前期发生率、PGDM或GDMA2发生率均有显著性差异(均P<0.05)。疑诊FGR组与非FGR组相比,BMI显著降低 (P<0.05),其他指标二者无统计学差异(均 P>0.05)。
2.2 各组之间新生儿预后评估
新生儿总体预后评价指标参考文献[4],本研究主要采用新生儿住院时间来评估,同时对于新生儿死亡、合并新生儿缺血缺氧性脑病、新生儿重度窒息(新生儿1min Apgar评分≤3分或者5min≤5分者[5])等同于最长住院时间来调整为相对住院时间。具体见表2。
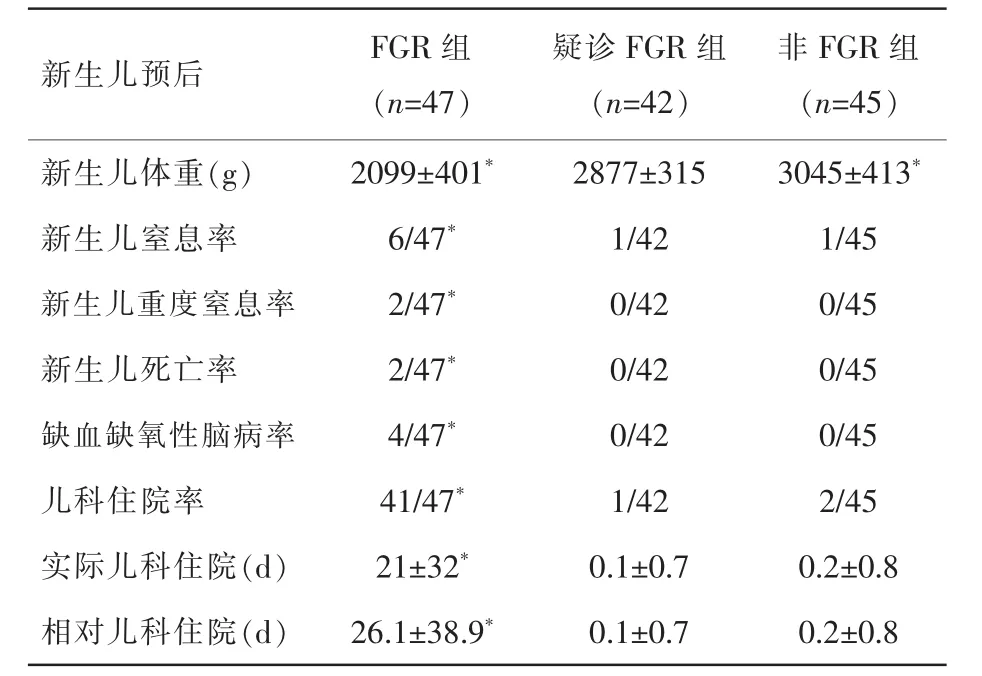
表2 新生儿预后比较
表4 各组间白蛋白相关检测结果比较 (x±)

表4 各组间白蛋白相关检测结果比较 (x±)
注:与疑诊FGR组相比,*P<0.05;与未合并子痫前期相比,#P<0.05。
检测指标非FGR组(n=45)合并子痫前期(n=13) 未合并子痫前期(n=34)FGR组(n=47) 疑诊FGR组(n=42)白蛋白(g/L) 34±2# 37±4 35±2 36±3前白蛋白(mg/L) 190±43 190±32 172±26 198±40*纤维蛋白原(g/L) 4.4±1.0 4.7±0.6 4.9±0.8 4.6±1.0
与疑诊FGR组相比较,FGR组新生儿体重、窒息率、新生儿死亡、新生儿严重并发症、儿科住院率及住院时间明显较差,即FGR组新生儿预后较差(P<0.05)。疑诊FGR组与非FGR组仅新生儿出生体重有统计学差异,但是新生儿预后无统计学差异。
2.3 FGR组内比较
表3示,合并子痫前期FGR组与未合并子痫前期FGR相比,分娩孕周更小,剖宫产率更高,相对儿科住院天数越多,即新生儿预后更差 (P<0.05),二者间年龄、产次、BMI、孕期增重、合并糖尿病情况无显著性差异(均P>0.05)。
2.4 各组白蛋白、前白蛋白、纤维蛋白原水平比较
表4示,FGR组、非FGR组患者前白蛋白水平均明显高于疑诊FGR组,有统计学差异 (P<0.05),FGR组与非FGR组前白蛋白无统计学差异(P>0.05);合并子痫前期FGR患者白蛋白水平明显低于非合并子痫前期FGR组,二者有统计学差异(P<0.05),FGR 组、疑诊 FGR 组、非 FGR 组三组之间白蛋白无统计学差异(P>0.05)。纤维蛋白原在各组之间均无统计学差异(P>0.05)。
2.5 发生FGR的高危因素
以是否发生FGR作为因变量,在FGR组和非FGR组之间有统计学差异的5个母体因素,分别为孕妇年龄、BMI、合并子痫前期、合并GDMA2或PGDM、前白蛋白水平作为自变量进行二分类非条件Logistic回归分析,结果显示合并子痫前期(OR=5.87,95%CI 1.397~30.822)和低前白蛋白水平(OR 3.08,95%CI 1.354~7.932)是 FGR 的高危因素。
3 讨论
3.1 FGR相关影响因素分析
胎儿生长受限的影响因素主要有3个方面:胎儿因素,包括胎儿畸形、染色体异常、感染、多胎等;胎盘因素,包括胎盘梗死、帆状胎盘、胎盘绒毛血管瘤等;母体因素,包括药物滥用、营养不良、妊娠期高血压相关疾病、糖尿病、心血管疾病、自身免疫疾病等[6]。我们的研究着重在孕晚期胎儿生长受限的母体因素分析,尽可能排除了胎儿因素及部分胎盘因素,同时排除了药物滥用者,主要研究母体合并症。
3.2 FGR与妊娠期高血压相关疾病
妊娠合并症中,合并子痫前期是胎儿生长受限预后不良的重要因素,在本研究中合并子痫前期FGR占总体的近30%。子痫前期是孕产妇死亡的主要原因之一,以孕34周为界分为早发型子痫前期(5%~20%)和晚发型,越来越多的研究表明二者病因学不同,早发型子痫前期多合并FGR,也可以FGR为首发表现,临床表现更重且新生儿预后较差,这与我们的研究是相符合的,同时国外研究表明,合并子痫前期FGR的新生儿发育到2岁其认知功能、神经发育较其他FGR幼儿差[4]。根据Huppertz等的胎盘形成病因假说,子痫前期、胎儿生长受限、自发性流产都是滋养细胞分化与侵袭异常导致的疾病[7],这些发生在孕早期,为疾病的早期预测及干预提供了理论假说和研究基础。目前,关于甲胎蛋白、可溶性Fms样酪氨酸激酶-1、胎盘生长因子以及其他新标记物预测FGR研究逐渐增多,但荟萃分析表明尚没有敏感性、特异性满意的预测指标可以应用于临床。这些血清标志物结合临床特征、超声指标协同预测FGR以及通过研究FGR病因学寻找新的标志物还是很有前景的[8,9]。同时,因为早发子痫前期与FGR的密切关系是否意味着已经在子痫前期中研究的较为成熟的分子通路、方法以及子痫前期的治疗有些也可以应用到FGR上,是值得探讨和深入研究的问题。
在临床工作中,我们需要时刻警惕子痫前期并发FGR,且发生顺序不定,所以对于早发的FGR在保守观察期需警惕子痫前期的出现,而子痫前期患者则严密监测其胎儿生长发育、脐血流、羊水等情况。
3.3 FGR与其他母体合并症
除子痫前期外,本研究中可发现,FGR组与疑诊FGR组、非FGR组总体合并糖尿病例数是无统计学差异的,但FGR组合并GDMA2、PGDM与其他2组有统计学差异;且在FGR组内,非合并子痫前期FGR患者合并GDMA2、PGDM例数多于合并子痫前期FGR组。这可能与糖尿病为母体全身微血管病变,严重到一定程度后同时累及胎盘绒毛浅植入导致胎盘功能低下进而影响胎儿生长发育有关[10]。由于合并糖尿病的例数有限,不能得到统计学差异,具体有待进一步研究。本研究中,FGR组内自身免疫疾病、心血管疾病较少,未分别统计。
3.4 相关检验结果讨论
白蛋白、前白蛋白、纤维蛋白原均是营养状态的不同评估指标,白蛋白是常用的营养评价指标,但是因为血清白蛋白的半衰期长,一般是21d,同时受到血管通透性疾病等的影响,如子痫前期,所以用来评估孕妇营养状况有一定误差,但是白蛋白低通常是疾病预后不良、较晚期的指标[11,12],这与我们的研究中,合并子痫前期FGR组与未合并子痫前期组有统计学差异这点相符合。
前白蛋白也是营养状态评估指标,因其半衰期短,2.1d左右,能迅速反应营养摄入效果,在老年人营养评估、心衰、肿瘤晚期等患者预后评估等方面已有相关研究[13,14],但目前对于前白蛋白在产科营养评估中应用的相关文章很少。我们实验结果表明,前白蛋白在FGR组、非FGR组、疑诊FGR组之间有显著性差异,这就意味着我们在产检过程中宫高腹围增长不满意或胎儿偏小的一部分孕妇是近期营养不良造成的,加强营养后胎儿可明显增长,而FGR组孕妇的前白蛋白水平与非FGR组相比是不低的,也说明造成FGR的因素大部分与外在营养关系不大,更多是相关合并症或者胎盘等内在性问题导致。于是我们推测,拟诊FGR产妇如果同时合并前白蛋白水平较低,加强营养后白蛋白上升明显,日后发生FGR的风险相对低,而对于前白蛋白水平不低的拟诊FGR产妇更需关注,警惕妊娠合并症如子痫前期存在的可能。除此之外,前白蛋白对于妊娠合并糖尿病孕妇控制饮食过程中的营养评估也可能是很好的指标。但是作为肝脏合成的快速转运蛋白,前白蛋白除了营养之外,还受感染、肝肾功能等其他因素的影响,所以将前白蛋白作为评估孕妇营养状况的指标还需要进一步探究。
纤维蛋白原虽然也是营养指标,但可能因为孕产妇高凝状态等混淆因素较多,在各组未见显著性差异,这与其他研究也符合。
子痫前期是FGR新生儿预后不良的重要母体因素,及早发现FGR是子痫前期患者高危管理的重要环节。前白蛋白在评估孕妇特别是拟诊FGR孕妇的营养状况及预测FGR发生等方面值得关注。
[1]Swanson AM,David AL.Animal models of fetal growth restriction:Considerations for translational medicine.[J].Placenta,2015,36(6):623-630.
[2]Devaskar SU,Chu A.Intrauterine growth re striction:Hungry for an answer[J].Physiology,2016,31(2):131-146.
[3]American College of Obstetricians and Gynecologists.ACOG Practice bulletin no.134:fetal growth restriction[J].Obstet Gynecol,2013,121(5):1122-1133.
[4]Kovo M,Schreiber L,Elyashiv O,et al.Pregnancy outcome and placental findings in pregnancies complicated by fetal growth restriction with and without preeclampsia[J].Reproductive Sciences,2015,22(3):316-321.
[5]中华医学会围产医学分会.新生儿窒息诊断的专家共识[J].中华围产医学杂志,2016,19(1):3-6.
[6]Kanwal Gujral,Sakshi Nayar.Current trends in management of fetal growth restriction[J].J Fetal Med,2014,1:125-129.
[7]Huppertz B.Placental origins of preeclampsia challenging the current hypothesis[J].Hypertension,2008,51(4):970-975.
[8]Conde-AgudeloA,Papageorghiou AT,KennedySH,etal.Novel biomarkers for predicting intrauterine growth restriction:a systematic review and meta-analysis[J].Bjog,2013,120(6):681-694.
[9]Bakalis S,Peeva G,Gonzalez R,et al.Prediction of smallfor-gestational-age neonates:screening by biophysical and biochemical markers at 30-34 weeks[J].Ultrasound in Obstetrics&Gynecology,2015,46(2):208-215.
[10]王子莲,陈汉青.妊娠合并糖尿病与死胎[J].中国实用妇科与产科杂志,2017,33(11):1125-1128.
[11]童桂兰,杨沛华,刘春文,等.血清前白蛋白的临床应用价值[J].中国中西医结合消化杂志,2012,20(5):232-234.
[12]Cederholm T,Bosaeus I,Barazzoni R,et al.Diagnostic criteria for malnutrition-An ESPEN Consensus Statement[J].Clinical Nutrition,2015,34(3):335-340.
[13]Cai W,Kong W,Dong B,et al.Pretreatment serum prealbumin as an independent prognostic indicator in patients with metastatic renal cell carcinoma using tyrosine kinase inhibitors as first-line target therapy[J].Clinical Genitourinary Cancer,2017,15(3):e437-e447.
[14]Franco J,Formiga F,Trullas JC,et al.Impact of prealbumin on mortality and hospital readmission in patients with acute heart failure [J].European Journal of Internal Medicine,2017,43:36-41.
