C6-HSL对蜂房哈夫尼菌生物学特性的影响
2018-06-06牛彤鑫张公亮侯红漫
◎ 刘 丽,牛彤鑫,张公亮,侯红漫
(大连工业大学食品学院,辽宁 大连 116034)
蜂房哈夫尼菌(Hafnia alvei)是一种革兰氏阴性菌,具有运动性,有鞭毛,是一种兼性厌氧菌[1]。该菌有类似于费氏弧菌的群体感应系统[2],能够产生信号分子AHL[3],通常在存在于自然环境中,尤其是土壤和污水中[4],能够从冷藏的牛奶、肉制品以及鱼肉中分离获得[5-7],能够产生硫化氢[8],酸性气味[9],是导致食品腐败变质、影响风味和贮藏时间的重要因素。蜂房哈夫尼菌能够在低温环境中生长[1,10],是导致冷藏食品变质的主要腐败菌之一。
细菌的群体感应是细菌根据细胞密度变化进行基因表达调控的一种生理行为[9],细菌通过产生信号分子,信号分子将与受体蛋白结合,从而调控细菌相关基因的表达,使细菌有效抵御外界不利环境[11]。近年来,一些研究表明许多食品腐败和致病性生物体,如大肠杆菌O157、肠道沙门氏菌、铜绿假单胞菌都受到QS系统的调控,产生许多生理特征,包括产生色素、群集运动、生物被膜形成、分泌毒素以及生产降解酶等[12]。但是外源同种信号分子对于细菌生理特性的研究较少,人们对于外源信号分子对细菌生理特性的调控机制了解有限。
因此,本试验研究了蜂房哈夫尼野生株以及LuxI基因缺失株(ΔLuxI)所产生信号分子的成分及含量,通过外源添加不同浓度的C6-HSL来研究信号分子对蜂房哈夫尼菌野生株以及ΔLuxI菌体生长、泳动能力、生物膜形成的影响,为进一步揭示蜂房哈夫尼菌群体感应作用机制提供帮助。
1 材料与方法
1.1 材料与试剂
蜂房哈夫尼菌野生株,分离自即食海参;LuxI基因缺失株,(ΔLuxI)由实验室构建成功(培养时需添加20 μg/mL卡那霉素);C6-HSL,Sigma公司;乙酸乙酯,天津市东丽区天大化学试剂厂;甲酸,Aladdin-阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
UV 2102 型紫外分光光度计[岛津(上海)仪器有限公司]、SpectraMax M2多功能酶标仪[美谷分子仪器(上海)有限公司]、1260高效液相色谱[安捷伦科技(中国)有限公司]、Sorvall ST 16R高速冷冻离心机[赛默飞世尔科技(中国)有限公司]。
1.3 蜂房哈夫尼菌内源信号分子的测定
1.3.1 AHLs粗提液的制备
蜂房哈夫尼菌野生株及LuxI基因缺失株(ΔLuxI)于LB培养基中30 ℃、150 r/min培养后,4 ℃、8 000 r/min离心10 min,将上清液浓缩后与酸化的乙酸乙酯(含0.5%的甲酸)混匀,25 ℃、180 r/min振荡3 h。静置将水相和有机相完全分开,收集有机相,使用旋转蒸发器40 ℃将有机相蒸干。用1 mL超纯水溶解提取物,经0.22 μm滤膜无菌过滤,于-20 ℃保存。
1.3.2 高效液相色谱检测AHLs含量
采用黄旭镇等[13]的方法并略作修改,采用安捷伦1260高效液相色谱进行分析。液相色谱条件:安捷伦ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm),流速1.0 mL/min,进样量10 μL,分析时间25 min,柱温30 ℃,流动相为乙腈∶水(0~2 min,10%~10%乙腈;2~3 min,10%~5%乙腈;3~5 min,5%~5%乙腈;5~6 min,5%~15 %乙腈;6~15 min,15%~15%乙腈;15~20 min,15%~30%乙腈;20~25 min,30%~50%乙腈)。标准品为C6-HSL。
1.4 细菌生长曲线的测定
将冻存于-80 ℃的蜂房哈夫尼菌野生株及LuxI基因缺失株(ΔLuxI)活化2次后,30 ℃培养16 h备用(后文中的菌液均指蜂房哈夫尼菌野生株以及LuxI基因缺失株ΔLuxI)。将C6-HSL用纯净水稀释备用。按照4、8、16、32 μmol/L和64 μmol/L的比例分别添加到LB培养基中,以没有添加C6-HSL的培养基作为空白对照。将菌液1∶100倍稀释接种到上述LB培养基中,于30 ℃、150 r/min培养,每隔4 h检测OD600值。
1.5 菌体泳动能力的测定
参照Cong等[14]和Hidalgo等[15]的方法并做适当修改,利用软琼脂平板法测定各时间段培养菌液的泳动能力。群体泳动性(swarming)平板的配方为0.3%的琼脂粉加到LB培养基中。将C6-HSL按照4、8、16、32 μmol/L和64 μmol/L的比例分别添加到LB软琼脂平板中,以没有添加C6-HSL的软琼脂平板作为空白对照。将培养16 h的菌液用移液枪吸取3 μL点到上述软琼脂平板中心位置,于室温静置30 min。待菌悬液充分吸收,将群体泳动性平板置于30 ℃培养72 h,分别于24、48、72 h测定菌株扩散圈的直径。以扩散群直径代表菌体泳动能力。
1.6 生物膜的制备和测定
将C6-HSL按照4、8、16、32 μmol/L和64 μmol/L的比例分别添加到LB培养基中,以没有添加C6-HSL的培养基作为空白对照。将培养好的菌液1∶100倍稀释后添加到96孔板中。将做好的96孔板置于30 ℃生化培养箱中培养24 h,取出96孔板振荡混合后测定OD600值,而后进行生物膜测定。
弃96孔板中菌悬液,向每孔添加250 μL PBS清洗3次,之后加250 μL无水甲醇固定15 min后弃之,常温风干,用0.1 %的结晶紫250 μL染色15 min后弃之,并用去离子水冲洗,自然风干后,用33 %的冰醋酸200 μL溶解,测OD590值[16]。
1.4 数据处理和统计分析
实验结果用平均数±标准差(x-±SD)表示,使用SPSS 22.0软件进行数据方差分析及多重比较。
2 结果与分析
2.1 蜂房哈夫尼菌野生株分泌C6-HSL含量的变化
随着蜂房哈夫尼菌的生长,培养上清液中的C6-HSL不断增加,在稳定期达到最高含量16.1 μmol/L。在细菌达到衰亡期时,C6-HSL含量急剧下降,其中20 h下降约52%,24 h下降约97%,基本不产生C6-HSL(如图1所示)。随着细菌浓度的增加,铜绿假单胞产生AHLs含量逐步增加,在12 h达到最高[13]。铜绿假单胞菌、荧光假单胞菌以及恶臭假单胞菌随培养时间的不同,各类AHLs信号分子均呈现由递增至递减的规律[17]。
LuxI基因缺失株的生长状况与蜂房哈夫尼菌野生株相似,但是没有检测到C6-HSL,说明LuxI基因控制C6-HSL的产生。因此LuxI基因缺失株ΔLuxI可以用于后续实验研究。
2.2 C6-HSL对蜂房哈夫尼菌生长的影响
检测添加不同浓度C6-HSL的蜂房哈夫尼的生长情况,结果如图2所示。与阴性对照(不添加C6-HSL)相比,添加C6-HSL对蜂房哈夫尼菌野生株的生长影响效果不大。这与Patzelt D[18]等人的研究结果相一致,信号分子对于菌体的生长的影响与信号分子的种类浓度有关,短链的高丝氨酸内酯对于细菌的生长影响很小。C6-HSL对LuxI基因缺失株生长的影响效果也很小,如图3所示。
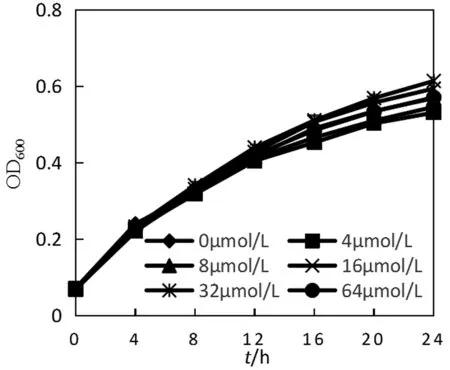
图2 C6-HSL对蜂房哈夫尼菌野生株生长的影响图
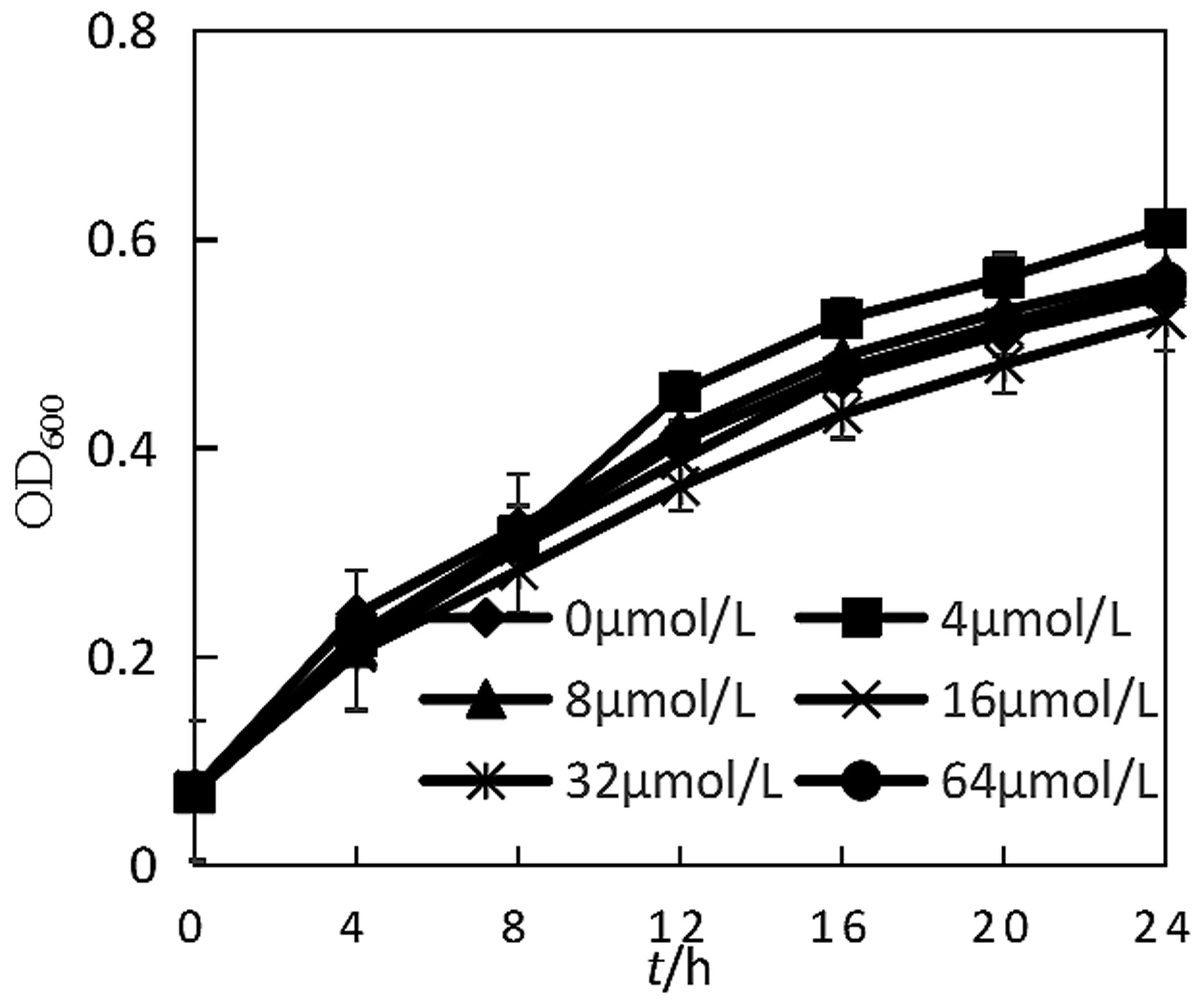
图3 C6-HSL对LuxI基因缺失株生长的影响图
2.3 C6-HSL对蜂房哈夫尼菌泳动性的影响
由图4与图5对比可以发现,缺失LuxI基因后蜂房哈夫尼菌的泳动能力减弱。随C6-HSL添加量(0~16 μmol/L)的增加,蜂房哈夫尼菌野生株及LuxI基因缺失株的泳动能力呈现上升的趋势,且这种现象随时间的延长愈发明显。但当C6-HSL持续增加(16~64 μmol/L)时,蜂房哈夫尼菌野生株及LuxI基因缺失株的泳动能力出现一定程度的下降。说明C6-HSL对蜂房哈夫尼菌泳动性的影响也在一定程度上受到添加量调控。同样,AHL对鼠伤寒沙门氏菌群体泳动性的影响受添加量调控[19]。而LuxI基因缺失株加入C6-HSL后同样要比蜂房哈夫尼菌野生株的泳动性弱,因此推测可能是由于LuxI基因的缺失,导致某些基因表达的改变进而影响菌体的运动能力。LuxI基因对泳动性起正调控作用,而C6-HSL可以促进蜂房哈夫尼菌的泳动性。
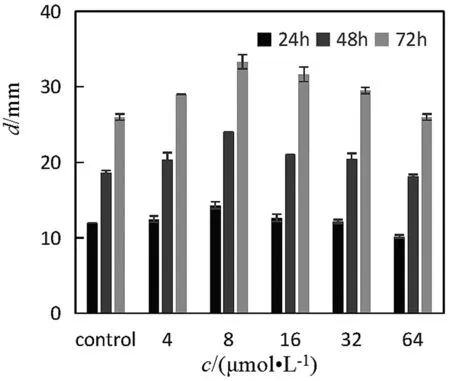
图4 C6-HSL对蜂房哈夫尼菌野生株泳动性的影响图
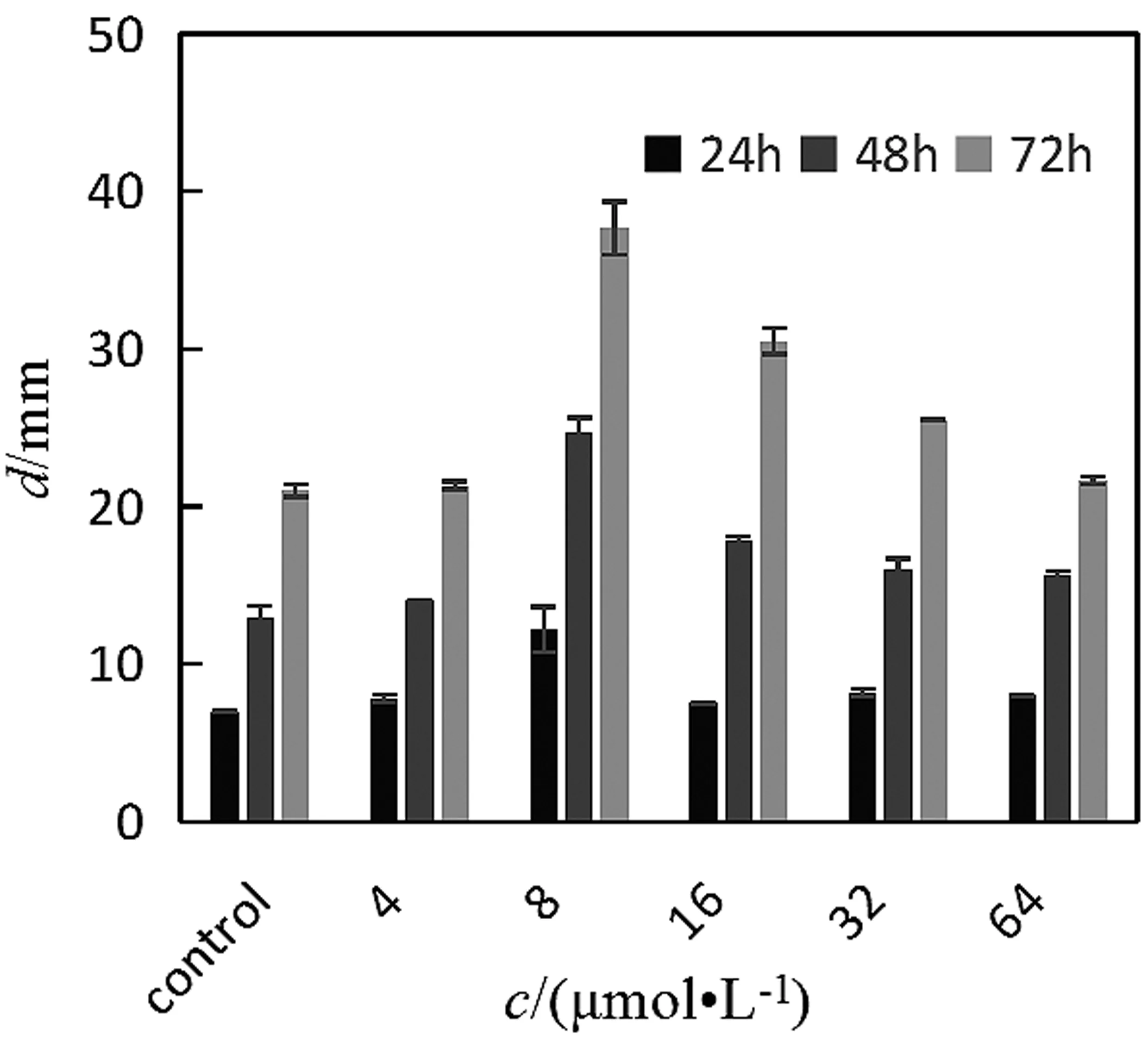
图5 C6-HSL对LuxI基因缺失株泳动性的影响图
2.4 C6-HSL对蜂房哈夫尼菌生物膜形成的影响
由图6可见,LuxI基因缺失株生物膜形成能力比野生型要高。不同浓度的C6-HSL对蜂房哈夫尼菌生物膜形成均有抑制作用,且随C6-HSL添加浓度的增加,抑制作用呈现先下降后上升的趋势。当外源添加16 μmol/L C6-HSL时,蜂房哈夫尼菌的生物膜形成量最低。但在添加C6-HSL之后迅速下降,随着浓度的增加依然呈现先下降后上升的趋势。当AHLs浓度为0.68 ng/mL时,假单胞的生物被膜形成能力无影响,但当浓度等于或者高于2.03 ng/mL时生物膜形成能力降低[20]。贾坤等[19]发现不同AHL添加量对鼠伤寒沙门氏菌生物膜形成均有一定抑制作用,且随着AHL添加量的增加,其抑制作用显著加强。外源AHLs(C4-HSL、C6-HSL)能够抑制沙雷氏菌以及气单胞菌生物膜的形成[21]。由此推断,LuxI基因对生物膜的形成起负调控作用,同样C6-HSL对对生物膜的形成起抑制作用。
值得注意的是,本次研究中C6-HSL促进蜂房哈夫尼菌的泳动性,但是抑制菌体的生物膜形成。生物膜的形成与细菌的鞭毛、纤毛、群体感应信号分子等具有密切关系,这与鞭毛的运动性对生物膜形成的负调控研究结果相一致,不少细菌的运动性对其表面黏附作用存在抑制作用。研究发现SadB蛋白缺陷菌株鞭毛运动能力增强,生物膜的形成能力反而下降[23]。由此推断是C6-HSL促进蜂房哈夫尼菌的鞭毛运动能力,从而使细菌表面的黏附作用降低,使得检测到的细胞膜含量降低。但是具体原因还需要进一步研究。
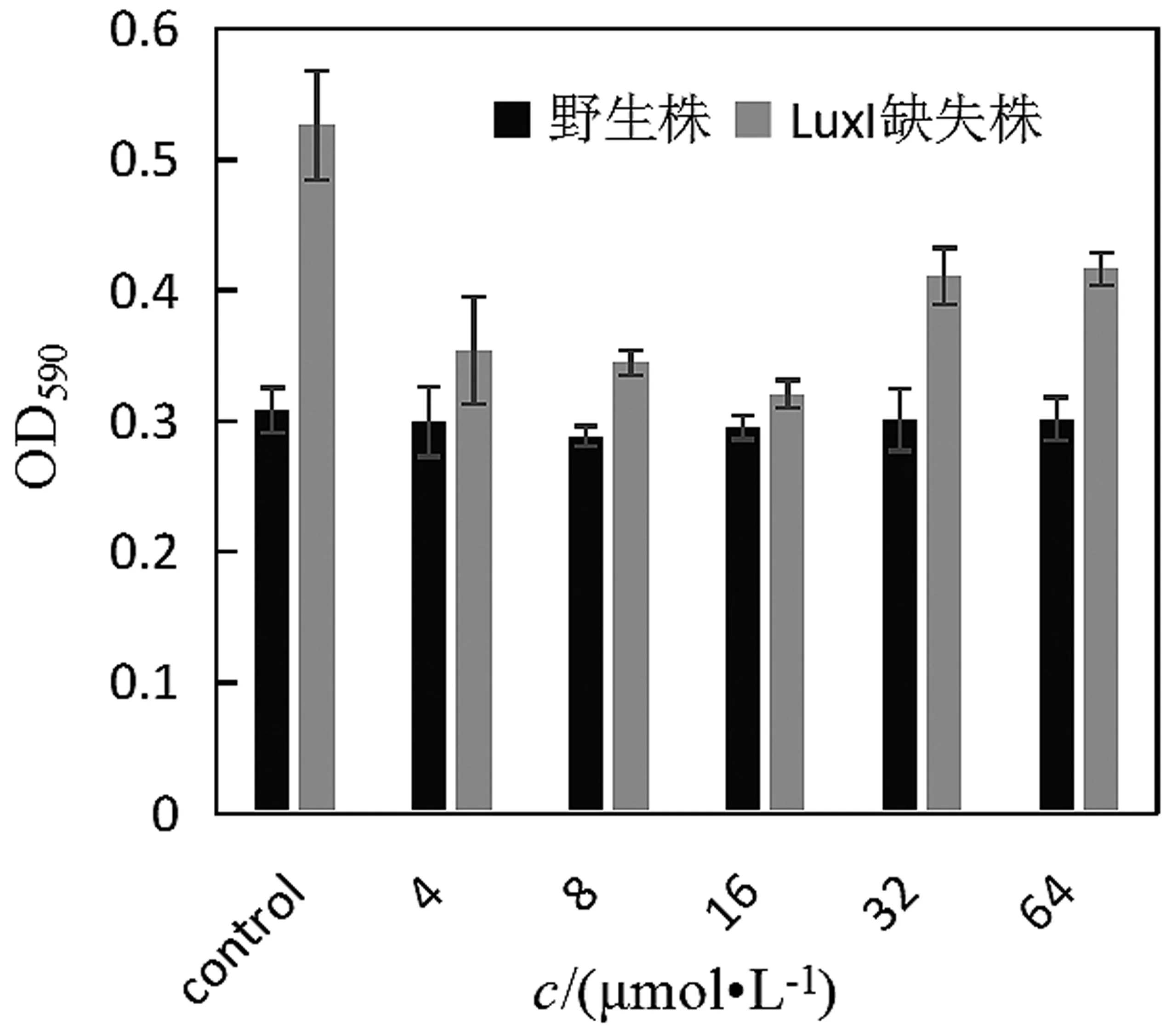
图6 C6-HSL对蜂房哈夫尼菌野生株以及LuxI基因缺失株生物膜形成的影响图
3 结论
蜂房哈夫尼菌群体感应信号分子C6-HSL由LuxI基因控制产生,C6-HSL对菌体的生长影响不明显,但对菌体泳动性有明显的促进作用,而对生物膜的形成具有抑制作用。目前,蜂房哈夫尼菌群体感应的研究还十分有限,从整体上阐明群体感应的作用机制是今后的主要研究方向。
[1]JR JEK, Oblinger J L, West RL. Fate of salmonella infantis, staphylococcus aureus, and hafnia alvei in vacuum packaged beef plate pieces during refrigerated storage[J]. Journal of Food Science,1980,45(5):1273-1277.
[2]Gram L, Christensen AB, Ravn L, et al.Production of acylated homoserine lactones by psychrotrophic members of the Enterobacteriaceae isolated from foods[J]. Applied & Environmental Microbiology,1999,65(8):3458-3463.
[3]Bruhn J B, Christensen A B, Flodgaard L R,et al. Presence of acylated homoserine lactones(AHLs) and AHL-producing bacteria in meat and potential role of AHL in spoilage of meat[J].Applied & Environmental Microbiology,2004,70(7):4293-4302.
[4]CHEN T R,WEI Q K,CHEN Y J. Pseudomonas spp. and Hafnia alvei growth in UHT milk at cold storage[J]. Food Control,2011,22(5):697-701.
[5]Liu M, Gray J M, Griffiths M W. Occurrence of proteolytic activity and N-acyl-homoserine lactone signals in the spoilage of aerobically chill-stored proteinaceous raw foods[J].Journal of Food Protection,2006,69(11):2729-2737.
[6]Viana E S,Campos M E M, Ponce A R,et al.Biofilm formation and acyl homoserine lactone production in Hafnia alvei isolated from raw milk[J]. Biological Research,2009,42(4):427-436.
[7]Säde E, Murros A, Björkroth J. Predominant enterobacteria on modified-atmosphere packaged meat and poultry[J].Food Microbiology,2013,34(2):252-258.
[8]Hanna M O,Smith G C,Hall L C,et al. Role of Hafnia alvei and a lactobacillus species in the spoilage of vacuum-packaged strip loin steaks[J].Journal of Food Protection,1979,42(7):569-571.
[9]Fuqua W C,Winans S C,Greenberg E P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. Journal of Bacteriology,1994,176(2):269-275.
[10]Ridell J, Korkeala H. Minimum growth temperatures of Hafnia alvei and other Enterobacteriaceae isolated from refrigerated meat determined with a temperature gradient incubator[J]. International Journal of Food Microbiology,1997,35(3):287-292.
[11]Holden M T,Ram C S,De N R,et al. Quorumsensing cross talk: isolation and chemical characterization of cyclic dipeptides from Pseudomonas aeruginosa and other gram-negative bacteria[J]. Molecular Microbiology,2010,33(6):1254-1266.
[12]Zhang J,Rui X,Wang L,et al. Polyphenolic extract from Rosa rugosa, tea inhibits bacterial quorum sensing and biofilm formation[J].Food Control,2014,42(2):125-131.
[13]黄旭镇,朱军莉,赵二科,等.LC-MS/MS检测水产品源致病菌和腐败菌群体感应AHLs信号分子[J].水产学报,2014,38(7):1040-1046.
[1 4]C o n g Y,W a n g J,C h e n Z,e t a l.Characterization of swarming motility in Citrobacter freundii[J].Fems Microbiology Letters,2011,317(2):160-171.
[15]Hidalgo G,Chan M,Tufenkji N. Inhibition of Escherichia coli CFT073 fliC expression and motility by cranberry materials[J].Applied &Environmental Microbiology,2011,77(19):6852-6857.
[16]渠宏雁,李学鹏,仪淑敏,等.亚硝酸钠对金黄色葡萄球菌和副溶血性弧菌生物被膜形成的抑制作用[J].食品工业科技,2015,36(21):178-182.
[17]马晨晨,李柏林,欧 杰,等.高效液相色谱-串联质谱法同时测定细菌群体感应效应的11种AHLs类信号分子[J].分析化学,2010,38(10):1428-1432.
[18]Patzelt D,Michael V,Päuker O,et al.Gene flow across genus barriers-conjugation of Dinoroseobacter shibae’s 191-kb killer plasmid into Phaeobacter inhibens and AHL-mediated expression of type IV secretion systems [J]. Frontiers in Microbiology,2016,7(336):742-753.
[19]贾 坤,廖燕红,徐 磊,等. 酰基-高丝氨酸内酯(AHL)对鼠伤寒沙门氏菌生物菌膜形成的影响[J].南京农业大学学报,2017,40(4):744-749.
[20]张秋勤.生鲜鸡肉中腐败菌群体感应信号分子研究[D].南京:南京农业大学,2014.
[21]Zhang C,Zhu S,Jatt A N,et al.Characterization of N-acyl homoserine lactones(AHLs) producing bacteria isolated from vacuumpackaged refrigerated turbot (Scophthalmus maximus) and possible influence of exogenous AHLs on bacterial phenotype[J]. Journal of General & Applied Microbiology,2016,62(2):60-67.
[22]NC Caiazza,JH Merritt,KM Brothers,et al.Inverse Regulation of Biofilm Formation and Swarming Motility by Pseudomonas aeruginosa PA14[J]. Journal of bacteriology,2007,189(9):3603-3612.
