一株土著B[a]P降解菌的筛选及降解特性研究
2018-06-06周启星伍跃辉张倩茹周爱申
顾 平,周启星 ,王 鑫,伍跃辉 ,陈 威,张倩茹,龚 起 ,周爱申
(1.黑龙江省环境监测中心站,哈尔滨 150056;2.南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室/天津市城市生态环境修复与污染防治重点实验室,天津 300071;3.中国科学院沈阳应用生态研究所,沈阳 110016;4.黑龙江省环境应急与事故调查中心,哈尔滨 150090)
多环芳烃(PAHs)是土壤环境中普遍存在的一类有机污染物,由于其毒性和潜在的致癌性已受到普遍关注[1-7]。苯并[a]芘(B[a]P)是一种具有5环结构的强致癌性PAHs[8-11],主要存在于石油污染的土壤[12]、煤矿区和河流中,已被美国环保局列入优先控制的有毒有机污染物黑名单[13],在其2008年1月公布的28种有毒有机物中,排名第三[14]。有学者已对B[a]P降解菌做了一些研究,例如:Boonchan等[8]用真菌-微紫青霉菌和细菌-嗜麦芽糖寡养单胞菌组成的复合菌群,能利用B[a]P为唯一碳源生长并降解之;Rafin等[9]筛选出一株腐皮镰孢霉菌,以B[a]P为唯一碳源并进行降解实验,12 d后的降解率为4%。目前,国内公布的降解B[a]P的微生物主要集中在真菌[15-16]。国外的报道也多以真菌为主,如Hadibarata等[17]研究了一株白腐真菌对B[a]P的降解,结果显示,在以B[a]P为唯一碳源的情况下,培养30 h后此菌株对B[a]P降解率为38%。由于细菌本身生理特性的多样性以及对植物的相对安全性,在微生物修复技术中比真菌更具有优越性,更能适应不同的环境条件[18-19]。因此,获得高效降解B[a]P的细菌是丰富微生物修复技术的关键环节,也是生物刺激和生物强化[20]等技术的基础,对高效降解微生物的筛选和降解特性研究,也成为PAHs污染土壤修复的第一步。为此,本研究以B[a]P为唯一碳源,从长期受石油污染的土壤中筛选优势土著降解菌株,并考察其降解特性,进而对降解特性最佳的一株菌进行菌种鉴定,旨在为今后污染土壤修复提供物质基础和实验依据。
1 材料与方法
1.1 实验材料
1.1.1 土样来源
污染土壤采自沈抚污灌区四方台大棚南石油污水灌溉多年的蔬菜田的表层土壤(0~20cm)。土壤理化性质:pH 6.9,有机质 17.95 g·kg-1,全 N 1.32 g·kg-1,全 P 1.39 g·kg-1,速效 K 144.4 mg·kg-1。总 Cd 2.71 mg·kg-1,Cd含量超过国家土壤环境质量标准GB 15618—1995的农业用地2级标准(pH介于6.7~7.5之间,Cd含量为0.6 mg·kg-1)的 3.5 倍;16 种 PAHs总量为 0.569 mg·kg-1,2~4 环 PAHs含量为 0.462 mg·kg-1,5~6 环 PAHs含量为 0.106 mg·kg-1,B[a]P 含量为 0.041 mg·kg-1。
1.1.2 主要试剂
B[a]P购于北京百灵威化学技术有限公司,纯度≥95%;实验所用其余有机溶剂均购于山东禹王实业有限公司化工分公司,气谱用正己烷为色谱纯,其余常用试剂如二氯甲烷、丙酮、正己烷、层析用硅胶(200~300目)均为分析纯。
磷酸缓冲溶液:0.02 mol·L-1NaH2PO4,0.02 mol·L-1Na2HPO4,pH 7.0,0.1 MPa,121 ℃,灭菌 20 min[21]。
1.1.3 培养基
富集驯化培养基:所用碳源为 B[a]P(5 mg·L-1),以丙酮溶液加入。(NH4)2SO42.0 g,KH2PO40.5 g,Na2HPO40.5 g,MgSO40.3 g,酵母膏 0.2 g,水 1000 mL,pH=7.0,121℃,蒸气灭菌 30 min。
降解用液体培养基:(NH4)2SO40.5 g,NaNO30.5 g,CaCl20.02 g,MgSO40.2 g,KH2PO41.0 g,NaH2PO4·H2O 1.0 g,水 1000 mL,pH7.0,灭菌条件同上,所用碳源为 B[a]P(5 mg·L-1),以丙酮溶液加入。
降解菌选择性固体培养基:其无机盐配方同上,琼脂浓度20 g·L-1。灭菌条件同上。
活化富集培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,蒸馏水 1000 mL,pH7.0,灭菌条件同上。
1.2 实验方法
1.2.1 B[a]P降解菌富集分离和筛选
将采集的筛菌土样充分混合后取1 g,放入装有50 mL已灭菌的富集驯化培养基的三角瓶中。开始添加 B[a]P 的浓度为 5 mg·L-1,30 ℃、120 r·min-1摇床振荡培养,培养开始后每8 d转接1次,以20%的接种量接种到新鲜B[a]P富集驯化液体培养基中,如此连续富集直至培养到溶液呈现明显的浑浊及颜色变化(此过程约为30 d)。采用梯度稀释法在不同B[a]P浓度的选择性固体培养基上分离培养,经5个周期反复平板划线分离后,得到8个菌株样品,分别纯化后保存于牛肉膏蛋白胨斜面。
在无菌条件下,将8个待测菌株样品制成供试菌悬液(方法见1.2.2),分别接入装有已灭菌的100 mL降解用液体培养基的三角瓶中,然后加入B[a]P的丙酮溶液,使瓶中B[a]P的浓度达5 mg·L-1,同时设不接菌对照CK,各3个重复,在30℃、200 r·min-1恒温下振荡培养。自接种开始1~10 d每日固定时间取样,同时测定培养液中残留B[a]P浓度和OD600值,以便选取降解曲线趋势最好和降解率最高的菌株作为降解特性研究对象。
1.2.2 菌悬液的制备
将分离纯化后的菌种从斜面各挑取一环接入活化富集培养基中,30℃摇床振荡培养48 h(此时处于对数生长期)后,分别取3 mL菌液于离心管内,离心10 min(8000 r·min-1),用磷酸缓冲溶液清洗后离心 15 min(10 000 r·min-1),反复 3 次,制成一定浓度的菌悬液冷藏备用。以上操作在无菌条件下进行,目的是洗去培养基中的碳源[18]。
1.2.3 菌株BB-1对B[a]P的降解实验
无菌条件下,将去掉碳源的供试菌悬液10 mL接入B[a]P浓度为5 mg·L-1的三角瓶中。同时设不接菌对照CK,各3个重复,每个重复两瓶。培养条件及取样时间同1.2.1,一瓶分析培养液中残留B[a]P浓度,另一瓶测定OD600值。以时间为横坐标,以B[a]P含量和OD600为纵坐标画出曲线。
在上述研究基础上,分别研究不同pH值和添加不同浓度葡萄糖作为底物对菌株BB-1降解B[a]P的影响。
1.2.4 菌种鉴定
采用16sRNA基因序列分析、革兰氏染色、形态观察法鉴定菌株。其中,16sRNA基因序列分析引物为:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),扩增条件为:94℃预变性5 min,1个循环;94℃变性1 min,52℃退火1 min,72℃延伸2 min,35个循环;72℃保温 10 min。PCR扩增产物用上海生工的UNIQ-10柱式PCR产物纯化试剂盒进行纯化,DNA测序由大连宝生物公司完成,将测序结果用Blast软件同Genbank中DNA序列进行同源性比较。
1.2.5 微生物生长曲线测定
在30℃、200 r·min-1摇床振荡培养并定时定量吸取培养液,采用蛋白核酸测定仪测定其OD600值以表示其微生物生长密度。
1.2.6 B[a]P的测定
B[a]P含量的分析采用GC-FID法。设备条件:HP-6890,PLUSGC(Version A.03.07)气相色谱仪,装有氢火焰检测器(FID),HP-5毛细管色谱柱(30.0 m×0.25 mm×0.25μm);采用自动进样方式,进样口无分流模式,温度250℃;柱流量1.5 mL·min-1;高纯氮气(99.999%)作载气;炉温80℃;氢火焰离子化检测器(FID)温度:310℃。B[a]P在 1.3~9.75 mg·L-1的浓度范围内,峰面积呈较好的线性关系,线性方程为y=10.408x-2.132 4,其中y为峰面积,x为B[a]P浓度,决定系数R2=0.993 5。
对样品进行加标回收率测定,加标浓度为5 mg·L-1,回收率测定结果为93.6%~108.1%,符合100%±25%的规定,且对空白加标样品进行7次平行测定,相对标准偏差为4.6%,小于5%,说明该方法可以用于培养液中B[a]P含量的测定。
培养后的样品瓶从培养箱中取出后立即放入冰箱中(4℃)平衡1 h以上。拿出后分别用移液管均匀取适量移至分液漏斗。然后加入15 mL二氯甲烷,振荡萃取10 min,静置后收集有机相,经过无水硫酸钠去水后存于茄形瓶中。向水相中再加入10 mL二氯甲烷,振荡萃取5 min,同样过无水硫酸钠去水,合并2次萃取的有机相,于氮吹仪上将其溶剂蒸至微干。最后用色谱纯的正己烷定容至5 mL,立即转移到气谱进样瓶中上机测定。
1.2.7 数据处理
平均值之间的比较采用单因素方差分析(ANOVA),显著性水平为P<0.05,数据处理由SPSS 16.0、Excel 2007、Origin 8.0软件完成。
2 结果与讨论
2.1 菌种的分离筛选与鉴定
由于降解污染物的巨大潜力,目前,多数生物修复工程中应用的是土著微生物,而接种的外源微生物在环境中难以保持较高的活性导致工程菌的应用受到较严格的限制[22]。基于这一原则,许多研究人员均采用从污染土壤中筛选PAHs降解菌的策略[23-25],以获取大量微生物作为污染土壤生物修复的基础。
本研究以沈抚污灌区长期受石油污染的土壤为筛选降解菌的目标土壤,利用细菌富集液体培养基得到能利用B[a]P的富集液,然后将其涂布于以不同浓度B[a]P为唯一碳源的固体培养基中,分离筛选到8株形态各异的能利用B[a]P的微生物。为进一步验证各菌株的降解能力,将其分别接入以B[a]P为唯一碳源的降解用液体培养基中,定时取样,通过测定培养液中B[a]P残留率及菌悬液光密度值(OD600),筛选到一株降解B[a]P能力最强的细菌命名为BB-1。显微镜下观察BB-1菌株为芽孢杆状,革兰氏染色阳性,在牛肉膏蛋白胨培养基上其菌落为圆形、扩展、边缘整齐、淡黄色、有光泽。该菌株为好氧化能异养菌。以其总DNA为模板,采用细菌16sRNA基因特异引物F27和R1492进行扩增,获得1.5 Kb大小的PCR产物,用Blast软件将该片段测序结果和GenBank中已登录的核苷酸序列进行同源性比较,发现菌株BB-1与Bacillus megaterium同源性为100%。根据形态及序列特征,菌株BB-1被鉴定为巨大芽孢杆菌(Bacillusmegaterium),其序列特征见图1。

图1 菌株BB-1的16sRNA基因序列Figure1 16sRNAgenesequenceof strain BB-1
目前,PAHs降解菌的研究大多集中在3~4环有机物上,也达到比较理想的降解效果,如黄兴如等[26]筛选出的3株 PAHs降解菌SL-1、02173和 02830,经16sRNA基因序列分析,02173和02830分别与假单胞菌属中的Pseudomonasalcaliphila和Pseudomonas corrugate同源性最近,SL-1为新类群Rhizobiumpetrolearium的模式菌株,其降解实验表明,菌株SL-1 3 d内对单一 PAHs,即菲(100 mg·L-1)和芘(50 mg·L-1)的降解率分别达100%和48%,5 d后能降解74%的芘;而其3 d内对混合PAHs中菲和芘的降解率分别为75.89%和81.98%。菌株02173和02830 3 d内对混合PAHs 中萘(200 mg·L-1)、芴(50 mg·L-1)、菲(100 mg·L-1)和芘(50 mg·L-1)的降解率均分别超过97%。但能够利用B[a]P作为唯一碳源和能源并对其有降解作用的菌株很少见。已经报道过的有霉菌可可毛色二孢菌[24]、绿色木霉[16]、细菌-真菌[27]、氮单胞菌[19],以及铜绿假单胞菌(报道较多)等。尽管芽孢杆菌属的很多细菌具有强降解PAHs能力,如张宏波等[28]从PAHs污染的土壤中分离到一株以芘作为碳源生长的高效降解菌,属于短短芽孢杆菌属(Brevibacillus parabrevis),能耐受含芘1000 mg·L-1的无机盐液体培养基,在含芘200 mg·L-1的无机盐液体培养基中7 d的降解效率达到51.02%,而且对培养基具有较广泛的pH适应范围,在去除环境污染方面发挥着重要作用[29],但芽孢杆菌属对B[a]P有较强的降解能力的菌株还鲜有报道。
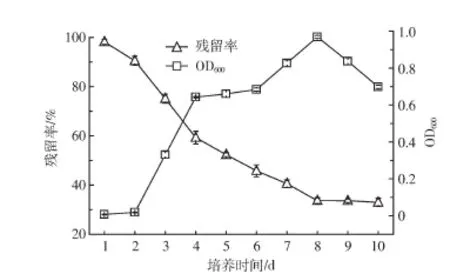
图2 菌株BB-1的生长曲线和对B[a]P的降解Figure 2 Growth and benzo[a]pyrene degradation curvesof strain BB-1
2.2 菌株BB-1对B[a]P的降解特性
2.2.1 菌株BB-1的降解曲线
根据1.2.3所述测定方法,采用处于对数期(48 h)的菌悬液,在培养基pH值为7.0的条件下考察菌株BB-1对B[a]P的降解能力。由图2可以看出,培养初期,菌株BB-1对B[a]P的降解能力较弱,随着培养时间的延长,其降解B[a]P的能力逐渐增强。菌株BB-1在培养24 h后就开始降解B[a]P。培养4 d时,降解率已经显著提高,达到40.74%。6 d后,降解率继续逐渐升高,液体培养基中B[a]P的残留率仅有45.78%±2.44%,菌株BB-1对B[a]P的降解率为54.22%。到第8 d,B[a]P的残留率降低最明显,达到33.64%±1.18%(降解率为66.36%)。之后2 d降解率变化不明显,而未投加菌株的培养基在8 d后测得的B[a]P降解率为3.69%±0.63%,和投加菌株的降解率对比差异明显。10 d后,投加菌株BB-1的液体培养基中B[a]P的残留率仅为32.96%±1.63%。光密度OD600结果显示:培养1 d后OD600值仅为0.007 3±0.002 2;培养第3 d开始细菌数量显著增加,说明其生长曲线存在一定的延滞期;第6 d OD600值为0.683 9±0.008 3;到第8 d达到最高值0.967 6±0.007 4。这些结果都说明菌株BB-1可以利用B[a]P作为主要碳源进行生长繁殖并对其有很高的降解能力。
从B[a]P残留率和降解时间的曲线趋势可以看出,菌体对B[a]P的降解经过了很短的延滞期到快速降解期,最后进入平缓期。说明菌体在反应初期对外源物质有一个适应过程,一方面B[a]P自身毒性抑制了菌体生长,但另一方面,菌体在B[a]P的诱导下开始产生降解酶,所以此时降解率较低。2 d后,菌体已经适应了外来碳源,菌体繁殖速度加快,在大量降解酶作用下对B[a]P利用率增加,使得体系里B[a]P的残留率迅速下降,如图中2~8 d的曲线所示。而8~10 d,曲线趋于平缓,变化不明显,且OD600急速下降,说明菌体的生长受到抑制,可能是由于随着降解的进行,产生了很多有机酸[30-31],改变了体系pH,影响了菌体的代谢;或者是小分子的产物与B[a]P形成了碳源之间的竞争,降低了B[a]P的降解率;也可能是因为产生了一些毒性中间产物在菌体内累积,菌体为了降解中间产物又要进入一轮新的适应期。
菌株BB-1是通过为期30 d的B[a]P富集培养后筛选得到的,并且在接入含B[a]P液体培养基前又再次进行了细菌驯化。从图2中B[a]P残留率曲线可以发现菌株BB-1对B[a]P的降解延滞期非常短,这表明引进菌种的驯化对于降解微生物的实际应用是十分必要的。
另外,根据刘海滨等[24]的研究,可可毛色二孢菌经过 10 d 降解,B[a]P(初始浓度为 100 mg·L-1)的降解率为52.5%±1.5%。可见,多数研究都集中在高浓度的降解上,对于比较接近真实情况的中低浓度且高降解率细菌的研究很少,本研究筛出的BB-1具有很强的实践性。
2.2.2 菌株BB-1降解B[a]P最佳pH
微生物对有机污染物的生物降解受环境中多种因素的制约,为了确定菌株BB-1降解B[a]P的最佳pH值,测定了不同初始pH值下8 d后的B[a]P降解率。由表1可以看出,菌株BB-1对酸碱性有很强的适应能力,在pH 4~10范围内都可以利用B[a]P作为唯一碳源生长,且均可不同程度地降解B[a]P,只是不同pH值条件对B[a]P降解能力的影响存在显著差异。由表1可知,在中性条件下,该菌株8 d后对B[a]P的降解率最高,达66.36%,OD600值为0.967 6±0.007 4;在弱碱(pH值为8)条件下,8 d后其对B[a]P的降解效果也比较好,降解率为55.21%,OD600值为0.812 1±0.010 3;但在强碱(pH值为10)和酸性(pH值为6和4)条件下,菌株BB-1对B[a]P的降解率普遍偏低,均未超过40%,OD600值很低。说明在中性和弱碱体系中BB-1的降解效果优于酸性和强碱体系。这可能是因为B[a]P在降解过程中会生成小分子的有机酸类,与碱性体系中和或趋向弱酸性,这都利于微生物的生长繁殖和代谢降解[32-33]。而在强酸强碱条件下,菌株BB-1的生长活性和降解能力都受到抑制作用,而细胞表面也可能受到破坏,或者出现结构改变,进而影响其对B[a]P的降解。综上,菌株BB-1的最佳降解pH值为7~8。蔡瀚等[33]的研究也发现:在pH=7时,B[a]P降解率达到最高,为46.32%。
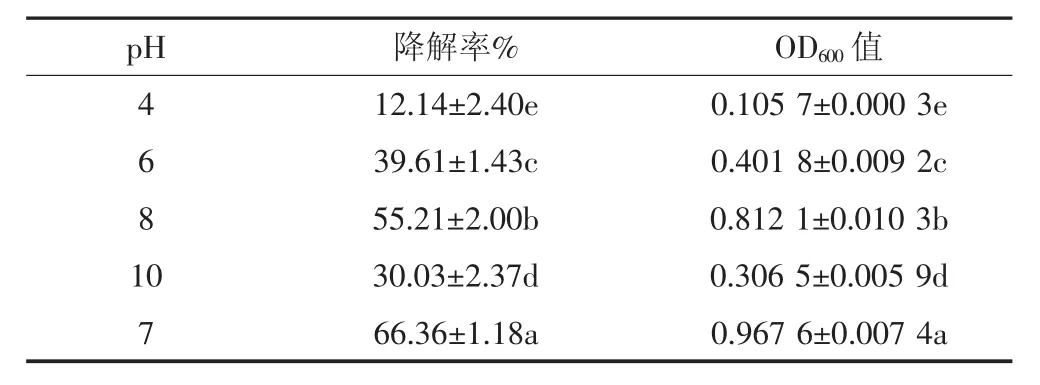
表1 不同pH值对菌株BB-1降解B[a]P的影响(±S.D)Table1 The influence of different pH on B[a]Pdegradation by strain BB-1
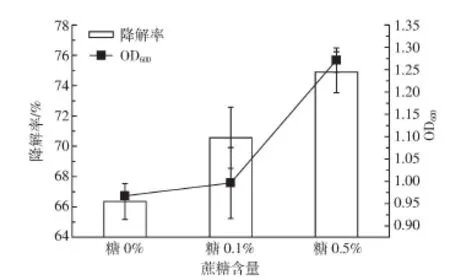
图3 不同含量蔗糖对菌株BB-1降解B[a]P的影响Figure 3 The effect of variousadded sucroseconcentrationson B[a]Pdegradation by strain BB-1
2.2.3 不同含量蔗糖对菌株BB-1降解B[a]P的影响
为了考察外加无毒害碳源对BB-1降解B[a]P的影响情况,选择加入不同浓度的蔗糖,测定相应的B[a]P降解率。当培养基中添加易被细菌利用的蔗糖并同样经过8 d培养时,对比未添加蔗糖的培养基,降解效能有明显改变,见图3。在0.1%蔗糖与5 mg·L-1B[a]P共存条件下,促进了菌株BB-1对B[a]P的降解,降解率为70.56%±2.02%;当蔗糖浓度增加至0.5%时,进一步促进了该菌株的降解效能,降解率增加至74.89%±1.34%,而OD600也由0.996 3±0.079 6增加至 1.271 3±0.027 3。
目前普遍认为,PAHs系一类难降解污染物,尤其是高分子量且结构复杂的B[a]P更难被微生物降解[26,34]。共代谢是被广泛认可的提高微生物降解PAHs的有效方式[20]。它是通过改变微生物碳源与能源的底物结构,增大微生物对碳源与能源的选择范围,从而达到微生物利用并降解PAHs的目的[35]。常见的共代谢底物多为和PAHs本身结构相似的有机物或其中间代谢产物[23],但这些物质除来源有限,还存在竞争性抑制和一定的毒害性等弊端[15,36]。有研究表明,选择较易被利用的碳源如蔗糖、葡萄糖等作为有机污染物的共代谢底物能够明显提高微生物对PAHs的降解率,并具有来源广泛、无毒害,和PAHs无竞争性抑制作用等优点[18-19,36]。本研究也表明,蔗糖能够促进菌株BB-1对B[a]P的降解,但这种促进作用与糖的浓度有关。因此,选择合适的共代谢底物并调整至适宜的浓度是应用共代谢作用降解B[a]P的关键问题之一。
此外,如果将BB-1菌株直接投入到受B[a]P污染的土壤中,其降解特性不一定十分理想,还需要对菌株进行驯化,使降解基因恢复活性,并通过环境条件控制和外源底物添加促使降解菌能够在一定程度上抵御土著微生物的竞争抑制作用。
3 结论
(1)通过富集培养,获得了一株能以B[a]P为唯一碳源的新的高效降解菌株BB-1,它在B[a]P浓度为5 mg·L-1的条件下,30℃振荡培养8 d,对B[a]P的降解率提高最快,达到66.36%±1.18%;
(2)运用16sRNA基因扩增、Blast软件分析等鉴定方法,初步鉴定降解菌株BB-1为巨大芽孢杆菌(Bacillusmegaterium);
(3)强酸、强碱条件对菌株BB-1的生长具有抑制作用,培养基初始pH值为7时,B[a]P的降解率最大;
(4)共代谢底物蔗糖可促进菌株BB-1对B[a]P的降解,当0.5%蔗糖与5 mg·L-1B[a]P共存时,明显促进了菌株BB-1的降解效能,第8 d降解率已经达到74.89%±1.34%。
[1]Ohura T,Amagai T,Fusaya M,et al.Polycyclic aromatic hydrocarbons in indoor and outdoor environments and factors affecting their concentrations[J].Environmental Science& Technology,2004,38(1):77-83.
[2]Kanaly R A,Harayama S.Biodegradation of high-molecular-weight polycylic aromatic hydrocarbons by bacteria[J].Journal of Bacteriology,2000,182(8):2059-2067.
[3]Kipopoulou A M,Manoli E,Samara C.Bioconcentration of polycyclic aromatic hydrocarbon in vegetablesgrown in an industrial area[J].Environmental Pollution,1999,106(3):369-380.
[4]Robert JG,David W,JR V,Indigenousand enhanced mineralization of pyrene,benzo[a]pyrene,and carbazolein soils[J].Applied and Environmental Microbiology,1991,57(12):3462-3469.
[5]苏 慧,赵 波,张素坤,等.广州市小学生多环芳烃内暴露水平[J].环境科学,2015,36(12):4567-4573.SU Hui,ZHAOBo,ZHANG Su-kun,et al.Internal exposure levels of PAHs of primary school students in Guangzhou[J].Environmental Science,2015,36(12):4567-4573.
[6]周启星.复合污染生态学[M].北京:中国环境科学出版社,1995.ZHOUQi-xing.Ecology of combined pollution[M].Beijing:China Environmental Science Press,1995.
[7]张雪娜,贾海滨,王 伟,等.不同载体材料固定化Fusarium.sp修复老化污染土壤中HMW-PAHs的研究[J].环境科学学报,2017,37(3):1107-1114.ZHANG Xue-na,JIA Hai-bin,WANG Wei,et al.Impact of different immobilization materials for Fusarium.sp on the remediation of aged soilspolluted with HMW-PAHs[J].Acta Scientiae Circumstantiae,2017,37(3):1107-1114.
[8]Boonchan S,Britz M L,Stanley G A.Degradation and mineralization of high-molecular-weight polycylic aromatic hydrocarbons by defined fungal-bacterial cocultures[J].Applied and Environmental Microbiology,2000,66(3):1007-1019.
[9]Rafin C,Veignie E,Fayeulle A,et al.Benzo[a]pyrene degradation using simultaneously combined chemical oxidation,biotreatment with Fusariumsolani and cyclodextrins[J].Bioresource Technology,2009,100(12):3157-3160.
[10]包 贞,潘志彦,杨 晔,等.环境中多环芳烃的分布及降解[J].浙江工业大学学报,2003,31(5):528-544.BAO Zhen,PAN Zhi-yan,YANG Ye,et al.The distribution and decomposition of PAHs in the environment[J].Journal of Zhejiang University of Technology,2003,31(5):528-544.
[11]Jules G E,Pratap S,Ramesh A,et al.In utero exposure to benzo[a]pyrene predisposes offspring to cardiovascular dysfunction in later-life[J].Toxicology,2012,295(1/2/3):56-67.
[12]王红旗,王 帅,宁少尉,等.土壤铅-苯并[a]芘复合污染对小麦种子生长的影响研究[J].环境科学,2011,32(3):886-894.WANGHong-qi,WANGShuai,NINGShao-wei,et al.Effectsof combined pollution of lead and benzo[a]pyrene on seed growth of wheat in soils[J].Environmental Science,2011,32(3):886-894.
[13]Keith LH,Telliard WA.Priority pollutantsⅠ:Aperspectivereview[J].Environ Sci Technol,1979,13(4):416-423.
[14]Gan S,Lau EV,Ng H K,Remediation of soilscontaminated with polycyclic aromatic hydrocarbons(PAHs)[J].Journal of Hazardous Materials,2009,172:532-549.
[15]巩宗强,李培军,王 新,等.真菌对土壤中苯并[a]芘的共代谢降解[J].环境科学研究,2001,14(6):36-39.GONGZong-qiang,LIPei-jun,WANGXin,et al.Cometabolic degradation of benzo[a]pyrene in the soil by the introduced fungi[J].Research of Environmental Sciences,2001,14(6):36-39.
[16]顾 平,张倩茹,周启星,等.一株苯并[a]芘高效降解真菌的筛选与降解特性[J].环境科学学报,2010,30(1):1-6.GUPing,ZHANGQian-ru,ZHOUQi-xing,et al.Isolation of a fungal strain capableof degradingbenzo[a]pyrene and itsdegradation characteristics[J].Acta Scientiae Circumstantiae,2010,30(1):1-6.
[17]Hadibarata T,Kristanti RA.Fate and cometabolic degradation of benzo[a]pyrene by white-rot fungus Armillaria sp.F022[J].Bioresource Technology,2012,107:314-318.
[18]孙铁珩,宋玉芳,许华夏,等.植物法生物修复PAHs和矿物油污染土壤的调控研究[J].应用生态学报,1999,10(2):225-229.SUNTie-heng,SONGYu-fang,XUHua-xia,et al.Research of bioremediation of contaminated soil by PAHs and mineral oil with plantsact[J].Chinese Journal of Applied Ecology,1999,10(2):225-229.
[19]盛下放,何琳燕,胡凌飞,等.苯并[a]芘降解菌的分离筛选及其降解条件的研究[J].环境科学学报,2005,25(6):791-795.SHENGXia-fang,HELin-yan,HULing-fei,et al.Isolation of abenzo[a]pyrene-degrading strain and its degradation conditions[J].Acta Scientiae Circumstantiae,2005,25(6):791-795.
[20]吴蔓莉,陈凯丽,叶茜琼,等.堆肥-生物强化对重度石油污染土壤的修复作用[J].环境科学,2017,38(10):4412-4419.WUMan-li,CHENKai-li,YEXi-qiong,etal.Remediationofpetroleumcontaminated soil using a bioaugmented compost technique[J].Environmental Science,2017,38(10):4412-4419.
[21]侯树宇,张清敏,余海晨,等.多环芳烃芘高效降解菌的筛选及其降解性能的研究[J].南开大学学报:自然科学版,2006,39(2):71-74.HOUShu-yu,ZHANGQing-min,YUHai-chen,et al.Optimized cultivation of high-efficient degradation bacterial strainsand their degradation ability towards pyrene[J].Acta Scientiarum Naturalium Universitatis Nankaiensis,2006,39(2):71-74.
[22]周启星,魏树和,张倩茹,等.生态修复[M].北京:中国环境科学出版社,2006.ZHOUQi-xing,WEIShu-he,ZHANGQian-ru,et al.Ecological remediation[M].Beijing:China Environmental Science Press,2006.
[23]胡凤钗,苏振成,孙 健,等.高效芘降解菌N12的分离鉴定与降解特性[J].应用生态学报,2011,22(6):1566-1572.HUFeng-chai,SUZhen-cheng,SUNJian,et al.Isolation and identification of a highly efficient pyrene-degrading Mycobacterium sp.strain N12[J].Chinese Journal of Applied Ecology,2011,22(6):1566-1572.
[24]刘海滨,王翠苹,张志远,等.苯并[a]芘高效降解菌筛选及其降解特性研究[J].环境科学,2011,32(9):2696-2701.LIU Hai-bin,WANG Cui-ping,ZHANG Zhi-yuan,et al.Isolation of highly-effective benzo[a]pyrene degrading strain and its degradation capacity[J].Environmental Science,2011,32(9):2696-2701.
[25]陈思尹,吕卫光,张娟琴,等.萘降解菌的分离及其联合修复作用的研究进展[J].环境科学与技术,2017,40(7):152-159.CHENSi-yin,L譈 Wei-guang,ZHANGJuan-qin,et al.Review on isolation of naphthalene degradation bacterium in different habitats and the combined remediation[J].Environmental Science and Technology,2017,40(7):152-159.
[26]黄兴如,张彩文,张瑞杰,等.多环芳烃降解菌的筛选、鉴定及降解特性[J].微生物学通报,2016,43(5):965-973 HUANGXing-ru,ZHANGCai-wen,ZHANGRui-jie,et al.Isolation,identification and degrading properties of PAHs-degrading bacteria[J].Microbiology China,2016,43(5):965-973.
[27]李培军,许华夏,张春桂,等.污染土壤中苯并(a)芘的微生物降解,环境污染治理技术与设备[J].环境污染治理技术与设备,2001,2(5):37-40.LIPei-jun,XUHua-xia,ZHANGChun-gui,et al.The degradation of B(a)Pby microorganism in contaminated soil[J].Techniques and E -quipment for Environmental Pollution Control,2001,2(5):37-40.
[28]张宏波,林爱军,刘 爽,等.芘高效降解菌的分离鉴定及其降解特性研究[J].环境科学,2010,31(1):243-248.ZHANG Hong-bo,LIN Ai-jun,LIU Shuang,et al.Identification of pyrene degrading strains and the degrading characteristicsresearch[J].Environmental Science,2010,31(1):243-248.
[29]周 乐,盛下放,张士晋,等.一株高效菲降解菌的筛选及降解条件研究[J].应用生态学报,2005,16(12):2399-2402.ZHOU Le,SHENG Xia-fang,ZHANG Shi-jin,et al.Screening of a phenanthrene-degrading bacterium and its degradation conditions[J].Chinese Journal of Applied Ecology,2005,16(12):2399-2402.
[30]Joanna DM,James PF,Peter PF,et al.Degradation of benzo[a]pyrene by Mycobacterium vanbaalenii PYR-1[J].Applied and Environmental Microbiology,2004,70(1):340-345.
[31]Schneider J,Grosser R,Jayasimhulu K,et al.Degradation of pyrene,benz[a]anthracene,and benzo[a]pyrene by Mycobacterium sp.strain RJGII-135,isolated fromaformer coal gasification site[J].Applied and Environmental Microbiology,1996,62(1):13-19.
[32]Zang SY,Li PJ,Yu X C,et al.Degradation of metabolites of bezno[a]pyrene by coupling Penicillium Chrysogenum with KMnO4[J].Journal of Environmental Sciences,2007,19(2):238-243.
[33]蔡 瀚,尹 华,叶锦韶,等.1株苯并[a]芘高效降解菌的筛选与降解特性[J].环境科学,2013,34(5):1938-1943.CAIHan,YIN Hua,YE Jin-shao,et al.Isolation of an effective benzo[a]pyrene degrading strain and its degradation characteristics[J].Environmental Science,2013,34(5):1938-1943.
[34]王立红,丁克强,刘廷凤,等.芘和苯并[a]芘复合污染土壤中的环糊精-微生物连续修复[J].环境工程学报,2017,11(6):3813-3822.WANGLi-hong,DINGKe-qiang,LIUTing-feng,et al.Continuousremediation of pyrene and benzo[a]pyrene-contaminated soil by cyclodextrin-microbial remediation[J].Chinese Journal of Environmental Engineering,2017,11(6):3813-3822.
[35]Kanaly R A,Bartha R.Cometabolic mineralization of benzo[a]pyrene caused byhydrocarbon additionstosoil[J].Environ Toxicol Chem,1999,18(10):2186-2190.
[36]张 杰,刘永生,孟 玲,等.多环芳烃降解菌筛选及其降解特性[J].应用生态学报,2003,14(10):1783-1786.ZHANGJie,LIUYong-sheng,MENGLing,et al.Isolation and characteristics of PAHs-degrading strains[J].Chinese Journal of Applied E-cology,2003,14(10):1783-1786.
