生菜地上部镉累积规律及其与矿质元素浓度的关系
2018-06-06唐希望吉普辉同延安伊丽丽
唐希望 ,吉普辉 ,同延安 *,伊丽丽
(1.河北环境工程学院环境科学系,河北 秦皇岛 066102;2.西北农林科技大学资源环境学院,陕西 杨凌 712100)
二十世纪五十年代爆发于日本的痛痛病事件使人们开始关注镉(Cd)对人体的毒性作用[1]。人体过量富集镉可以造成肾小管和骨骼的损害[2],同时也会引起肺水肿、肝损伤、贫血以及高血压等症状[3]。对非吸烟人群,食物是人体镉的主要摄入途径[2]。世界卫生组织和联合国粮农组织规定人体日摄入镉的最高限量是70μg[4],正常情况下人体通过食物的日均镉摄入量是8~25μg[2],低于限量标准。但是生活垃圾和工业废物的无序排放以及农业上磷肥的使用会造成土壤中镉富集[5-6]。自然状况下土壤中重金属主要是难以被植物吸收的形态[7-8],但人为活动输入土壤中的重金属很容易进入食物链,进而在人体中富集,危害人体健康。
生菜是一种在世界范围内被广泛消费的蔬菜,2010年生菜的全球消费量达到0.236亿t[9]。生菜对土壤中有毒元素的存在非常敏感,并且这些有毒元素可以富集到生菜的可食部分中[10]。研究表明生长在15 mg·kg-1CdCl2基质中的生菜,其叶片中镉的浓度可以超出蔬菜产品最高限量的100倍[11]。然而这些生长在镉污染土壤中的生菜却没有表现出脱水,黄叶或者坏死等症状[11-12],这表明生菜对镉具有很高的耐受性,生菜受镉污染不容易被发现。此外生菜也是研究植物富集的很好的模式植物,它可以被用来研究植物镉的吸收以及在可食部分的富集问题[13],因此生菜在土壤镉污染研究中也经常作为供试作物[7,14-18]。
作物对镉的吸收会受到矿质元素吸收的影响[5,19-24]。Nan等[21]在田间状态下研究了春小麦和玉米中锌和镉的交互作用,发现锌和镉的吸收存在协同作用。然而Sarwar等[23]通过叶面喷施锌的方法,有效降低了小麦籽粒中镉的含量。Liu等[19-20]研究了不同品种水稻镉与5种矿质元素吸收转运的关系,发现镉与铁、锰、铜存在协同转运关系。然而Sarwar等[22]通过综述前人研究却认为钙、锌、铁、锰可以降低作物对镉的吸收和累积。而王丽香等[24]采用盆栽试验,发现镉胁迫对花生籽粒矿质元素含量的影响不一致,随着镉浓度增加钾、镁、钙、铁、锌元素呈现先增加后降低的趋势。虽然很多关于矿质元素对植物镉吸收影响的研究结果是矛盾的,但是利用矿质元素与镉的相互作用来降低作物对镉的吸收转运是可行的。
在本试验中,采用立生生菜作为供试品种,种植在一个年限超过20年的镉污染日光温室中,在生育期内不间断采样,测定生菜地上部镉与矿质元素含量,以了解在整个生育期生菜地上部镉累积规律及镉与矿质元素吸收的关系。本研究结果对保障生菜等叶类菜的安全生产具有重要意义。
1 材料和方法
1.1 试验地和试验材料
试验地位于陕西杨凌五泉镇的一个日光温室里(34°17′28″N,108°00′27″E),田间试验开展于 2014 年5月20日至8月10日。日光温室土壤是塿土,质地为重壤土,具体理化性质见表1。本试验地位于半湿润地区,年均降水量595.9~732.9 mm,年均温度13.6℃,年均辐射量440~544 kJ·cm-2[25-26]。供试生菜为立生生菜,商品名称“立生二号”,单株生物量为300~500 g,生育期为70 d。
1.2 田间试验方法
1.2.1 生菜种植
在日光温室的中部选取一片试验田块,使用微耕机翻耕田块表层土壤,最大可能使耕层土壤质地达到均一。将生菜种子密集而均匀的撒播在每一行,一共播种9行,每行长9 m,行间距30 cm。在种子出苗前,使用塑料薄膜覆盖在田块上以保持湿度,必要的时候喷洒水分,使土壤湿度保持在最大持水量的60%。为避免肥料对试验结果的干扰,在田间试验前后阶段均不施入任何肥料。
1.2.2 采样方法
播种后20 d开始对生菜地上部分进行采样。每次随机采取20株生菜地上部分作为一个样品,重复三次。采样时间分别为播种后第 20、25、27、30、32、33、34、35、36、38、40、42、44、46、48、51、53、57、59、61、67、70、73 d。所有采集的样品均使用同一方法进行前处理。
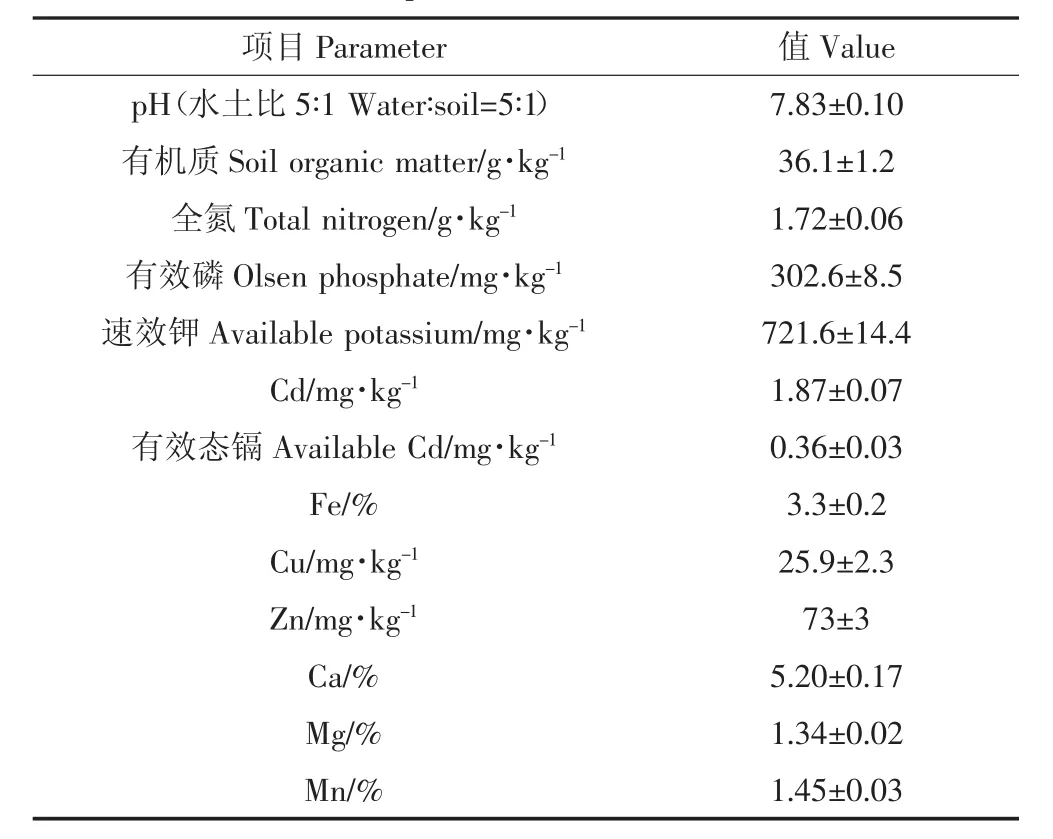
表1 试验场地土壤表层(0~20 cm)理化性质(n=3)Table 1 Propertiesof the 0~20 cmsoil layer in the experimental field(n=3)
1.3 样品前处理及金属元素的测定
1.3.1 样品前处理
从田间采集的鲜样抖尽泥土,先用自来水冲洗,再用去离子水清洗,最后用高纯水清洗干净。然后晾干,称取鲜重。随后放入烘箱中,105℃杀青1 h,80℃烘干至恒重后称重。烘干样品采用不锈钢植物粉碎机(LD-Y500A,上海)进行粉碎混匀。所有样品都采用相同处理方法。
1.3.2 重金属分析
在耐高温石英消煮管中加入1.000 0 g样品,9 mL HNO3(GR)和3 mL HClO4(GR),敞口消解(160℃电热板加热)至近干,呈黄色或无色脓状物,判定为消解完全。然后将消解后的液体转移到25 mL容量瓶中,使用高纯水定容[26]。使用日立Z-2000原子吸收仪(AAS)法测定样品中 Cd、Fe、Mn、Cu、Zn、Ca、Mg 8 种元素,其中Ca、Mg测定以SrCl2为掩蔽剂。样品分析过程中使用环境标准物质GBW10015(菠菜)进行质量控制,回收率为95%±5%,每批次两个重复。
1.4 数据分析
数据分析采用 SigmaPlot 12.5(Systat Software Inc.)和Excel 2010软件。采用Pearson相关性检验对生菜镉浓度和矿质元素浓度相关性进行检验。显著性水平为 0.01和 0.05。
2 结果与讨论
2.1 生菜生长状况
田间试验从2014年5月20日开始到8月10日结束,相对应的采样时间从播种后20 d到播种后73 d。图1是在采样周期内生菜地上部分单株生物量的变化情况。根据生菜生长情况将其分为苗期(播种后20~30 d),器官形成期(播种后 30~57 d)和抽薹期(播种后57~73 d)。从图1a可以看出生菜地上部分鲜物质生物量呈“S”型曲线增加。在器官形成期初期,生菜单株鲜重迅速从2.8 g增加到88.1 g,随后在74.7~92.9 g之间波动。在抽薹期之前,生菜地上部单株干重也符合“S”型增长曲线,从0.1 g增加到了6.4 g,然而在抽薹期生菜地上部分单株干重迅速从6.4 g增加到了 11.2 g(图 1b)。
2.2 镉累积状况
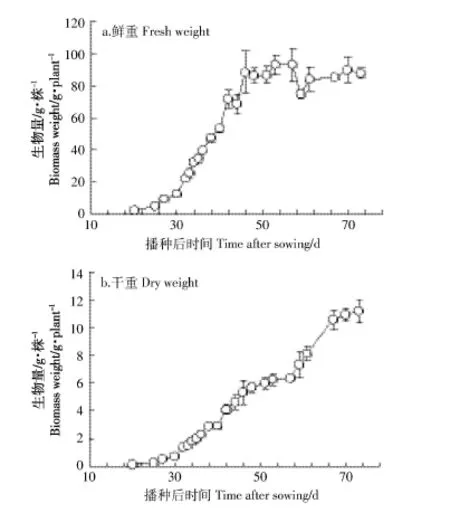
图1 采样期(播种后20~73 d)生菜地上部生物量(n=3)Figure 1 Biomass of lettuce above-ground parts duringthe experimental period(day 20 to 73 after sowing,n=3)
2.2.1 镉浓度
图2是整个生育期生菜地上部分Cd含量。在苗期生菜地上部分Cd的浓度从2.70 mg·kg-1上升到3.62 mg·kg-1,然而在器官形成期生菜地上部Cd的浓度从 3.62 mg·kg-1波动下降到 2.40 mg·kg-1,而在抽薹阶段生菜地上部Cd的浓度从2.40 mg·kg-1几乎直线下降到1.64 mg·kg-1(图2a)。基于Pearson相关性检测数据表明生菜地上部Cd的浓度与生菜生长时间显著负相关(r=-0.76,P<0.01)。
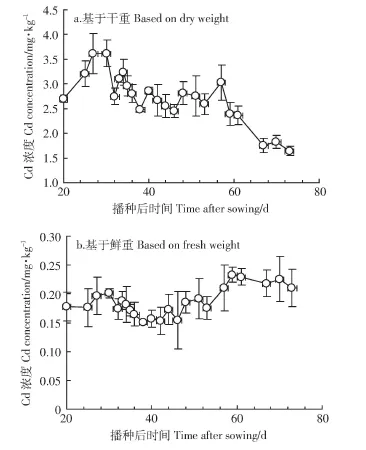
图2 基于干重和鲜重的生菜地上部Cd浓度(n=3)Figure 2 Cd concentrationsin lettuce above-ground partsbased on dry weight and fresh weight(n=3)
由于蔬菜相关的Cd限量标准是基于鲜重的浓度,为便于分析比较生菜地上部Cd浓度与限量标准的关系,本试验计算了基于鲜重的生菜地上部Cd浓度(图2b)。根据图2b,在抽薹期之前生菜地上部分Cd鲜重浓度非常接近可允许的最大限量值(0.2 mg·kg-1),在抽薹期高于生菜可允许的最大限量值。我国对于如生菜的叶类菜,可允许的Cd最高限量值为0.2 mg·kg-1(GB 2762—2012)。考虑到误差,在抽薹期之前生菜Cd含量有可能超标,因此该日光温室生产出的生菜对消费者来说是有健康风险的。
从图2可以看出在整个生育期内生菜地上部Cd浓度的变化并没有保持相同的趋势。对于限定的土壤和限定的一株生菜,生菜组织中Cd浓度是由其生长状况所决定的。植物的根和叶片都可以吸收Cd[27-28],但根吸收是Cd的主要吸收途径。植物根系吸收Cd的规律可以用Michaelise-Menten动力学模型(1)及其衍生模型来描述[29-31]。

式中:J是植物根部微量元素汇入率,mg·cm-1·d-1;C是土壤溶液中的微量元素浓度,mg·L-1;Jmax是J的最大值;Km是J=50%Jmax时C的值。
但是这个方程并不能直接用于描述田间试验,因为在田间试验状态下根系不能被准确地测定。根的生长是和地上部生物量的累积高度相关的[17,32],而地上部分生物量的累积趋势遵循“S”型曲线方程(2):
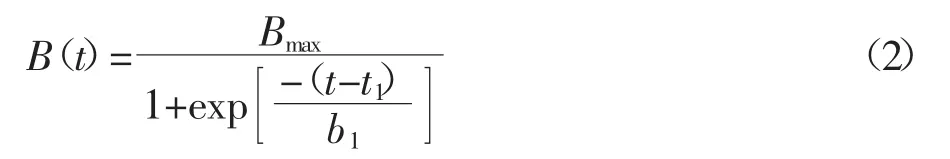
式中:B(t)是生菜地上部在生长时期t(d)的生物量,g·株-1;Bmax代表最大生物量,t1是 B(t)=50%Bmax时的生长时间,d;b1是生长速率的倒数,μg·d-1。
根据Chen等[33-34]和Molina等[17]的研究结果,田间状态下微量元素根吸收模型可以用公式(3)描述:
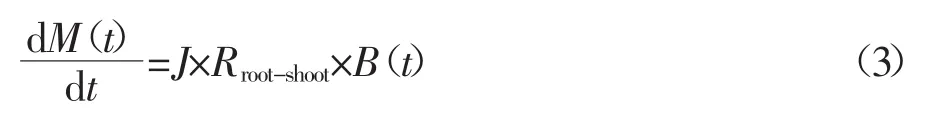
式中:M(t)代表根吸收的微量元素量,μg·株-1;Rroot-shoot代表根冠比(根长/生物量),cm·kg-1。
根据公式(3),根冠比和地上部生物量决定着生菜地上部Cd的累积。在播种后57 d之前地上部生物量的增长趋势符合“S”型曲线,而在此之后的抽薹期地上部生物量又开始迅速增长(图1b)。在整个生育期,地上部生物量增长率符合低-高-低-高的趋势。当生菜地上部生物量累积速率比Cd累积速率低时,地上部Cd浓度就会上升,反之则下降。假设在公式(3)中J值不变,则Cd浓度在苗期升高而在器官形成期和抽薹期下降。抽薹期Cd吸收速率的下降大于器官形成期。
2.2.2 镉累积
根据图3,生菜地上部Cd单株累计量可以用逻辑斯特方程(4)进行拟合。
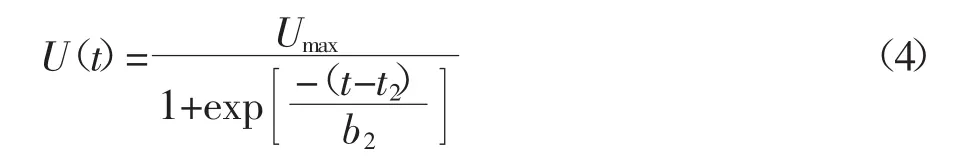
式中:U(t)代表生菜地上部 Cd 单株累积总量,μg·株-1;Umax代表 U(t)的最大值,t2是当 U(t)的值等于 50%Umax的时间,d;b2是Cd吸收速率的倒数,d。在本研究中 Umax=19.35 μg·株-1,t2=40.64 d,b2=6.18 d。
在器官形成期生菜地上部累积的Cd总量为15.48 μg·株-1,远高于抽薹期(表 2)。在器官形成期Cd的累积速率也是最高的,此阶段累积的Cd占全部生长阶段的80%,而抽薹期累积的Cd只占4.35%。由此可见,器官形成期是生菜地上部Cd累积的主要时期。抽薹期虽然生物量增长很快,其Cd累积速率却是最低的。McKenna等[35]的研究结果表明在研究设置的所有Cd输入水平下,都是生菜老叶Cd含量大于新叶,Moustakas等[36]的研究结果也表明生菜外叶Cd含量大于内叶Cd含量。这些研究结果与本研究结果可以相互印证,Cd在生菜各组织器官迁移性较低,但两者均没有比较新叶与老叶Cd累积速率。
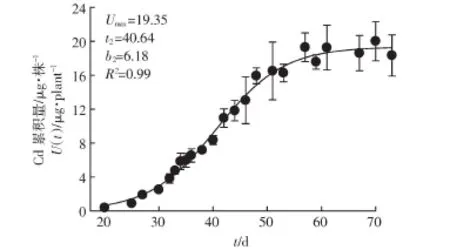
图3 生菜地上部Cd单株累积量的逻辑斯特拟合方程Figure 3 A logistic curve was used to fit the trend of cadmium accumulation in above-ground lettuce parts
在抽薹期,部分叶片枯萎脱落也可能造成部分累积Cd的减少。根据图1,在抽薹期干鲜比的增加可能也降低了Cd从生菜根部到地上部的转移速率。鉴于此,当把生菜作为Cd研究供试植物时应在抽薹期之前进行采摘。根据方程(3),根冠比是生菜地上部Cd累积的影响因素。使用生长素例如吲哚乙酸(IAA)和赤霉素(GA)均可以调节根冠比[25,37]。生菜地上部累积Cd的途径主要是根部的转运,而根部到地上部的转移速率在器官形成期最高。因此可以使用生长素在器官形成期对生菜Cd累积进行调节。
2.2.3 矿质元素浓度
图4是生菜在整个生育期地上部矿质元素Fe、Mn、Cu、Zn、Ca、Mg含量的变化情况。从图 4 可以看出,与生育期内生菜地上部Cd浓度的变化情况不同,Fe、Mn、Cu、Zn 4 种元素浓度的变化与生长时间呈显著正相关(相关系数分别为r=0.71,P<0.01;r=0.58,P<0.01;r=0.42,P<0.05;r=0.39,P<0.05),即随着生长时间的增加,生菜地上部Fe、Mn、Cu、Zn 4种元素的干物质浓度增加。而不同生育期内生菜地上部Ca和Mg元素含量变化则与生长时间没有显著相关性。这可能与研究区域土壤状况有关,根据表1,该区域土壤Ca和Mg的含量较高,分别为5.2%和1.34%,而Ca和Mg是生菜体内的大量元素,其在生菜体内的浓度受外界因素影响较小,因此其在生育期内浓度基本保持恒定。
2.2.4 生菜镉与其他元素含量的相关性
本文在2.1部分根据图1将生菜生长分为苗期、器官形成期和抽薹期,根据生长规律可以进一步将苗期和器官形成期划归至生菜的营养生长阶段,抽薹期划归至生菜的生殖生长阶段。对生菜整个生育期内、营养生长阶段以及生殖生长阶段 Fe、Mn、Cu、Zn、Ca、Mg元素含量与Cd含量进行Pearson相关性分析,结果见表3。可以看出整个生长阶段生菜地上部体内Cd浓度和Fe浓度变化呈极显著负相关(r=-0.77,P<0.01),和Ca呈正相关(r=0.46,P<0.05);在营养生长阶段,Cd浓度和Ca浓度变化呈显著正相关(r=0.56,P<0.05);在生殖生长阶段生菜Cd浓度变化和Fe浓度显著负相关(r=-0.82,P<0.05),和 Zn、Ca显著正相关(r=0.93,P<0.01;r=0.42,P<0.05)。
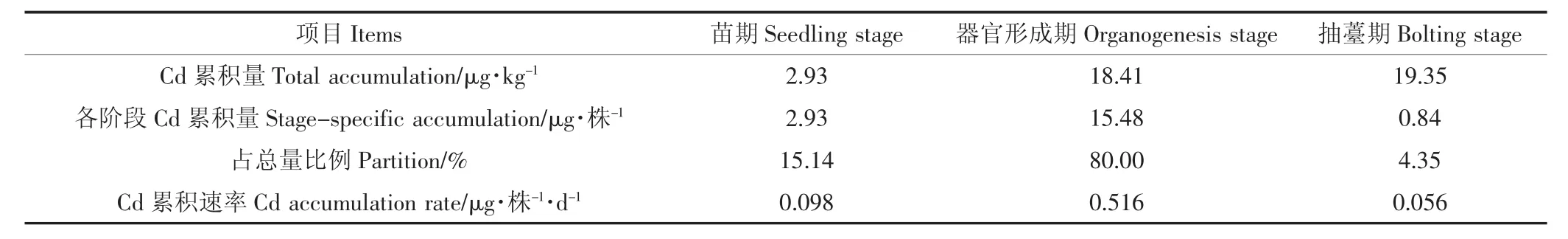
表2 不同生育期生菜地上部Cd累积Table 2 Cadmiumaccumulation in above-ground parts of lettuceplants during different growth stages
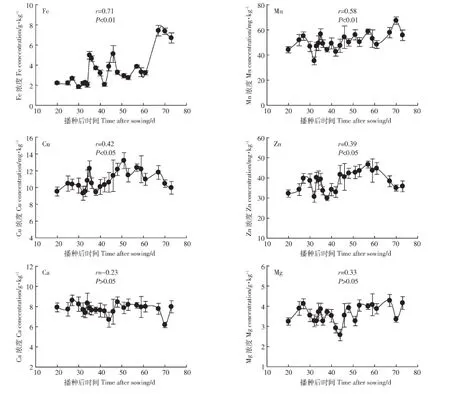
图4 生菜地上部 Fe、Mn、Cu、Zn、Ca、Mg 的浓度(n=3)Figure 4 Fe,Mn,Cu,Zn,Ca and Mgconcentration in the above ground partsof lettuce(n=3)
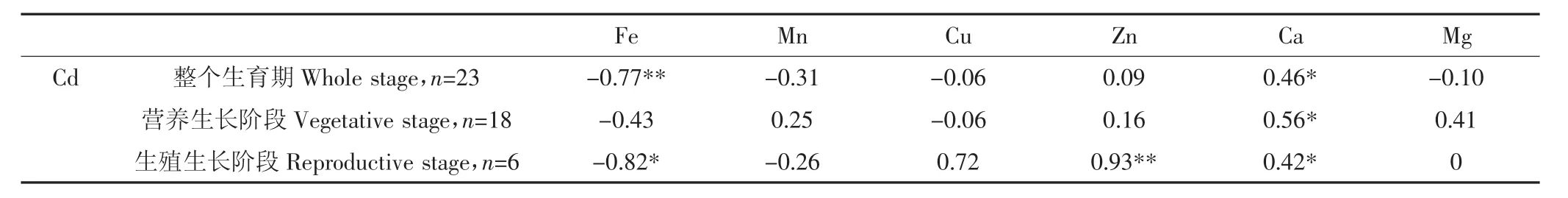
表3 整个生育期、营养生长阶段以及生殖生长阶段生菜Cd含量与Fe、Mn、Cu、Zn、Ca、Mg元素含量的相关性Table 3 Pearson correlation analysis of lettuce Cd content with lettuce Fe,Mn,Cu,Zn,Ca and Mg content respectively,during the whole growth stage,vegetative stage and reproductivestage
在整个生育期以及生殖生长阶段,生菜地上部Fe与Cd的浓度变化呈显著负相关。Fe元素虽然与Cd在生物体内功能不同,但是Fe与Cd存在交互作用,Cd胁迫可以诱导植物缺Fe,而足量供Fe可以降低Cd的生理毒性,减少植物对Cd的吸收转运[38-40]。在本研究中,生菜生育期内地上部Cd与Fe的浓度变化呈显著负相关正是体现了这一点。不过需要指出的是,有研究表明对于Cd富集作物来说,植物对Fe和Cd的吸收是显著正相关的[41]。表3结果表明生菜Cd浓度与Zn、Ca浓度变化呈正相关,而相关研究表明,在生物体内Cd和Zn、Ca两种元素在生理上存在拮抗作用,后两种元素可以缓解Cd对生物的毒害作用[42-43],而Cd与Zn、Ca两种元素存在生理拮抗是因为元素之间价态相同、性质相似,因此生菜对Cd、Zn、Ca吸收转运路径可能存在共同之处。根据图1中生菜生长状况,可以判断出生菜的生长没有受到Cd的胁迫,其对Cd的吸收未受到抑制。因此可以推测在本研究中这3种元素从根部到地上部的转运没有发生竞争,因而生菜地上部Cd浓度与Zn、Ca浓度变化呈正相关。
3 结论
(1)地上部Cd浓度的变化与地上部生物量的变化高度相关。Cd浓度在苗期增加,在器官形成期和抽薹期降低。
(2)单株生菜地上部Cd累积的速率可以用“S”型曲线进行描述,约15%的Cd累积发生在苗期,约80%的Cd累积发生在器官形成期,约5%的Cd累积发生在抽薹期,苗期、器官形成期和抽薹期Cd累积速率分别为 0.098、0.516、0.056 μg·株-1·d-1。
(3)整个生长阶段生菜地上部Cd浓度和Fe浓度变化呈极显著负相关,和Ca呈显著正相关;在营养生长阶段,生菜地上部Cd浓度和Ca浓度呈显著正相关;在生殖生长阶段生菜地上部Cd浓度变化和Fe显著负相关,和Zn、Ca显著正相关。
[1]Hagino N,Kono M.A study on the cause of Itai-itai-disease[C].Proc 17th Mtg Japanese Soc of Clinical Surgeons,1955.
[2]J覿rup L, 覽kesson A.Current status of cadmium as an environmental healthproblem[J].Toxicologyand Applied Pharmacology,2009,238(3):201-208.
[3]Baldantoni D,Morra L,Zaccardelli M,et al.Cadmium accumulation in leaves of leafy vegetables[J].Ecotoxicology and Environmental Safety,2016,123:89-94.
[4]FAO,WHO.List of maximum levels recommended for contaminants by thejoint FAO/WHO[R].Rome:FAO,WHO,1978.
[5]Bolan N,Kunhikrishnan A,Thangarajan R,et al.Remediation of heavy metal(loid)s contaminated soils:To mobilize or to immobilize?[J].J Hazard Mater,2014,266:141-166.
[6]Noll M R.Trace elements in terrestrial environments:Biogeochemistry,bioavailability,and risks of metals,2nd Edition[J].Journal of Environmental Quality,2003,32(1):374.
[7]Das P,Samantaray S,Rout GR.Studies on cadmium toxicity in plants:A review[J].Environmental Pollution,1997,98(1):29-36.
[8]Tyler G,PHlsson A M B,Bengtsson G,et al.Heavy-metal ecology of terrestrial plants,microorganisms and invertebrates[J].Water,Air,and Soil Pollution,1989,47(3/4):189-215.
[9]Liu Y,Vijver M G,Peijnenburg WJGM.Impacts of major cations(K+,Na+,Ca2+,Mg2+)and protonson toxicity predictionsof nickel and cadmiumtolettuce(Lactuca sativa L.)using exposure models[J].Ecotoxicology,2014,23(3):385-395.
[10]Do Nascimento Da Silva E,Heerdt G,Cidade M,et al.Use of in vitro digestion method and theoretical calculationsto evaluate the bioaccessibility of Al,Cd,Fe and Zn in lettuceand cole by inductively coupled plasma massspectrometry[J].Microchemical Journal,2015,119:152-158.
[11]Zorrig W,El Khouni A,Ghnaya T,et al.Lettuce(Lactuca sativa):A species with a high capacity for cadmium(Cd) accumulation and growth stimulation in the presence of low Cd concentrations[J].Journal of Horticultural Science&Biotechnology,2013,88(6):783-789.
[12]Pereira B,Rozane DE,Araujo SR,et al.Cadmiumavailability and accumulation by lettuce and rice[J].Revista Brasileirade Ciência do Solo,2011,35(2):645-654.
[13]Rashid A,Mahmood T,Mehmood F,et al.Phytoaccumulation,competitive adsorption and evaluation of chelators-metal interaction in lettuce plant[J].Environmental Engineering and Management Journal,2014,13(10):2583-2592.
[14]Fontes R,Pereira J,Neves J.Uptake and translocation of Cd and Zn in twolettucecultivars[J].Anaisda Academia Brasileirade Ciências,2014,86(2):907-922.
[15]Kukier U,Chaney RL,Ryan JA,et al.Phytoavailability of cadmiumin long-term biosolids-amended soils[J].JEnviron Qual,2010,39(2):519-530.
[16]Melo L,Alleoni L,Swartjes F A,et al.Cadmium uptake by lettuce(Lactucasativa L.)asbasisfor derivation of risk limitsin soils[J].Human and Ecological Risk Assessment,2012,18(4):888-901.
[17]Molina M,Escudey M,Chang A C,et al.Trace element uptake dynamics for maize(Zea mays L.)grown under field conditions[J].Plant and Soil,2013,370(1/2):471-483.
[18]Podar D,Ramsey M H.Effect of alkaline pH and associated Zn on the concentration and total uptake of Cd by lettuce:Comparison with predictions from the CLEA model[J].Science of the Total Environment,2005,347(1/2/3):53-63.
[19]Liu JG,Liang JS,Li K Q,et al.Correlations between cadmium and mineral nutrients in absorption and accumulation in various genotypes of rice under cadmium stress[J].Chemosphere,2003,52(9):1467-1473.
[20]Liu JG,Li K Q,Xu JK,et al.Interaction of Cd and five mineral nutrients for uptake and accumulation in different rice cultivars and genotypes[J].Field Crops Research,2003,83(3):271-281.
[21]Nan Z R,Li JJ,Zhang JM,et al.Cadmium and zinc interactions and their transfer in soil-crop system under actual field conditions[J].Sci Total Environ,2002,285(1/2/3):187-195.
[22]Sarwar N,Malhi SS,Zia M H,et al.Role of mineral nutrition in minimizing cadmium accumulation by plants[J].Journal of the Science of Food and Agriculture,2010,90(6):925-937.
[23]Sarwar N,Ishaq W,Farid G,et al.Zinc-cadmium interactions:Impact on wheat physiology and mineral acquisition[J].Ecotoxicology and En-vironmental Safety,2015,122:528-536.
[24]王丽香,陈 虎,郭 峰,等.镉胁迫对花生生长和矿质元素吸收的影响[J].农业环境科学学报,2013,32(6):1106-1110.WANGLi-xiang,CHEN Hu,GUOFeng,et al.Effects of cadmium on peanut growth and mineral nutrient uptake[J].Journal of Agro-Environment Science,2013,32(6):1106-1110.
[25]Ji P,Jiang Y,Tang X,et al.Enhancing of phytoremediation efficiency using indole-3-acetic acid(IAA)[J].Soil and Sediment Contamination:An International Journal,2015,24(8):909-916.
[26]Tang X W,Pang Y,Ji PH,et al.Cadmium uptake in above-ground partsof lettuce(Lactuca sativa L.)[J].Ecotoxicology and Environmental Safety,2016,125:102-106.
[27]Fismes JF,Echevarria G,Leclerc-Cessac E,et al.Uptake and transport of radioactive nickel and cadmium into three vegetables after wet aerial contamination[J].Journal of Environmental Quality,2005,34(5):1497-1507.
[28]Zorrig W,Rouached A,Shahzad Z,et al.Identification of three relationships linking cadmium accumulation to cadmium tolerance and zinc and citrate accumulation in lettuce[J].JPlant Physiol,2010,167(15):1239-1247.
[29]Alexander PD,Alloway BJ,Dourado A M.Genotypic variations in the accumulation of Cd,Cu,Pb and Zn exhibited by six commonly grown vegetables[J].Environ Pollut,2006,144(3):736-745.
[30]Cataldo DA,Garland T R,Wildung R E.Cadmium uptake kinetics in intact soybean plants[J].Plant Physiol,1983,73(3):844-848.
[31]Stritsis C,Claassen N.Cadmium uptake kinetics and plants factors of shoot Cd concentration[J].Plant and Soil,2013,367(1/2):591-603.
[32]Casper BA,Cahill JF,Hyatt L A.Above-ground competition does not alter biomassallocated to rootsin Abutilon theophrasti[J].New Phytologist,1998,140(2):231-238.
[33]Chen WP,Li L Q,Chang A C,et al.Modeling uptake kinetics of cadmium by field-grown lettuce[J].Environmental Pollution,2008,152(1):147-152.
[34]Chen W P,Li L Q,Chang A C,et al.Cadmium uptake by lettuce in fieldstreated with cadmiumspikeled phosphorusfertilizers[J].Commun Soil Sci Plant Anal,2009,40:1124-1137.
[35]Mckenna IM,Chaney R L,Williams FM.The effects of cadmium and zinc interactions on the accumulation and tissue distribution of zinc and cadmiumin lettuceand spinach[J].Environmental Pollution,1993,79(2):113-120.
[36]Moustakas NK,Akoumianakis K A,Passam H C.Cadmiumaccumulation and its effect on yield of lettuce,radish,and cucumber[J].Communications in Soil Science and Plant Analysis,2001,32(11/12):1793-1802.
[37]Ji P,Tang X,Jiang Y,et al.Potential of gibberellic acid 3(GA3)for enhancing the phytoremediation efficiency of Solanum nigrum L.[J].Bulletin of Environmental Contamination and Toxicology,2015,95(6):810-814.
[38]黄益宗,朱永官,黄凤堂,等.镉和铁及其交互作用对植物生长的影响[J].生态环境,2004,13(3):406-409.HUANGYi-zong,ZHUYong-guan,HUANGFeng-tang,et al.Effects of cadmium and iron and their interactions on plants growth:A review[J].Ecologyand Environment,2004,13(3):406-409.
[39]万亚男,张 燕,余 垚,等.铁营养状况对黄瓜幼苗吸收转运镉和锌的影响[J].农业环境科学学报,2015,34(3):409-414.WAN Ya-nan,ZHANG Yan,YU Yao,et al.Effects of iron supply on cadmium and zinc uptake and translocation by cucumber seedlings[J].Journal of Agro-Environment Science,2015,34(3):409-414.
[40]杨 芸,周 坤,徐卫红,等.外源铁对不同品种番茄光合特性、品质及镉积累的影响[J].植物营养与肥料学报,2015,21(4):1006-1015.YANGYun,ZHOUKun,XUWei-hong,et al.Effect of exogenous iron on photosynthesis,quality,and accumulation of cadmium in different varietiesof tomato[J].Journal of Plant Nutrition and Fertilizer,2015,21(4):1006-1015.
[41]张晗芝,郭庆军,杨俊兴,等.镉胁迫下蓖麻对镉及矿质元素的富集特征[J].生态环境学报,2015,24(2):323-328.ZHANG Han-zhi,GUO Qing-jun,YANG Jun-xing,et al.Cadmium and mineral nutrients accumulation in various genotypes of castor under cadmium stress[J].Ecology and Environment Sciences,2015,24(2):323-328.
[42]关昕昕,严重玲,刘景春,等.钙对镉胁迫下小白菜生理特性的影响[J].厦门大学学报(自然科学版),2011,50(1):132-137.GUANXin-xin,YANChong-ling,LIUJing-chun,et al.Effect of calciumon physiological property of Brassica chinensis L.under cadmium stress[J].Journal of Xiamen University(Natural Science),2011,50(1):132-137.
[43]郭秀璞,孔祥生,张妙霞,等.锌对小麦镉毒害的缓解效应[J].河南农业大学学报,1999,33(2):211-214.GUOXiu-pu,KONGXiang-sheng,ZHANGMiao-xia,et al.Buffer effect of zinc on cadmium toxic of wheat[J].Journal of Henan Agricultural University,1999,33(2):211-214.
