脂氧素A4抑制恶性黑色素瘤生长的动物实验及免疫学机制初步研究
2018-06-05张晓彤巩毓刚
张晓彤,巩毓刚,李 灵
(1.西南医科大学,四川 泸州 646000;2.四川省医学科学院·四川省人民医院·皮肤病性病研究所,四川 成都 610072)
黑色素瘤是一种来源于皮肤黏膜和色素膜的恶性肿瘤。来自美国国家癌症研究所的数据[1]显示,黑色素瘤的发病率在所有肿瘤中增长最快。脂氧素是花生四烯酸经过15-脂氧化酶、12-脂氧化酶、5-脂氧化酶作用后生成的产物。近年来,越来越多的资料表明脂氧素(Lipoxins,LXs)作为一类脂类介质具有广泛的抗炎作用[2~5]。炎症为一种使机体避开有害刺激的机制,可由多种因素诱发,但持续的炎症使机体通过分泌相关的炎性细胞因子,诱导基因突变、抑制细胞凋亡或刺激血管生成、细胞增殖,最后导致肿瘤发生[6,7]。我们的前期研究发现LXA4抗肿瘤效应的机制,可能是通过抑制炎症发展[8]和抑制肿瘤血管生成来抑制肿瘤的生长[9]。但其免疫机制尚不清晰,相关研究也较少。肿瘤免疫中,T细胞对肿瘤可直接杀伤,对控制肿瘤的发生发展起到了关键的作用。本研究旨在通过研究LXA4对外周血与脾脏中T细胞免疫的影响,来阐明其抑制肿瘤发生发展的免疫学机制,报道如下。
1 材料与方法
1.1实验动物造模实验时间为2017年10月19~27日,健康纯种C57bl/6鼠12只,雌性,SPF级,7周,体重(20±2) g,由四川省医学科学院四川省人民医院实验动物研究所提供,并在该研究所饲养。饲养环境温度为22~25 ℃,湿度为(45%~50%),光照周期为12 h光照/12 h黑暗,自由饮水/取食。小鼠每3天进行一次饲料、饮用水及垫料的更换,其中,饲养小鼠所需的饲料、饮用水以及垫料均须经高压灭菌处理。小鼠适应性饲养一周后进行实验处理。将B16通过皮下接种至正常小鼠腹部,构建恶性黑色素瘤动物模型,造模成功后,通过抽签法分为两组各6只。5S,6R-7- 三羟甲基庚酸(BML-111)组腹腔注射LXA4类似物BML-111(因脂氧素的体外研究试剂LXA4半衰期太短,在体内极易被快速代谢,因此选用BML-111代替)[9](1 mg/kg)进行治疗;磷酸缓冲盐溶液(PBS)组腹腔注射PBS缓冲液(1 mg/kg)作为PBS组对照,两组均每两天治疗一次,共治疗5次。每天观察并记录肿瘤生长情况。
1.2检测方法①测量小鼠肿瘤体积及重量。方法:每隔3天进行称重,并用游标卡尺测量每只小鼠的肿瘤长径、短径,计算肿瘤体积,根据肿瘤体积绘制小鼠肿瘤的生长曲线:肿瘤体积=肿瘤长径×(肿瘤短径)2/2(mm3)实验结束时,颈椎脱臼处死小鼠,完整取出肿瘤块,称量肿瘤瘤重。剥取肿瘤与脾脏,抽取小鼠外周血,称重并计算小鼠肿瘤生长抑制率(tumor growth inhibition rate,IR)=1-干预组平均瘤重/对照组平均瘤重×100%。②测量小鼠脾脏及外周血淋巴细胞所占比。方法:①收集细胞:弃去上清,再加入1 ml 0.25%胰酶消化细胞,待细胞变圆且有部分细胞悬浮,即加入PBS终止消化。用移液枪轻轻吹打细胞,使细胞悬浮。细胞悬液转入离心管中,1500 rpm离心5 min收集细胞。②PBS洗涤细胞:加入3 ml 4 ℃预冷的PBS完全重悬细胞,1500 rpm离心5 min,弃上清。沉淀震荡混匀。③加一抗:加入100 μl一抗抗体稀释液,室温孵育60 min。④加二抗:孵育完后用预冷的PBS洗涤1次,1500 rpm离心5 min,弃上清。加入100 μl二抗抗体稀释液,避光室温孵育30 min。⑤PBS洗涤细胞:加入500 μl 4 ℃预冷的PBS完全重悬细胞,1500 rpm离心5 min,弃上清。沉淀震荡混匀,用200 μl的4 ℃预冷的PBS重悬细胞。⑥上机检测:根据二抗抗体上荧光染料选择适合的通道进行上机检测,用FlowJo软件分析细胞阳性率及阳性区平均荧光强度。
1.3统计学方法应用SPSS 10.0统计分析软件对实验数据进行分析。计量资料以均数±标准差表示,组间比较采用t检验,计数资料以百分率表示。P< 0.05为差异有统计学意义。
2 结果
2.1小鼠肿瘤生长情况实验终止时,BML-111组小鼠肿瘤体积(2069.47±761.17)mm3明显小于PBS对照组小鼠肿瘤体积(4423.24±590.06)mm3,差异有统计学意义(P< 0.01)。BML-111组小鼠的瘤重(1.88±0.38) g明显小于PBS组(2.90±0.22) g,差异有统计学意义(P< 0.01),肿瘤生长抑制率为35.17%。
2.2小鼠脾脏与外周血中淋巴细胞所占比实验终止时,两组小鼠外周血液和脾脏的淋巴细胞比例比较(图1),差异无统计学意义(P> 0.05)。见表1。
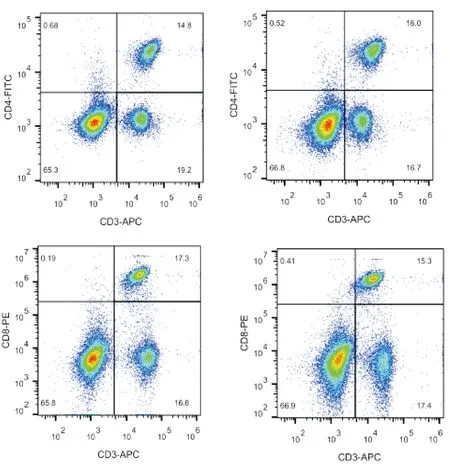
图1 实验终止时PBS组(左列)与BML-111组(右列)小鼠外周血淋巴细胞占比

组别CD4+T细胞CD8+T细胞BML-111组13.07±4.5313.69±4.53PBS组15.60±2.6714.85±2.77
3 讨论
MM是起源于胚胎期神经嵴的恶性肿瘤,其恶性度极高,预后较差。可发生于皮肤、眼球、消化道、生殖系统等部位,但其中以皮肤恶性黑色素瘤最常见[10]。脂氧素是一类花生四烯酸的代表产物,研究表明它具有强有力的抗炎和促进炎症消退的作用,可以及时消退炎症,阻止炎症转化为慢性炎症[11,12],它是一个维持内环境稳态平衡的负性调控因子。LXA4 作为一种广泛的内源性抗炎因子在肿瘤中发挥着强大的抗炎作用,并发现其与肿瘤进程密切相关[13]。除了对天然免疫细胞以及在炎症反应中有着重要的作用外,LXA4与抗感染的免疫应答调节也有着密切的关系。有研究表明LXA4的合成在对弓形虫感染的免疫应答调控中起到了重要的作用[14,15]。基于以上的实验结果,Aliberti等进一步利用活的弓形虫对LXA4的合成进行了研究[15]。这些结果都说明了LXA4对免疫应答的调控有着重要的作用。
免疫系统与肿瘤发生发展的关系在过去几十年中已经得到了很好的研究。免疫系统在肿瘤的预防中发挥着非常重要的作用[16]。肿瘤之所以发生发展,其本质上是一个免疫逃逸的过程。
在本次研究中,我们将B16通过腹部皮下接种,成功构建MM动物模型,成瘤率100%。将小鼠随机分为两组进行干预治疗。BML-111组小鼠肿瘤体积、瘤重均明显小于PBS组,差异有统计学意义(P< 0.01)。综合给药结束后小鼠肿瘤瘤重、肿瘤体积的实验结果,表明脂氧素在小鼠体内可显著抑制MM的生长。此时我们使用流式实验测得小鼠脾脏、外周血液中淋巴细胞所占比例,结果提示,LXA4对CD4+T细胞与CD8+T细胞没有影响,差异无统计学意义(P< 0.05)。查阅大量之前的文献,并没有报道LXA4对T细胞的作用,而我们的实验结果同样说明了,LXA4可能并不是通过影响外周血和脾脏中T细胞的增殖和功能,从而产生抑制MM的作用。最新的研究表明,人和小鼠的B淋巴细胞上有LXA4受体ALX/FPR2的表达,LXA4可以抑制B细胞抗体的产生及记忆B细胞的二次应答[17]。我们推测,也许是T细胞上面的LXA4受体数量或功能远低于B细胞上面的LXA4受体数量及功能,或者LXA4不通过影响外周血和脾脏中T细胞,而作用于引流测淋巴结T细胞,或者LXA4是主要通过B细胞免疫或者B细胞与T细胞联合免疫,而发挥抗MM的作用。另一方面以往研究显示LXA4在其他肿瘤通过抑制调节性B淋巴细胞,下调调节性T淋巴细胞,增强杀伤性T淋巴细胞功能而达到抗肿瘤作用,LXA4在抗MM作用免疫作用机制是否存在差异或者有类似免疫作用机制还有待进一步研究。本实验进一步观察了LXA4在小鼠体内可显著抑制MM的生长;初步观察了LXA4在抗MM中T淋巴细胞免疫作用影响,为后续进一步研究LXA4抗MMMM的免疫机制奠定了基础。
[1] Bostanci O,Kartal K,Battal M.Liver metastases of unknown primary:malignant melanoma[J].Case Reports Hepatol,2014,2014:131708.
[2] 吴升华,董玲.脂氧素与肾脏[J].国外医学泌尿系统分册,2003,23(3):310.
[3] 吴升华.脂氧素研究进展[J].国外医学临床生物化学与检验学分册,2003,24(5):255.
[4] Fierro IM,Serhan CN.Mechanisms in anti-inflammation and resolution:the role of lipoxins and aspirin-triggered lipoxins[J].Braz J Med Biol Res,2001,34(5):555.
[5] GodsonC,BradyHR.Lipoxins:pro-resolutionlipidme-diators in intestinal inflammation[J].Gastroenterology,2003,124(4):1043.
[6] Seruga B,Zhang H,Bernstein LJ,et al.Cytokines and their relation-ship to the symptoms and outcome of cancer [J].Nat Rev Cancer,2008,8(11):887-899.
[7] Kundu JK,Surh YJ.Inflammation:gearing the journey to cancer[J].MutatRes,2008,659(1-2):15-30.
[8] 杨菊.脂氧素A-4对人皮肤鳞状细胞癌A431细胞株增殖及IL-6/VEGF表达的影响[D].西南医科大学,2017.
[9] 曾蓁.脂氧素A4抑制恶性黑素瘤生长的动物研究[D].电子科技大学,2017.
[10]Miller KD,Siegel RL,Lin CC,et al.Cancer treatment and survivorship statistics,2016 [J].CA Cancer J Clin,2016,66(4):271-289.
[11]Serhan CN,Yacoubian S,Yang R.Antiinflammatory and proresolving lipid mediators[J].Annu Rev Pathol,2008,3:279312.
[12]Serhan CN.Lipoxins and aspirintriggered 15-epilipoxins are the first lipid mediators of endogenous antiinflammation and resolution[J].Prostaglandins Leukot Essent Fatty Acids,2005,73(34):141162.
[13]杨菊,李灵.脂氧A4调控炎症信号通路在肿瘤中的研究进展[J].实用医院临床杂志,2016,13(3):144-146.
[14]Aliberti J,Hieny S,Sousa CR,et al.Lipoxin-mediated inhibition of IL-12 production by DCs:a mechanism for regulation of microbial immunity[J].Nat Immunol,2002,3(1):76-82.
[15]Aliberti J,Serhan C,Sher A.Parasite-induced lipoxin A4 is an endogenous regulator of IL-12 production and immunopathology in Toxoplasma gondii infection[J].The Journal of experimental medicine 2002,196(9):1253-1262.
[16]Swann JB,Smyth MJ.Immune surveillance of tumors[J].J Clin Invest 2007,117(5):1137.
[17]Ramon S,Bancos S,Serhan CN,et al.Lipoxin A4 modulates adaptive immunity by decreasing memory B-cell responses via an ALX/FPR2-dependent mechanism[J].Eur J Immunol 2014,44(2):357-369.
