乙型肝炎病毒蛋白及环氧合酶在乙肝相关性肝细胞癌发展与转移中的作用
2018-06-05周秀敏
殷 骏 周秀敏
(苏州大学附属第一医院,江苏 苏州 215000)
乙型肝炎病毒持续感染是肝癌发生的重要原因〔1〕。乙型肝炎病毒X蛋白在乙型肝炎病毒持续感染小鼠模型致癌过程中具有重要生物学意义〔2〕;环氧合酶(COX)基因为可诱导表达基因,其中同工酶COX-2可被多种细胞外刺激后诱导表达,与肿瘤发生、发展密切相关〔3〕。本研究拟分析乙型肝炎病毒X蛋白、COX-2在人乙肝相关性肝细胞癌发展与转移中的作用机制。
1 材料与方法
1.1材料与试剂 53例人肝细胞癌组织源于2014年5月至2016年6月苏州大学附属第一医院手术切除的病理标本,其中乙型肝炎病毒 cccDNA阳性为乙型肝炎相关性肝癌组织,阴性为非乙型肝炎相关性肝癌组织。人肝癌细胞系HepG2、HepG2-X购于中国科学院。主要试剂:DMEM培养基、胎牛血清购于北京北方同正生物技术发展有限公司;乙型肝炎病毒X蛋白鼠抗人单抗、COX-2鼠抗人单抗、CD34鼠抗人单抗购于上海联硕生物科技有限公司;NMLV逆转录酶购于上海经科化学科技有限公司。
1.2免疫组织化学 SP法检测人肝细胞癌组织中乙型肝炎病毒X蛋白、COX-2、CD34的表达水平。鼠抗人乙型肝炎病毒X蛋白、COX-2单抗滴度均为1∶800,鼠抗人CD34单抗滴度为1∶200,磷酸盐缓冲液(PBS)代替一抗为阴性对照。半定量积分法判断阳性表达,细胞膜、细胞质、细胞核被深成棕黄色为阳性,细胞核蓝色为阴性;Werdner法计算微血管密度。
1.3细胞培养和计数 人肝癌细胞系HepG2、HepG2-X细胞加入含10%胎牛血清的DMEM培养基中,放入37℃ 5%CO2的培养箱中。每12 h观察1次,待细胞贴壁后更换含COX-2抑制剂西乐葆(0、20、40、60 μmol/L)的细胞培养基,细胞活性染料台盼蓝染色细胞计数,记录HepG2、HepG2-X细胞生长情况。
1.4RT-PCR检测COX-2 mRNA表达 分别取1×106个转染X基因的HepG2-X细胞及空载体转染的对照HepG2细胞,使用Trizol试剂盒提取细胞总RNA,逆转录为cDNA并进行PCR扩增,正向引物:5′-AAGTTTACTAACACCCTTTTA-3′,反向引物:5′-TCTAGTAGACGGACTCTATAG-3′;引物设计由上海吉然生物科技有限公司完成。反应条件:70℃ 20 min,94℃ 60 s,55℃ 45 s,72℃ 60 s,共30个循环。扩增产物行电泳检测,分析灰度值,与β-actin的比值为相对表达量。
1.5Western印迹检测COX-2蛋白表达 细胞覆盖面积占培养皿75%~80%时用PBS洗涤细胞,冰上收集细胞后用RIPA裂解,4℃ 10 000 r/min离心20 min,收集上清液蛋白,常规行蛋白定性、定量、电泳。十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)分离蛋白后湿法转膜,室温下用10%脱脂奶粉封闭1 h,滴加COX-2单抗和β-actin,4℃孵育过夜;滴加辣根过氧化酶(HRP)标记的羊抗鼠二抗,室温下孵育4 h,洗膜后ECL显色。
1.6酶联免疫吸附(ELISA)法检测细胞上清液中PGE2 将1×106个细胞平铺到24孔板中,培养至贴壁75%~80%融合时收集细胞培养上清液,胰酶消化培养板中的细胞,显微镜下计数,作为PGE2水平参照。使用ELISA试剂盒,检测样品均设置3个复孔,进行PGE2水平测定。
1.7统计学分析 采用SPSS20.0 软件行t检验、χ2检验及Spearman相关分析。
2 结 果
2.1人肝细胞癌组织中乙型肝炎病毒X蛋白、COX-2的表达 42例乙型肝炎相关性人肝细胞癌组织中乙型肝炎病毒X蛋白阳性表达率为76.19%(32/42),以细胞质阳性表达为主且呈棕黄色。COX-2阳性表达率为83.33%(35/42),以细胞质与细胞膜阳性表达为主且呈棕黄色。32例乙型肝炎病毒X蛋白阳性表达组织中COX-2阳性率为87.50%(28/32),明显高于阴性表达组织中的30.00%(3/10)和非乙型肝炎相关性肝癌组织中的45.45%(5/11),差异有统计学意义(P<0.01),见图1。
2.2微血管密度计数 CD34抗体多阳性表达于毛细血管内皮细胞核,呈棕黄色表达,见图2。
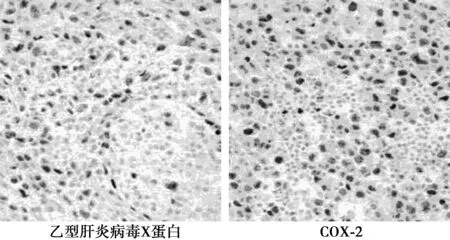
图1 乙型肝炎病毒X蛋白、COX-2在人肝细胞癌组织中的表达(×200)

图2 CD34在早期和进展期人肝细胞癌组织中的表达(×200)
32例乙型肝炎病毒X蛋白阳性表达组织中微血管密度平均计数为(51.56±9.14);其中11例早期癌症组织中微血管密度为(43.18±10.62),21例进展期癌症组织中微血管密度为(57.81±18.42),差异有统计学意义(P<0.01)。10例乙型肝炎病毒X蛋白阴性表达组织中微血管密度为(34.28±2.81),明显低于阳性表达组织;28例COX-2阳性表达组织中微血管密度为(56.61±3.58),明显高于COX-2阴性表达组织的(33.62±2.83;P<0.01)。非乙型肝炎相关性肝癌组织中微血管密度为(34.95±1.79),明显低于乙型肝炎病毒X蛋白阳性表达组织及COX-2阳性表达组织(P<0.01)。乙型肝炎病毒X蛋白阴性表达组织和COX-2阴性表达组织之间差异无统计学意义(P>0.05)。相关性分析显示,乙型肝炎病毒X蛋白、COX-2与肝细胞癌组织微血管生成呈正相关(r=0.671,P<0.01)。
2.3HepG2、HepG2-X细胞生长和药物抑制情况 台盼蓝染色细胞计数显示,培养1~5 d HepG2细胞数分别为:1.12×104、3.65×104、6.17×104、7.83×104、9.67×104;HepG2-X细胞数分别为:1.09×104、4.81×104、8.35×104、11.06×104、15.92×104。结果显示,HepG2-X细胞在10%胎牛血清的DMEM培养基中生长比HepG2细胞快。20、40、60 μmol/L COX-2抑制剂西乐葆对HepG2细胞生长抑制率分别为:(4.61±1.08)%、(10.83±3.67)%、(42.69±8.55)%;HepG2-X细胞生长抑制率分别为:(7.38±2.15)%、(22.05±6.13)%、(64.18±9.91)%。结果显示,西乐葆对HepG2、HepG2-X细胞生长抑制呈剂量依赖性且HepG2-X细胞更为敏感。
2.4HepG2、HepG2-X细胞中COX-2 mRNA和蛋白表达情况 HepG2-X细胞中COX-2 mRNA的相对表达量为(6.51±0.79),明显高于HepG2细胞的(4.05±0.42),差异有统计学意义(P<0.05);HepG2-X细胞中COX-2蛋白相对表达量为(9.82±1.36),明显高于HepG2细胞的(3.68±0.82),差异有统计学意义(P<0.01)。见图3。

图3 COX-2 mRNA和蛋白表达情况的RT-PCR和Western印迹检测结果
2.5西乐葆作用后细胞中COX-2表达情况及细胞上清培养液中PGE2水平 60 μmol/L的COX-2抑制剂西乐葆作用72 h后HepG2-X、HepG2细胞中COX-2 mRNA的相对表达量分别为(2.15±0.58)、(1.95±0.43),均较西乐葆作用前的(6.38±0.56)、(4.41±0.37)明显降低,其中HepG2-X下降幅度更为明显,差异有统计学意义(P<0.05)。西乐葆作用后HepG2-X、HepG2细胞中COX-2 蛋白的相对表达量分别为(2.49±0.61)、(1.53±0.38),均较西乐葆作用前的(10.05±1.82)、(3.81±0.76)明显降低,其中HepG2-X下降幅度更为明显,差异有统计学意义(P<0.01)。见图4。

1作用前HepG2-X细胞;2作用前HepG2细胞;3作用后HepG2-X细胞;4作用后HepG2细胞图4 西乐葆作用前后HepG2-X、HepG2细胞中COX-2蛋白表达情况
60 μmol/L西乐葆作用72 h后HepG2-X、HepG2细胞培养上清液中PGE2水平分别为(513.68±72.15)pg/ml、(639.51±58.09)pg/ml,较作用前的(1 967.85±207.18)pg/ml、(1 304.61±196.50)pg/ml明显降低,差异有统计学意义(P<0.01)。
3 讨 论
乙型肝炎病毒X蛋白表达使肝癌产生独特的生物学特征,与肝细胞癌的发生、进展、转移密切相关。新生血管是肿瘤生长、转移过程中的必要因素,COX-2对肿瘤组织新生血管生成具有明显促进作用,其表达水平与肿瘤组织浸润、转移呈正相关。动物试验发现,在乙型肝炎相关性肝癌中,乙型肝炎病毒X蛋白可活化T细胞核因子,进而与COX-2启动子结合后使其表达上调,促进癌细胞侵袭〔4〕。乙型肝炎病毒X蛋白和COX-2在肝细胞癌组织中的协同表达提示COX-2可能是乙型肝炎病毒X蛋白的一个作用靶点。
PEG2是COX-2的主要代谢产物,肿瘤组织中PEG2水平明显高于正常组织且COX-2与PEG2可促进癌细胞生长和血管生成〔5〕。COX-2/PEG2可通过激活AKT信号通路促进人肝癌细胞生长〔6〕。本研究结果提示,乙型肝炎病毒X蛋白可能通过相应的信号通路活化COX-2表达,进而激活其下游产物PEG2发挥促进肝细胞癌发展与转移。提示乙型肝炎病毒X蛋白对COX-2表达的影响不仅是数量的改变,更是功能性的改变。
4 参考文献
1方宏罡,董秀鹏.慢性乙型肝炎白介素18及其结合蛋白与乙型肝炎病毒DNA载量的相关性〔J〕.中国老年学杂志,2015;35(14):3953-5.
2刘海鸥.乙型肝炎病毒大S蛋白(LHBs)和X蛋白(HBx)对肝癌发生的转移的调控及其功能的研究〔D〕.上海:复旦大学,2012.
3Xirong L,Rui L,Xiaoli Y,etal.Hepatitis B virus can be inhibited by DNA methyltransferase 3a via specific zinc-finger-induced methylation of the X promoter〔J〕.Biochemistry(Mosc),2014;79(2):111-23.
4Luo L,Chen S,Gong Q,etal.Hepatitis B virus X protein modulates remodelling of minichromosomes related to hepatitis B virus replication in HepG2 cells〔J〕.Intern J Mol Med,2013;31(1):197-204.
5董小锋.Meloxicam通过COX-2依赖及非依赖途径发挥其抗肝细胞肝癌机理的研究〔D〕.济南:山东大学,2014.
6Wu CY,Cheng HY,Oil KL,etal.Real-time sensing of hepatitis B virus X gene using an ultrasensitive nanowire field effect transistor〔J〕.J Polymer Engin,2014;34(3):273-7.
