山东省某猪场仔猪多重混合感染的诊断
2018-06-05王丽红张传美韩先杰杨海燕
王丽红,王 妍,张传美,韩先杰,杨海燕,单 虎
(青岛农业大学动物医学院,山东青岛 266109)
1 病例基本情况
山东省青岛市某规模化猪场存栏母猪3 300头左右。2018年3月,该猪场仔猪连续出现死亡现象,半个月来每天死亡一二百头,七八十日龄发病仔猪表现为发热、喘气、关节肿大,三四十日龄发病仔猪主要表现为水样腹泻。发病半个月后,该场送检4头病猪(样本1、2为三四十日龄的发病仔猪,样本3、4为七八十日龄的发病仔猪)到青岛农业大学教学动物医院进行诊断。该场发病仔猪已免疫接种支原体、圆环病毒,以及猪瘟、猪繁殖与呼吸综合征、伪狂犬病和口蹄疫等疫苗。
2 临床症状和病理剖检变化
发病仔猪皮肤苍白,腹股沟肛门处有出血点。剖检发现:心包内有渗出液,绒毛心;肺脏有出血点,纤维素性渗出,有实变;淋巴结肿大;腹腔内有大量纤维素性渗出;脾脏边缘梗死,有出血点;肾脏有针尖状出血点(皮质部髓质部均有);关节腔有渗出,关节处水肿(图1)。
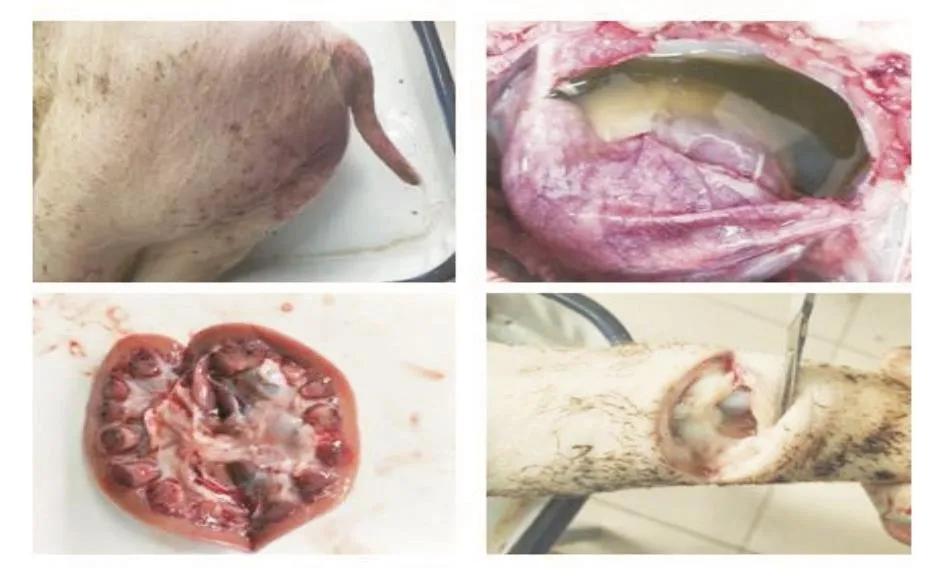
图1 病理剖检情况
3 实验室诊断
3.1 细菌检测
3.1.1 细菌分离与形态观察 无菌取病死猪关节脓汁、心包积液及细支气管分泌物,划线接种于绵羊鲜血琼脂平板上,37 ℃培养24 h后,绵羊鲜血琼脂平板上长出两种菌落:一种是针尖大小、灰白色、半透明、边缘整齐的小菌落,呈β型溶血,经革兰氏染色镜检为革兰氏阳性球菌,多呈单个双球型或短链状排列;另一种是米粒大小、白色、不溶血的菌落,经革兰氏染色镜检为革兰氏阴性菌,呈短杆状,“V”型排列。
3.1.2 16S rRNA基因的PCR检测及测序分析两种分离菌16S rRNA基因序列的PCR扩增产物经1%琼脂糖凝胶电泳,出现大小约1 600 bp,与预期大小相符的目的条带(图2)。利用NCBI的BLAST,将两种分离菌16S rRNA基因序列进行同源性比对分析,发现一株分离菌与猪链球菌序列(CP024126.1)同源性为99%,另一株分离菌与支气管败血波氏杆菌序列(AP014582.1)同源性为99%,因此怀疑存在猪链球菌和支气管败血波氏杆菌的混合感染。
3.2 病毒检测
无菌采集病猪的肺脏、脾脏、小肠和淋巴结等组织,研磨后通过试剂盒提取病毒核酸,使用荧光定量PCR检测试剂盒(购自青岛巴特菲生物科技有限公司)检测猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病病毒(PCV2)、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)和传染性胃肠炎病毒(TGEV)。结果显示,送检的4个样本均为PRRSV阳性,样本2为PCV2阳性,样本1、2为PEDV阳性(表1)。
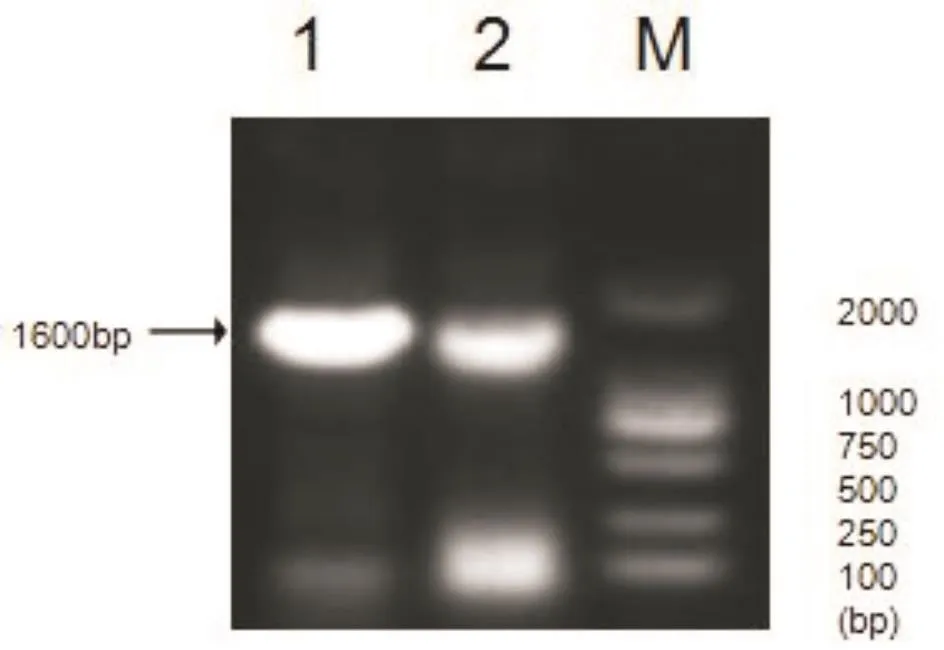
图2 两种分离菌16S 的PCR扩增结果

表1 荧光定量PCR检测结果
4 讨论
本研究通过对病例的流行病学调查、临床症状及病理分析,结合实验室病原鉴定,对该病进行了确诊,对下一步猪场的治疗及防控提供了依据。
猪繁殖与呼吸综合征由于其具有高流行性以及高度致死性等特点,目前已成为危害我国养猪业的重大疫病之一。对于大多数猪场来说,疫苗免疫仍然是防控该病的重要手段,但如果免疫方法和程序不合理,猪群的抗体水平不达标,就很有可能会暴发疾病。该猪场恰逢仔猪断奶和转群,造成应激,导致了疾病暴发。有研究表明,猪感染PRRSV后会导致机体巨噬细胞的吞噬功能以及免疫细胞数量大幅度下降,导致机体的先天性免疫和获得性免疫功能大大降低,从而为其他病原体的入侵开辟了通道[1-3]。目前,PCV2也给养猪业造成了巨大经济损失。众多研究者对PCV2致病机理做了大量研究,大多数研究证明PCV2可导致严重的免疫抑制。至今,由于PCV2的广泛分布,以及PCV2对环境超强的抵抗力,采用有效的防控措施尤为重要[4-5]。猪流行性腹泻是由PEDV引起的具有毁灭性的一种高度接触性猪肠道传染病,临床上主要以食欲下降、呕吐、严重腹泻、脱水,最后酸中毒为基本特征,各年龄阶段的猪都易感染,尤其以哺乳仔猪最为严重,通常死亡率可达到100%,给养猪业造成了巨大经济损失[6-7]。
最新流行病学调查研究结果显示,猪圆环病毒(PCV)、猪细小病毒(PPV)、PRV、 PRRSV、CSFV、副猪嗜血杆菌、猪链球菌、放线杆菌胸膜肺炎、肺炎支原体和支气管败血波氏杆菌等病原体常常发生混合感染,导致猪群病死率上升[8]。因此,在多重混合感染的形势下,单纯依赖疫苗免疫防控是远远不够的,采取科学有效的综合防控措施更为重要。目前,防控各种病毒病主要依靠合理的疫苗免疫,以及健全的生物安全措施。除此之外,还非常有必要定期监测猪群病毒病抗体水平。临床中,常由于疫苗免疫操作不规范、免疫剂量不足或存在其他免疫抑制性疾病等原因造成免疫后疾病暴发[9],因此应随时掌握抗体消长规律,为猪场制定更加合理的免疫程序提供参考。
5 结论
本研究对山东省某规模猪场发生的仔猪死亡疫情进行了临床诊断,结合仔猪发病情况、临床症状、剖检病变以及实验室检测结果,最终确诊为PRRSV、PEDV、PCV2的混合感染,同时疑似存在猪链球菌和支气管败血波氏杆菌的感染。当前,猪群的病毒、细菌混合感染较为普遍,单纯依赖疫苗免疫防控远远不够,需要采取科学有效的综合防控措施,定期监测猪群疫病的抗体水平,及时调整免疫程序,防止疫病暴发。
[1] LABARQUE G,REETH KV,NAUWYNCK H,et al.Impact of genetic diversity of European-type porcine reproductive and respiratory syndrome virus strains on vaccine efficacy[J].Vaccine,2004,22(31/32):4183-4190.
[2] 谢印乾,沈志强,王桂花等. 猪繁殖与呼吸综合征免疫学研究进展[J]. 动物医学进展,2006,27(6):6-10.
[3] 董雅琴,刘林青,李艳,等. 一起猪蓝耳病与伪狂犬病混合感染的紧急流行病学调查[J]. 中国动物检疫,2018,35(4):12-16.
[4] 孙光野,张洪友. 猪高致病性蓝耳病、圆环病毒病和链球菌病混合感染的诊断[J]. 猪业科学,2017(2):129.
[5] 曹胜波,陈焕春,肖少波,等. 猪环状病毒2型的PCR检测方法的建立及应用[J]. 华中农业大学学报,2001,20(1):53-56.
[6] 姜艳平. 猪流行性腹泻病毒S基因片段的原核表达及其表达产物的反应原性[J]. 中国兽医学报,2009,39(7):602-607.
[7] 张志,董雅琴,刘爽,等. 我国部分省份猪流行性腹泻的流行病学监测[J]. 中国动物检疫,2014,31(10):47-51.
[8] 王洪光,汤德元,曹智勇,等. 规模化猪场主要细菌性疫病的流行病学调查[J]. 畜牧与兽医,2014,46(9):98-100.
[9] CHEN J,LIU X,SHI D,et al. Detection and molecular diversity of spike gene of porcine epidemic diarrhea virus in China[J].Viruses,2013,5(10):2601-2613.
