重症医学科呼吸衰竭患者病毒筛查与分析
2018-06-05刘佳许天琪薛晓艳
刘佳 许天琪 薛晓艳
呼吸衰竭是指各种原因引起的肺通气和(或)换气功能障碍,静息状态下不能维持患者需要的气体交换,导致低氧血症伴(或不伴)高碳酸血症,进而引起一系列病理生理变化和相应临床表现的综合征。临床表现缺乏特异性,明确诊断依据动脉血气分析。呼吸衰竭是重症医学科收治的常见疾病,一个欧美16个国家40个重症监护室(ICU) 共同完成的流行病学调查显示,32%的新入住ICU患者并发呼吸衰竭,24%的患者 ICU 住院期间并发急性呼吸衰竭,总发生率达56%,病死率达31%,显著高于未合并呼吸衰竭者[1]。引起呼吸衰竭的病因多种多样,有研究显示肺源性因素引起的呼吸衰竭占大多数[2],而感染性因素是肺源性呼吸衰竭最常见的原因。社区获得性肺炎的病原学研究显示,38%患者可查到致病原,而病毒占23%[3]。呼吸道病毒正逐渐成为住院社区获得性肺炎患者的主要病原体。本研究拟对重症医学科呼吸衰竭患者进行病毒学检测与筛查,结合临床资料进行分析,旨在了解病毒与危重症患者呼吸衰竭之间的相关性,为呼吸衰竭的病原学研究及针对性治疗提供依据。
1 材料与方法
1.1 研究对象 经医院伦理委员会批准,选取2017年1月1日~12月31日在航天中心医院重症医学科住院、入院时或住院期间发生呼吸衰竭的患者。入选标准:标准大气压下、静息条件下呼吸室内空气,并排除心内解剖分流和原发心排量降低等情况后,动脉氧分压低于60mmHg,伴或不伴二氧化碳分压高于50mmHg。排除标准:①住院时间不足72h;②年龄<18岁;③器官移植及长期使用免疫抑制剂、长期使用激素的患者。本研究所有患者均签订知情同意书,留取入选患者临床资料及血气分析结果。同时选取同期住院非呼吸衰竭患者为对照组。
1.2 方法
1.2.1 标本采集 用带有聚丙烯纤维头的拭子对鼻咽部标本进行采集,鼻拭子需在鼻腔内停留15s,咽拭子采集需越过舌根,反复轻轻旋转3次后,将拭子投入病毒运送培养基中,折断拭杆,使其完全置于管中,旋紧盖冒做好标记后密封,-20℃保存后送检。留取咽拭子或鼻拭子同时采取静脉血液标本,无菌条件下勿倾斜或颠覆,2℃~8℃保存≤3d待检或-20℃保存≤2个月待检,冻融次数≤3次,进行标本保存。
1.2.2 临床资料收集 记录患者基本信息(包括性别、年龄等)、住院时间、序贯器官衰竭评分(SOFA评分)、APACHE Ⅱ评分、病死率。
1.2.3 样本扩增和检测 在中科院分子发育生物学实验室进行病毒检测。用呼吸道病原体及血液病原体多重检测试剂盒进行检验。取研究对象标本核酸提物 5μl,25℃孵育 5min,50℃变性 15min,95℃ 2min;按照 94℃ 30s,60℃ 30s,72℃ 60s,总共 35个循环进行RT-PCR 扩增;再经72℃10min扩增产物延长,于4℃环境保存。取扩增产物1μl,加入去离子甲酰胺和LIZ-500 9μl混合,加样于96孔测序板中,在95℃变性4min后,采用POP7胶毛细管电泳通过Genetic Analyzer 3500型测序仪(ABI PRISM 3500)进行产物片段分析,观察扩增所得 PCR 产物电泳后峰型图。采用S1000TMPCR仪、Centrifuge 5424R冷冻离心机、Bio-Rad SmartSpecTM3000分光光度计、Bio-Rad Power Pac 3000基础电泳仪、XICHONG凝胶成像仪等进行检测。采用Magen MagPure Viral Nucleic Acid LQ for Abbott M2000 Kit磁珠法病毒总核酸提取试剂盒、康为世纪HiFiScript cDNA Synthesis Kit逆转录试剂、QIAGEN QIAxcel DNA Screening CartridgeGenStar StarPrep快速DNA胶回收试剂盒等进行试剂的提纯。
1.2.4 结果判读 根据电泳所得峰型图,与阳性对照中的特征峰进行比较,得出研究对象所检病毒种类。单一病毒检出或同时有两种及两种以上的病毒检出为阳性结果;单一拭子标本检出或血液标本检出,或是二者皆检出,均视为阳性标本。
1.3 统计学方法 采用Excel表格建立数据库,对资料进行描述性统计分析。采用SPSS 19.0软件对资料进行整理,符合正态分布的计量资料以均数±标准差(±s)表示,非正态分布的计量资料用中位数(最大值,最小值)及平均数表示;组间比较采用t检验;计数资料以相对数表示,组间比较采用χ2检验。采用Kaplan-Meier生存分析法计算各组病死率并绘制生存曲线,采用Log-rank检验比较生存曲线,以P<0.05为差异有统计学意义。使用GraphPad Prism 7.0软件进行统计图表的描述及分析。
2 结果
2.1 两组基本信息比较 2017年1月1日~12月31日共纳入呼吸衰竭患者67例,排除住院时间不足72h患者5例,62例患者入选,以同期住院非呼吸衰竭患者62例作为对照组。共收集248例合格鼻/咽拭子及血液标本。两组患者基本信息见表1。
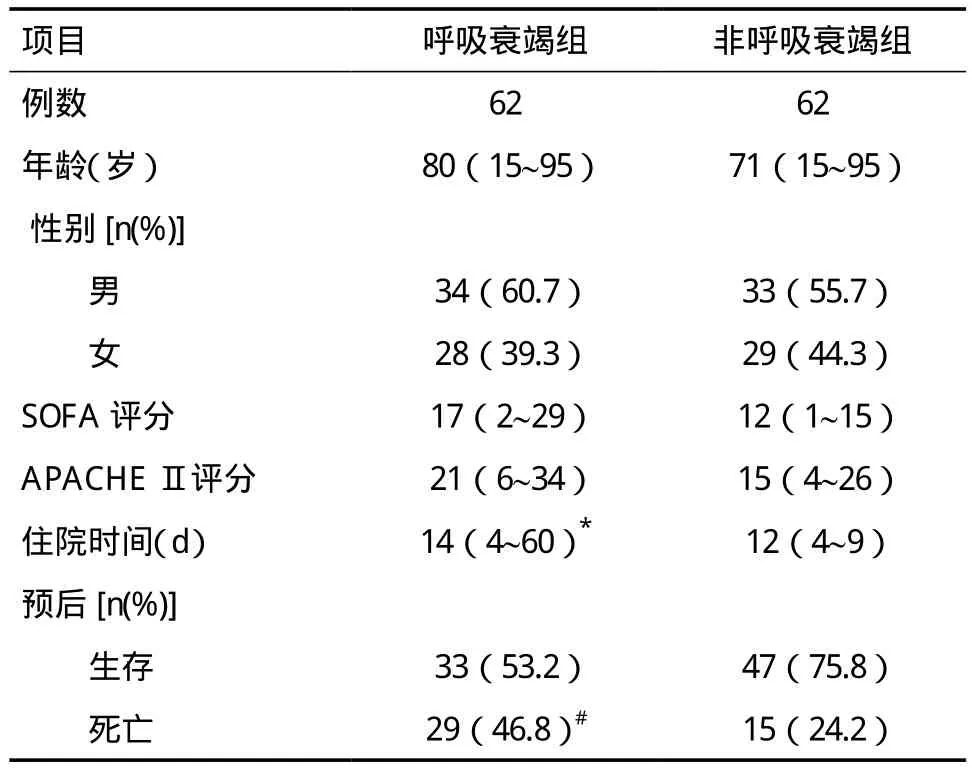
表1 两组患者基本信息
2.2 两组病毒检测结果比较 248例临床标本中共检测出11种病毒,呼吸道鼻/咽拭子标本中检出 5种,包 括 IFN(A/B)26例(20.9%),RhV 18例(14.5%),RSV 10例(8.1%),AdV 6例(4.8%),hMPV 2例(1.6%);血液标本中检出6种,包括CMV 24例(19.4%),EBV 32例(25.8%),HSV 19例(15.3%),HHV 10例(8.1%),RuV 17例(13.7%),AdV 2例(1.6%)。呼吸衰竭组患者呼吸道鼻/咽标本中IFN(A/B)、RhV、RSV、AdV及血液标本中CMV、EBV检出率高于非呼吸衰竭组,差异有统计学意义(P<0.05)。其余检测结果两组比较差异无统计学意义(P>0.05),见表2。
2.3 病毒阳性及阴性呼吸衰竭患者疾病严重程度比较 呼吸衰竭病毒检出阳性患者APACHE Ⅱ评分及SOFA评分高于病毒检出阴性患者,其中IFN(A/B)、AdV、EBV检出阳性患者APACHE Ⅱ评分高于检出阴性患者,差异有统计学意义(P<0.05);CMV 检出阳性患者SOFA评分高于检出阴性患者,差异有统计学意义(P<0.05),见表3。
2.4 病毒阳性及阴性呼吸衰竭患者住院时间和病死率比较 呼吸衰竭鼻/咽拭子标本中IFN(A/B)、RhV、RSV以及血液标本中CMV、EBV检测阳性患者住院时间长于阴性患者,差异有统计学意义(P<0.05)。AdV阳性患者住院时间较阴性患者差异无统计学意义(P>0.05),见图1。呼吸衰竭组血液标本中EBV检出阳性患者病死率与检出阴性患者比较差异存在统计学意义(P<0.05),见图2。
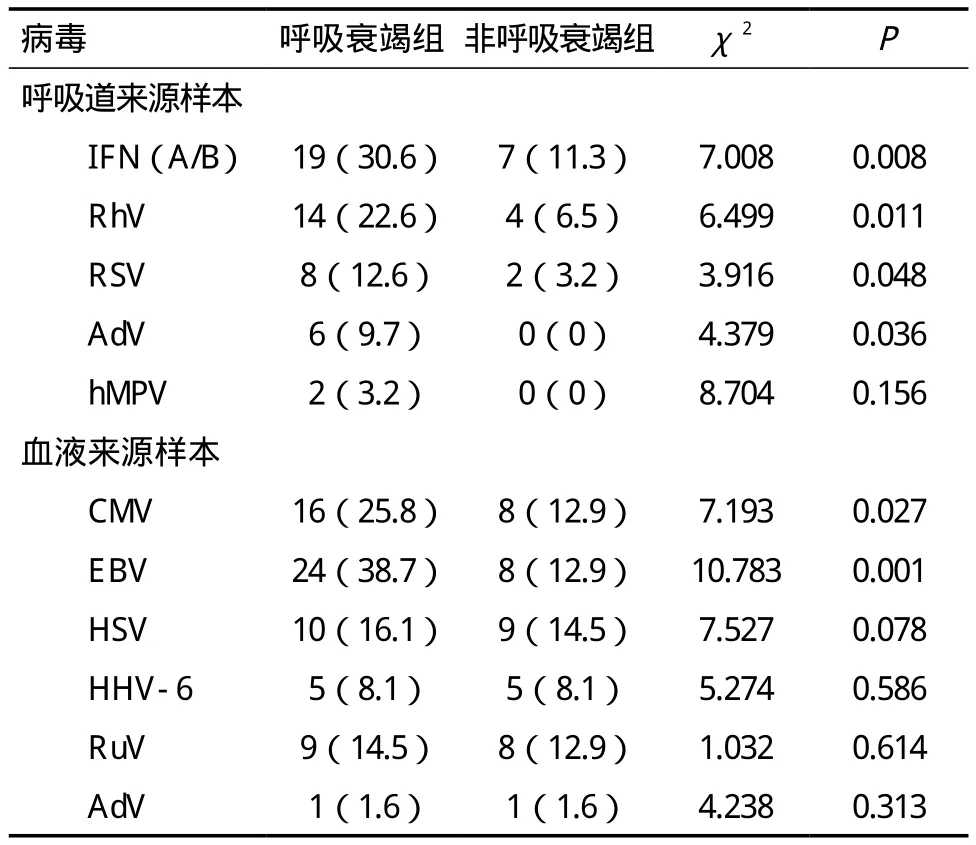
表2 两组病毒检测结果比较[n(%)]
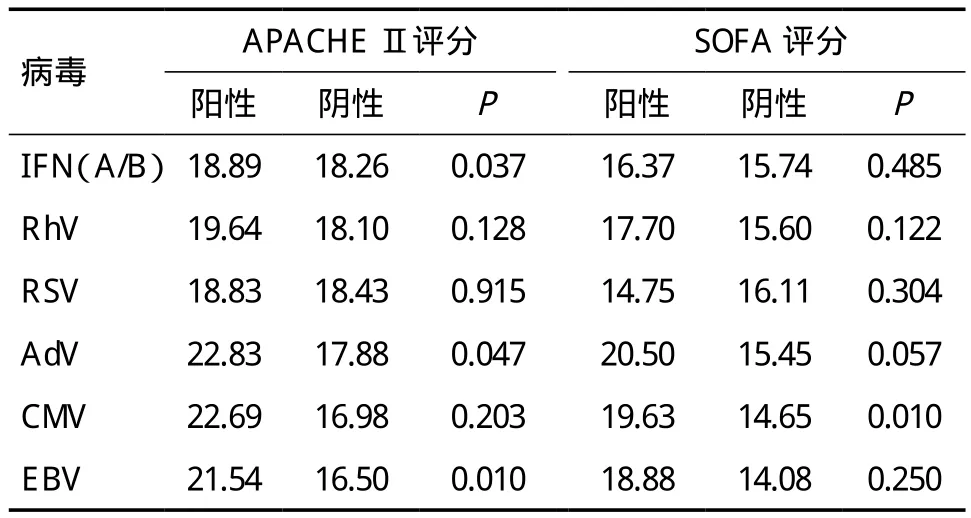
表3 呼吸衰竭患者病毒检出结果与疾病严重程度评分
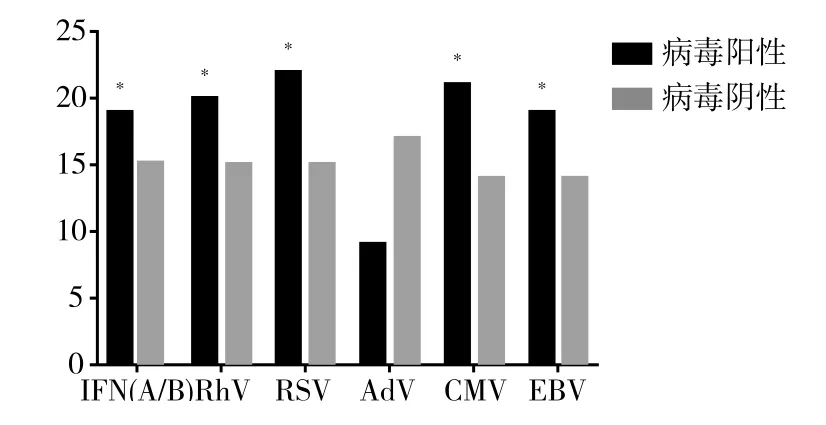
图1 呼吸衰竭患者住院时间

图2 呼吸衰竭患者生存分析
3 讨论
引起呼吸衰竭的病因较多,有研究显示肺源性因素引起的危重患者呼吸衰竭占绝大多数[2],原发肺部感染或疾病过程中合并肺部感染成为重症患者呼吸衰竭的重要原因。由于检测条件所限,以往对感染原的研究重点为细菌、真菌、非典型病原体,未对病毒足够重视。近期研究显示病毒可能是肺部感染尤其是重症肺部感染的首要病原体[4~6]。也有研究显示病毒感染在呼吸衰竭诱发因素中占重要地位[7]。从本研究结果可以看出,呼吸衰竭组患者的病毒检出阳性率明显高于非呼吸衰竭患者,检出率最高的为流感病毒及鼻病毒,病毒分布情况与门诊及普通病房患者所做病毒检测结果大致相同[8]。
本研究显示,呼吸衰竭患者鼻/咽拭子标本中流感病毒及腺病毒检测阳性与疾病严重程度之间具有相关性。呼吸衰竭患者血液标本中出现多种病毒合并阳性,特别是巨细胞病毒及EB病毒,与患者的疾病严重程度及平均住院时间相关,其中EB病毒与患者病死率之间有相关性,虽不能明确呼吸衰竭患者死亡为病毒感染所致,但在对病毒种类的分析过程中发现,该院重症医学科住院患者无论是否呼吸衰竭,病毒的检出种类与一项大型门诊及住院流行病学统计比较未见明显差异[8],但病毒检出率方面明显较其高,其中以流感病毒及鼻病毒的检出率升高最为明显。
目前公认的常见导致病毒性肺炎的呼吸道病毒有甲、乙、丙型流感病毒、副流感病毒、呼吸道合胞病毒、腺病毒、鼻病毒、人类疱疹病毒、人偏肺病毒、人博卡病毒、冠状病毒、肠道病毒、水痘带状疱疹病毒、汉坦病毒、副肠孤病毒、EB病毒、单纯疱疹病毒、巨细胞病毒、麻疹病毒、迷你病毒等。但是患者所检出病毒是否为导致患者重症肺部感染乃至呼吸衰竭的主要病原体目前尚不明确,正如细菌培养阳性不能区分定植还是感染一样,病毒也是广泛存在,可以定植或者感染,区分要靠临床资料,即患者是否处于病毒感染状态。病毒感染往往启动全身免疫应答反应,形成瀑布级联导致严重免疫紊乱和内皮细胞广泛受损,从而导致器官损伤乃至衰竭(如呼吸衰竭)的发生与发展。
有研究显示,单一病毒感染是病毒性肺炎的主要形式[9];其中患者的病情严重程度是引起患者呼吸衰竭发生与进展的重要危险因素,是体内定植病毒处于定植或是感染状态的关键,需要行病毒的载量检测加以鉴别。而重症患者因为在基础疾病的基础上常合并多系统疾病,免疫状态多处于紊乱或低下的状态[10]。目前相关发病机制尚未完全清楚,可能的机制包括:①病毒感染导致炎症反应增高[11];②病毒感染导致呼吸衰竭患者免疫功能紊乱,降低了机体对病原菌的防御能力[11];③病毒感染与细菌感染形成恶性循环。国外一项针对病毒性肺炎的研究表明,感染甲型流感病毒(influenza A virus,IAV)的死亡患者肺部有明显的肺泡损伤,且肺泡上皮细胞(alveolar epithelial cells,AEC)是最主要的感染细胞之一[12],AEC也是维持肺泡上皮内皮屏障功能的最主要细胞。AEC在IAV引起人畜禽共患性疾病过程中发挥着至关重要的作用。病毒引起肺泡上皮细胞表面活性物质的合成和分泌障碍,破坏肺泡的完整性,增加肺泡毛细血管的通透性并通过影响免疫反应和抑制中性粒细胞的趋化和吞噬作用以及对炎症因子调节作用,影响呼吸系统对呼吸道病毒的防御能力,Qiu等[11]研究显示合并呼吸衰竭的AECOPD 患者中约 47%检测出病毒感染,病毒感染率明显升高。合并呼吸衰竭的患者一般状况会迅速恶化,机体出现耗氧增加和低氧合情况。贯序出现骨骼肌肉蛋白消耗增多、持续的氧化应激和炎症因子刺激、能量摄入不足等状况, 最终会导致机体体液免疫、细胞免疫等清除病毒和防御能力降低[13],从而对呼吸功能产生影响,出现呼吸衰竭。
本研究显示,重症医学科呼吸衰竭患者呼吸道鼻/咽拭子标本病毒核酸检测以流感病毒、鼻病毒单独或合并其他病毒存在最为多见,血液标本病毒以巨细胞病毒及EB病毒多见,其中以EB病毒合并多种病毒较多见,与非呼吸衰竭组比较差异具有统计学意义。呼吸衰竭组内IFN(A/B)、AdV、EBV检出阳性患者APACHEⅡ评分、SOFA评分均高于病毒检测阴性患者,差异具有统计学意义(P<0.05)。CMV感染的唯一宿主是人类,在人体多处于潜伏状态,当机体的免疫出现紊乱时可激发CMV出现致死性症状[14],这也是本研究中呼吸衰竭患者血液中巨细胞病毒检出率及死亡率较高的原因。同样在对EBV的研究中发现,EBV在大部分人群中处于潜伏状态,引起EB病毒感染的主要机制可能为对上皮细胞的感染[15],当呼吸道上皮细胞出现感染时导致潜伏状态的EBV启动入胞机制,产生EB病毒感染。
本研究具有一定的局限性,在对病毒种类检测时缺乏对病毒载量的检测,并且纳入的样本量较小,对最终结果产生一定影响,虽然已经设定了病毒单因素与呼吸衰竭之间的关系,同时严格制定纳入标准,尽量减少偏倚的发生,保证结果的准确性,但是本研究结果仍需要贯序、多中心研究进一步证实,同时需对病毒的载量进行检测。
综上所述,呼吸衰竭患者病毒检出率高,住院时间延长,病毒携带/感染可能是重症医学科呼吸衰竭患者的危险因素,早期识别、提高认识、早期防治可能对重症呼吸衰竭患者的治疗及预后产生一定的积极影响。
1 Vincent JL,Aka S,De Mendona A,et al.Sequntial organ failure assessment.The epidemiology of acute respiratory failure in critically ill patients[J].Chest,2002,121(5):1602-1609
2 Andruska A,Micek ST,Shindo Y,et al.Pneumonia pathogen characterization is an independent determinant of hospital readmission[J].Chest,2015,148(1):103-111
3 Daubin C,Parienti JJ,Vincent S,et al.Epidemiology and clinical outcome of virus-positive respiratory samples in ventilated patients: a prospective cohort study[J].Crit Care,2006,10(5):R142
4 汪秀琴,张文艳,金晶.2014年-2015年合肥地区不明原因肺炎病例流感病毒核酸检测结果分析[J].中国卫生检验杂志,2016,26(12):1777-1779
5 林秀慧,张根生,崔巍.病毒性肺炎的诊治进展[J].中国现代医生,2017,55(5):163-168
6 邱欢,黄升海.呼吸道病毒诊断的研究进展[J].实用医学杂志,2013,29(22):3628-3629
7 Wu X, Chen D, Gu X, et al.Prevalence and risk of viral infection in patients with acute exacerbation of chronic obstructive pulmonary disease: a meta-analysis [J].Mol Biol Rep,2014,41(7):4743-4751
8 杨厚宇,王旻晋,梁宗安.呼吸道病毒核酸检测结果分析[J].四川医学,2017,38(4):415-420
9 杨艺,陆小艳.病毒性肺炎患者病原学与外周血T淋巴细胞亚群水平研究 [J].国际病毒学杂志,2015,22(6):424-426
10 钱永兵,谢晖,田锐,等.早期免疫功能麻痹在重症甲型H1N1流感中的临床意义[J].中华危重病急救医学,2017,29(7):581-585
11 Qiu Y, Zhu J, Bandi V, et al.Biopsy neutrophilia,neutrophilchemokine and receptor gene expression in severe exacerbations of chronic obstructive pulmonary disease [J].Am J Respir Crit Care Med,2003,168(8):968-975
12 Shieh WJ,Blau DM,Denison AM,et al.2009 pandenllc infIuenza A(H1N1):pathoIogy and path。genesis of 100 fataIcases in the united states[J].Am J Pathol,2010,177(1):166-175
13 Schnell D, Gits-Muselli M, Canet E, et al.Burden of respiratory viruses in patients with acute respiratory failure[J].J Med Virol,2014,86(7):1198-1202
14 Sekh M,Nichols WG,Papanicohou G,et al.Cytomegehvirus in hematopoietic stem cell transplant recipients:current status,known challenges,and future stralegies[J].Bid Blood Marrow Transplant,2003,9(9):543-558
15 王艳,陈小毅.EB病毒潜伏感染与机体免疫关系的研究[J].西南军医,2012,14(2):309-311
