应用小分子干扰RNA技术以慢病毒为载体抑制乳腺癌淋巴管生成因子VEGF-C的实验研究
2018-06-05罗国庆周晶晶李关杰梁计焕刘秋华李思文胡宁东夏旭
罗国庆 周晶晶 李关杰 梁计焕 刘秋华 李思文 胡宁东 夏旭
乳腺癌是全球威胁女性健康的主要疾病之一,我国乳腺癌的发病率正逐年上升,并且呈年轻化的趋势[1]。淋巴道转移是决定乳腺癌预后最重要的因素之一[2]。研究表明许多肿瘤存在淋巴管新生,血管内皮生长因子C (vascular endothelial growth factor C,VEGF-C) 是重要的促淋巴管生成因子[3]。VEGF-C可通过激活其特异性受体VEGFR-3促进肿瘤内淋巴管的生成,进而促进淋巴转移;有研究发现VEGF-C还有促进乳腺癌细胞迁移的功能,这些与肿瘤淋巴道播散转移和预后密切相关[3、4]。因此,VEGF-C可以作为治疗与预防乳腺癌淋巴道转移的靶点,降低体内VEGF-C的表达水平有可能抑制乳腺癌淋巴管新生与淋巴道转移。RNAi技术的不断成熟,为有效降低VEGF-C的表达提供了重要的理论依据与技术支持。
本研究使用针对人VEGF-C基因的RNAi片段,以慢病毒为载体,感染体外培养的人乳腺癌细胞MDA-MB-231,用Real-time PCR和Western blot方法检测体外干扰后VEGF-C的表达水平变化;利用小室侵袭实验检测慢病毒感染后乳腺癌细胞侵袭能力的改变。
1 材料与方法
1.1 材料与仪器
1.1.1 细胞株 人乳腺癌细胞株MDA-MB-231,购自美国模式培养物保藏所(ATCC,USA)。置于37℃、5%CO2培养箱培养。
1.1.2 siRNA慢病毒 购自上海吉凯基因化学技术有限公司;VEGF-C-siRNA序列为5'-CCTCAACT CAAGGACAGAA-3',阴性对照siRNA序列为5'-TTCTCCGAACGTGTCACGT-3'。VEGF-C-siRNA慢病毒以及阴性对照siRNA慢病毒的滴度分别为5×108TU/ml、2×109TU/ml,均携带绿色荧光标记物。
1.1.3 主要试剂 含双抗(青、链霉素)的细胞培养基RPMI-1640、胎牛血清、胰蛋白酶购自北京Solarbio生物科技有限公司。VEGF-C、GAPDH抗体购自Santa公司;M-MLV逆转录酶和dNTP购自Promega公司;Oligo dT购自上海生工;SYBR Master Mixture购自Takara公司;Cell Invasion Assay Kit购自Chemicon International。
1.1.4 主要仪器 OLYMPUS IX70倒置相差显微镜(光学工业株式会社),电泳用稳压电源、SDSPAGE 蛋白电泳仪、蛋白转膜仪(上海天能),MCO-17AICO2温箱(日本SANYO),5417R台式冷冻高速离心机(Eppendorf公司),TDL-60B离心机(上海安亭科学仪器厂),恒温水浴箱(山东环宇科研仪器厂),Real-time PCR仪器(Takara公司)。
1.2 方法
1.2.1 靶细胞慢病毒感染 目的细胞慢病毒感染实验在6孔板中进行。细胞分成3组:未感染任何病毒的细胞组(CON组)、感染阴性对照病毒的细胞组(NC组)、感染RNAi靶点病毒的细胞组(KD组)。将细胞悬液(细胞数约为5×104)接种于6孔板中,37℃、5%CO2培养箱培养至细胞融合度约30%。根据病毒滴度值,KD组与NC组分别加入0.4μl、0.1μl的病毒。感染3d后观察慢病毒上报告基因绿色荧光的表达情况,感染效率大于50%者继续培养,感染7d后收集细胞抽提RNA进行Real-time PCR及Western blot检测;感染效率低于50%者重新进行感染实验。感染效率定义为同一视野感染细胞数占总细胞数的百分比。
1.2.2 Real-time PCR法检测VEGF-C在靶细胞中的表达 根据Invitrogen公司的Trizol操作说明书进行RNA提取,之后根据M-MLV操作说明书(Promega公司)进行RNA逆转录获得cDNA。引物序列为 Actin-F:5'-GGCGGCACCACCATGTACCCT-3';Actin-R:5'-AGGGGCCGGACTCGTCATACT-3';VEGFC-F:5'-AGGCTGGCAACATAACAGAGA-3';VEGFC-R:5'-TCCCCACATCTATACACACCTC-3'。采用2-ΔΔCt法做相对定量分析。
1.2.3 Western blot法检测VEGF-C在靶细胞中的表达 常规收获细胞,超声破碎仪破碎细胞,离心,取上清,BCA法测蛋白浓度,调整每个样品蛋白终浓度为2 µg/µl。本实验采用10%的分离胶,5%的浓缩胶,每个样品取20 µg总蛋白量上样。在4℃、400 mA恒流条件下电转120min,将蛋白转移到PVDF膜上。用封闭液(含5%脱脂牛奶的TBST溶液)室温封闭PVDF膜4℃过夜。一抗孵育:用封闭液按1∶100、1∶5000分别稀释 VEGF-C、GAPDH抗体,然后与封闭好的PVDF膜室温孵育4℃过夜。二抗孵育:用封闭液按1∶5000稀释相应的二抗,室温下孵育PVDF膜2h。采用Amersham公司ECL+plusTM Western blotting system试剂盒进行显色。
1.2.4 细胞侵袭实验 用无血清培养基准备细胞悬液,每个嵌入物中侵袭室接种2.5×104个细胞每孔,培养48~72h,移去非侵袭细胞。将嵌入物浸泡在染色液中20min,在膜的下表面染色侵入细胞,显微镜拍照,10%醋酸溶解,OD570检测。
1.3 统计学分析 采用SPSS 21.0软件进行统计学分析。计量资料以±s表示,采用方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒载体感染效率 感染3d后在电子荧光显微镜下观察每200倍镜下的感染效率。经观察KD组与NC组感染效率均达到70%以上,CON组因为没有转染带有绿色荧光标记的慢病毒,因此在电子荧光显微镜下不显像,见图1~6。可见慢病毒有较高的感染效率。
图1 KD组白光显像(×200)
图2 NC组白光显像(×200)
图3 CON组白光显像(×200)
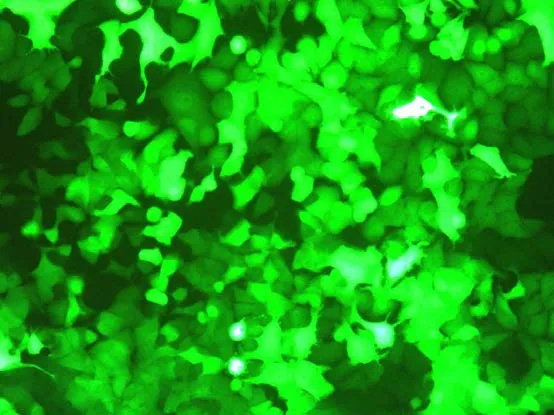
图4 KD组荧光显像(×200)

图5 NC组荧光显像(×200)

图6 CON组荧光显像(×200)
2.2 VEGF-C mRNA在目的细胞中的表达 通过Real-time PCR检测慢病毒感染7d后各组VEGF-C的表达情况。各组组间差异有统计学意义(F=5.14,P<0.05)。NC组与CON组表达水平差异无统计学意义(P>0.05);KD组较 CON组及 NC组表达明显下调,沉默效率大于60%,差异有统计学意义(P<0.05),见表1。结果表明VEGF-C-siRNA能有效抑制VEGF-C mRNA的表达,阴性对照siRNA对VEGF-C的表达无影响。
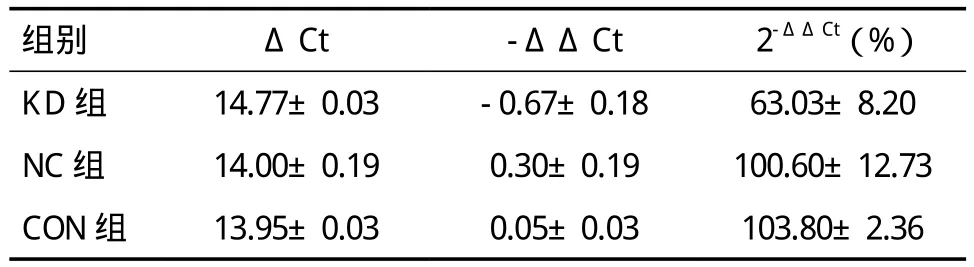
表1 各组VEGF-C mRNA的表达水平
2.3 VEGF-C蛋白在目的细胞中的表达 慢病毒感染7d后按组抽提蛋白进行蛋白印迹实验,结果显示:与CON组及NC组相比,KD组GAPDH条带亮度几乎无差异,而KD组细胞靶基因蛋白表达明显减少,CON组与NC组无明显差异。 实验结果进一步证实了VEGF-C-siRNA在蛋白水平对靶基因的抑制及其作用的特异性。各组VEGF-C蛋白印迹实验结果见图7。

图7 各组VEGF-C蛋白表达
2.4 VEGF-C-siRNA对肿瘤细胞侵袭性的影响 通过细胞侵袭实验检查感染3d后VEGF-C-siRNA和阴性对照siRNA对肿瘤细胞侵袭性的影响。在显微镜下观察,染色后KD组颜色较NC组、CON组明显变淡,见图8~13。10%醋酸溶解,检测KD组、NC组、CON组OD570的吸光值分别为0.181±0.001、0.247±0.005、0.254±0.003,组间差异明显,有统计学意义(F=603.34,P<0.05);与 NC组、CON组相比,VEGF-C-siRNA明显抑制肿瘤细胞的侵袭能力(P<0.05);NC组与CON组差异无统计学意义(P>0.05)。
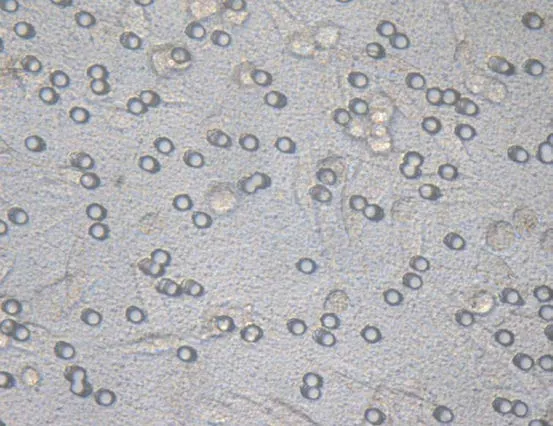
图8 KD组染色前显像(×400)
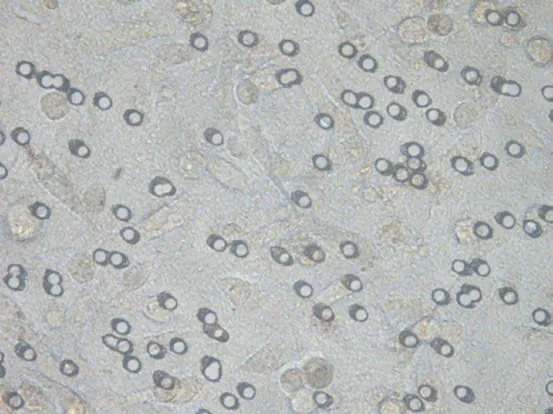
图9 NC组染色前显像(×400)

图10 CON组染色前显像(×400)
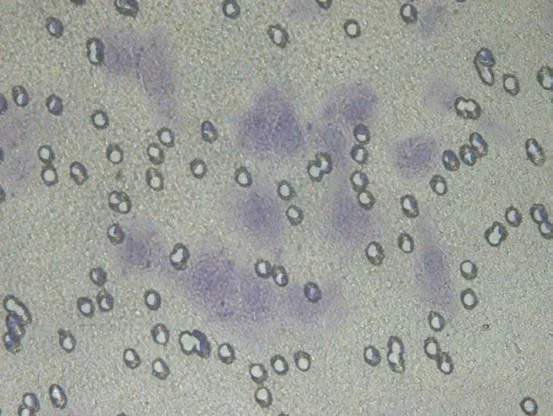
图11 KD组染色后显像(×400)
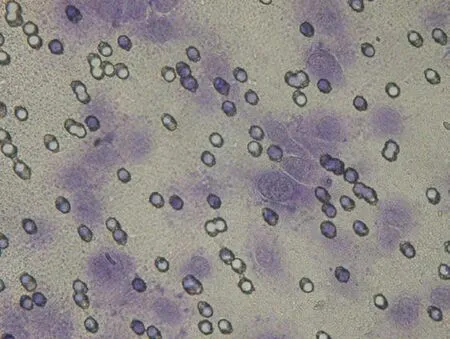
图12 NC组染色后显像(×400)
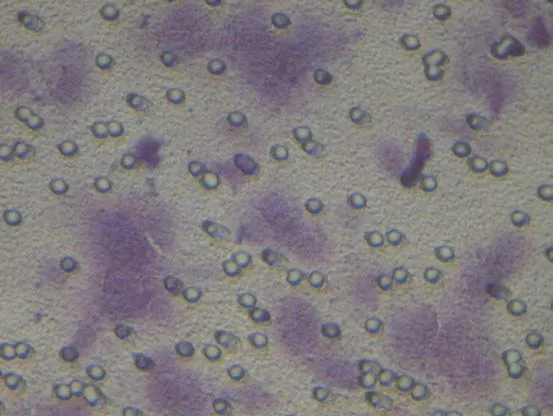
图13 CON组染色后显像(×400)
3 讨论
淋巴道转移是乳腺癌最常见的转移途径之一,通过淋巴结的转移情况可以协助乳腺癌分期和选择治疗方案[5]。淋巴管新生为肿瘤淋巴道转移提供了重要的途径。一系列关于淋巴管生成的分子机制和淋巴内皮细胞特异性标记物的研究提示:在正常生物体和肿瘤的淋巴管生成中VEGF家族的成员 VEGF-C起着关键作用,其促进淋巴管新生的作用通过与特异性受体VEGFR-3结合产生。乳腺癌中的VEGF-C过表达明显提高瘤内淋巴管生成因子的水平,而且与淋巴结转移严重程度呈正相关[6]。对比VEGF-C表达阴性的乳腺癌患者,VEGF-C表达阳性的患者 5 年生存率低(P=0.035),因此VEGF-C有可能成为预测乳腺癌复发的标记物[7]。既往研究显示,VEGF-C产生于癌细胞及基质细胞,通过自分泌和旁分泌发挥作用,它诱导淋巴管新生及介导癌细胞淋巴道转移的作用与其产生的量密切相关[8、9]。由此可见,抑制或者敲除VEGF-C的表达对预防与抑制乳腺癌的淋巴道转移具有非常重要的作用。
使用病毒载体可以提高质粒转染效率,转染效果稳定且可转染的细胞范围广泛,从而扩大RNAi应用范围,因此病毒载体介导RNAi近年来受到重点关注[10,11]。本研究使用慢病毒作为载体,感染7d后采用实时定量PCR检查,VEGF-C-siRNA对VEGF-C的沉默效果明显,沉默效率大于60%,与阴性对照组以及空白对照组之间的表达差异有统计学意义(P<0.05)。慢病毒感染7d后按组抽提蛋白进行蛋白印迹实验,从蛋白水平再次验证了VEGF-C-siRNA能稳定有效抑制VEGF-C的表达。小室侵袭实验结果显示:对比阴性对照组及空白对照组,在慢病毒感染3d后,VEGF-C-siRNA可降低肿瘤细胞的侵袭能力(P<0.05)。
综上所述,使用siRNA技术以慢病毒为载体,可有效抑制人乳腺癌细胞MDA-MB-231 VEGF-C的表达,并能降低细胞的侵袭能力,为体外基因预防与治疗乳腺癌淋巴道转移提供了实验依据,并为后续进行动物实验以及体内实验奠定了重要基础。
1 师金,梁迪,李道娟,等.全球女性乳腺癌流行情况研究[J].中国肿瘤,2017,26(9):683-690
2 中华医学会肿瘤学分会乳腺癌学组.乳腺癌荧光示踪前哨淋巴结活组织检查操作指南[J].中华乳腺病杂志(电子版),2017,11(4):193-197
3 高玉强,张蓓.ARID1A和VEGF-C在乳腺癌中的研究[J].医学检验与临床,2017,28(3):1-5
4 Eroğlu A, Ersöz C, Karasoy D, et al.Vascular endothelial growth factor (VEGF)-C, VEGF-D, VEGFR-3 and D2-40 expressions in primary breast cancer: Association with lymph node metastasis[J].Advances in Clinical & Experimental Medicine,2017,26(2):245-249
5 Qiu SQ, Aarnink M, van Maaren MC, et al.Validation and update of a lymph node metastasis prediction model for breast cancer[J].Eur J Surg Oncol,2018,44(5):700-707
6 Oh N, Park JI, Park JH, et al.The role of ELK3 to regulate peritumoral lymphangiogenesis and VEGF-C production in triple negative breast cancer cells[J].Biochem Biophys Res Commun,2017,484(4):896-902
7 Kinoshita J,Kitamura K,Kabashima A,et al.Clinical significance of vascular endothelial growth factor-C (VEGF-C) in breast cancer [J].Breast Cancer Res Treat,2001,66(2):159-164
8 Ji RC.Lymph node lymphangiogenesis: a new concept for modulating tumor metastasis and inflammatory process [J].Histol Histopathol,2009,24(3):377-384
9 Cao Y.Why and how do tumors stimulate lymphangiogenesis[J].Lymphat Res Biol,2008,6(3-4):145-148
10 Adams FF, Heckl D, Hoffmann T, et al.An optimized lentiviral vector system for conditional RNAi and efficient cloning of microRNA embedded short hairpin RNA libraries[J].Biomaterials,2017,139:102-115
11 Sumimoto H, Kawakami Y.Lentiviral vector-mediated RNAi and its use for cancer research[J].Future Oncol,2007,3(6):655-664
