靶向调控Nrf2-ARE通路的miRNAs研究进展
2018-06-02冯湘玲陈继华
郑 皖,冯湘玲,杨 飞,陈继华,2*
(1.中南大学湘雅公共卫生学院营养与食品卫生学系,中国湖南长沙410078;2.湖南省植物功能成分利用协同创新中心,中国湖南长沙410128)
活性氧类(reactive oxygen species,ROS)是一类具有很强氧化能力的含氧自由基的统称。在生理状态下,低浓度的ROS可作为信号分子激活细胞浆中的第二信使,参与调控细胞信号转导、细胞分化等过程,对机体生理功能发挥有益作用[1];当细胞受到环境毒物、高氧、低氧等外界刺激时会产生过量的ROS,高浓度的ROS可通过脂质过氧化、DNA损伤和蛋白质破坏等方式,引起氧化应激损伤,造成机体生理功能紊乱,导致皮肤病变、衰老以及多种慢性病的发生,如帕金森病、阿尔茨海默病、癌症、心血管疾病、糖尿病等[2,3]。
研究发现,多条通路上的关键分子参与调控机体内的氧化还原稳态。其中,核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,NFE2L2或Nrf2)是调节胞内众多抗氧化基因表达的关键性因子,可识别并结合抗氧化反应元件(antioxidant responsive element,ARE),诱导下游抗氧化蛋白质的表达,清除细胞内产生的过量ROS,从而对抗细胞内的氧化损伤,在疾病预防和治疗中具有积极的意义。Nrf2-ARE信号通路是目前国内外研究较多的抗氧化热点通路。
微RNA(microRNAs,miRNAs)是真核生物体中广泛存在的一类长度约为22个核苷酸的非编码小分子RNA。根据人类基因组计划测序结果预测出人体内miRNAs的数量约占人类基因组的1%~3%[4]。在miRBase v.21中,包含了35 828个成熟的miRNA序列,其中有2 588个人类的成熟miRNAs[5]。研究表明,60%的蛋白质编码基因受到miRNAs的调控[6]。miRNAs通过与靶基因信使RNA(mRNA)的碱基配对结合,降解靶基因或抑制靶基因表达,参与转录后基因表达的调控[7,8],与机体多种生理和病理过程密切相关。
1Nrf2-ARE信号通路
Nrf2-ARE通路主要由转录因子Nrf2、Nrf2抑制因子以及ARE元件构成。Nrf2在通路中起到开关作用,是机体内调控细胞对抗外来异物和氧化损伤的重要转录因子。
在正常稳态水平下,Nrf2定位于细胞质中,并与其胞浆抑制蛋白质Kelch样ECH相关蛋白1(kelch-like ECH-associated protein 1,Keap1)或β-TrCP(β-transducin repeat-containing protein)结合,且在泛素激活酶E1、结合酶E2和连接酶E3的协同作用下不断被泛素化,泛素化的复合体在26S蛋白酶体作用下降解,以此维持Nrf2的低水平无活性状态[9~12]。当机体接触外源性物质如药物、毒物、致癌物等或受到氧化应激刺激时,主要通过Keap1依赖或Keap1非依赖的方式稳定Nrf2,如Keap1构象发生改变或β-TrCP发生磷酸化,引起Nrf2与Keap1或β-TrCP发生解离,从而使Nrf2免于泛素化降解[10,12]。
未被泛素化的Nrf2进入核内与小Maf蛋白(small Maf protein,sMaf)结合形成异源二聚体,并与基因启动子区核苷酸序列5′-TGANNNNGC-3′(即ARE元件)结合,继而激活这类基因的转录(图1)。研究发现这类基因的编码产物主要有Ⅱ相解毒酶或抗氧化酶,如谷胱甘肽S转移酶(glutathione S-transferase,GST)、NAD(P)H 醌氧化还原酶1(NAD(P)H quinone oxidoreductase-1,NQO1)、血红素加氧酶-1(heme oxygenase-1,HO-1)、谷氨酸半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、谷氨酸半胱氨酸连接酶修饰亚基(glutamate-cysteine ligase modifier subunit,GCLM)等[13]。Nrf2通过识别并结合ARE元件,上调上述Ⅱ相解毒酶或抗氧化酶基因的表达[14,15],发挥清除过量ROS的抗氧化作用[16](图1),保护细胞免受氧化应激的损伤,发挥解毒作用或抵御氧化损伤[17~21]。此外,越来越多的研究提示,众多miRNAs同样参与调控了Nrf2-ARE通路,下文将会就此展开详细介绍。
2 miRNAs的生物合成及作用机制
2.1 miRNAs的生成
细胞核内包含miRNAs的DNA片段,该片段首先在RNA聚合酶Ⅱ(RNA polymeraseⅡ)的作用下转录形成初级miRNAs(primary miRNAs,primiRNAs),后者经核酸酶Drosha剪切后,生成大约70 nt长且具有发夹结构的前体miRNAs(precursor miRNAs,pre-miRNAs),随后进一步在转运受体Exp-5(exportin-5)的作用下从细胞核转运至细胞质,被胞质中的Dicer酶剪切为22 nt左右,最终被加工成成熟的miRNAs[22](图2)。
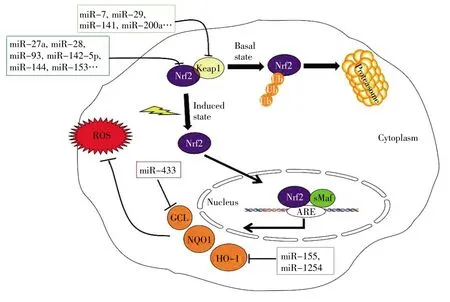
图1 Nrf2-ARE通路及相关miRNAsFig.1 Nrf2-ARE pathway and related miRNAs
2.2 miRNAs的作用机制
miRNAs参与基因表达的调控,与细胞分化、凋亡、生长发育、肿瘤发生等密切相关[4]。通常,一种miRNAs可以调控多种靶基因,而一种基因同时又可以受几种miRNAs的调控。目前,已知miRNAs与靶mRNA的作用方式主要有以下几种(图2):当miRNAs非核心序列与基因的转录因子[23]或启动子区[24,25]结合时,抑制基因转录,导致转录水平基因沉默;当miRNAs核心序列与靶mRNA某段序列完全互补配对时,靶mRNA分子断裂,导致mRNA水平基因沉默,使其失去生物学作用[6];当miRNAs核心序列与靶mRNA的3′-非翻译区(3′-UTR)、5′-非翻译区(5′-UTR)或基因编码区不完全互补配对时,则阻断靶基因转录后的翻译过程,抑制靶基因表达[26~30]。除了抑制靶基因表达外,也有文献报道miRNAs能够与靶mRNA的5′-UTR序列结合,增强蛋白质翻译,从而上调基因表达[31~33]。因此,miRNAs调节目的基因的方式与miRNAs的结合序列有关。
3 靶向调控Nrf2-ARE通路的miRNAs
Nrf2-ARE通路是重要的内源性抗氧化应激通路,研究发现,多种miRNAs可以直接或间接作用于该通路,调控Nrf2-ARE信号通路上相关基因的表达,影响机体的氧化还原稳态[34~36],进而参与介导机体的生理活动或病理变化。

图2 miRNAs的合成及作用方式Fig.2 miRNAs biogenesis and mode of action
3.1 靶向Nrf2的miRNAs
Nrf2是Nrf2-ARE抗氧化通路中最为核心的因子,目前的研究表明,多个miRNAs参与调控Nrf2的表达变化,从而调控通路下游各基因的表达或活性,参与机体的抗氧化反应。
miR-153是一类与神经元相关的微小RNA分子,与神经保护作用有关。研究发现,miR-153[37,38]和miR-93[39]均能靶向Nrf2(图1),抑制Nrf2蛋白的表达,使Nrf2/HO-1信号失活,氧化应激诱导神经损伤、凋亡,从而使神经元因缺血再灌注损伤。以上研究说明miR-153、miR-93在体内神经元细胞自我保护过程中,发挥拮抗机体抗氧化应激反应的作用。
此外,研究发现,miR-34a、miR-153、miR-27a、miR-142-5p和miR-144等在SH-SY5Y神经元细胞中能以Nrf2的mRNA 3′-UTR为靶点(图1),直接下调其蛋白质表达,导致大脑中ARE/谷胱甘肽(glutathione,GSH)通路失调,扰乱氧化还原稳态,进而导致帕金森病的发生[40~42]。
在老年大鼠的脑血管内皮细胞中miR-144表达上升,Nrf2表达下降,而且无论在幼年还是老年大鼠的脑血管内皮细胞中,miR-144的过表达均能显著降低Nrf2的表达。经进一步分析证明miR144可通过与Nrf2的3′-UTR结合,从而抑制Nrf2基因表达[43](图1)。在此之前,也有学者在研究镰刀型细胞贫血症病人的血液细胞时,应用计算机靶区扫描分析发现,人Nrf2基因的3′-UTR有2个潜在的miR-144结合区域,即nt265-271和nt370-377,miR-144能够以Nrf2 mRNA为靶点,下调其表达,减少红细胞对氧化应激的耐受性,导致贫血严重程度增加[44]。
抗氧化应激能力随着年龄的增长逐渐减弱,在大鼠肝细胞中Nrf2蛋白含量随着年龄的增长逐渐降低,然而Nrf2 mRNA的量并未随年龄的改变而变化,究其原因主要是miR-146a的高表达,miR-146a能与Nrf2 mRNA结合,阻碍Nrf2转录后的翻译,使其蛋白质含量下降,影响Nrf2-ARE通路的激活,导致下游抗氧化酶的表达下调,进而降低机体抗氧化应激能力[45]。
在正常细胞中,Nrf2对于癌症化学预防和肿瘤抑制起到关键作用。但另一方面,在肿瘤形成和肿瘤保护中,Nrf2也起到主要作用。因此,miRNAs可以通过调控Nrf2的表达,发挥抑癌和致癌的双重作用。
据报道,在乳腺癌细胞中过表达miR-153、miR-93、miR-28均能显著降低Nrf2及下游基因的表达(图1);同时,在乳腺上皮细胞中miR-153能够减少凋亡、增加克隆形成。这些研究结果说明,miR-153、miR-93、miR-28 通过作用于Nrf2 在乳腺癌发生发展过程中起到致癌因子的作用[46~48]。然而,在神经胶质瘤细胞的研究中发现,miR-153通过靶向Nrf2基因,抑制其蛋白质表达,从而促进凋亡、抑制细胞增殖,发挥抑癌作用[49]。
化疗是临床上治疗全身性肿瘤及已经转移的中晚期肿瘤的主要方案,但是药物抵抗常导致化疗效果差、预后不良。研究表明,Nrf2的过表达能够导致癌细胞对化疗药物的抵抗性增加。Shi等[50]发现在对化疗药物顺铂耐受的HepG2细胞中,miR-340的表达显著下调,Nrf2表达上调。生物信息学和荧光素酶报告基因实验分析发现Nrf2是miR-340的直接靶基因。因此,上调miR-340,可以抑制Nrf2-依赖的抗氧化通路,从而增加HepG2细胞对顺铂的敏感性,成为靶向治疗的依据。
在顺铂诱导的急性肾损伤模型中,研究发现,miR-140-5p可通过靶向Nrf2 mRNA的3′-UTR,激活Nrf2-ARE信号通路,增加抗氧化蛋白HO-1、NQO1的表达,从而降低顺铂对肾功能的氧化损伤[51]。
综上研究可知,众多miRNAs可以直接靶向Nrf2的表达,从而下调Nrf2-ARE信号通路(表1)。不同细胞类型中调控Nrf2的miRNAs种类不同,miRNAs的表达是否与细胞类型有关、是否受Nrf2水平的影响还需进一步研究。Nrf2-ARE通路与肿瘤的发生发展密切相关,而miRNAs可以调控该通路,研究是否可以通过靶向miRNAs预防肿瘤形成或促进肿瘤凋亡具有重要的现实指导意义。
3.2 靶向Keap1的miRNAs
Nrf2活性受到胞浆中抑制性蛋白质Keap1的严格调控,多种miRNAs也可以通过作用Keap1来调控Nrf2-ARE信号通路。如miR-29可通过靶向Keap1来调节Nrf2-ARE信号通路(图1)。研究表明,在高糖诱导的肾小管上皮细胞中,miR-29的表达下降,同时Keap1的表达增加,使得Nrf2泛素化增加,从而降低Nrf2的含量,引起肾小管上皮细胞的氧化损伤,导致肾功能紊乱[52]。但另一方面,也有研究指出Nrf2能够调控miR-29家族的基因表达[53]。由此可见,miR-29与Nrf2-ARE信号通路之间存在着非常紧密的联系,但两者之间是否存在反馈调节以及具体调控机制还需进一步探讨。
研究发现在人视网膜色素上皮细胞和视网膜神经节细胞中,miR-141可以通过下调Keap1(图1),引起Nrf2稳定性增强,促进Nrf2向核内转移,从而激活Nrf2-ARE信号通路,启动多种抗氧化基因的转录,如HMOX1、NQO1、GCLC等,最终保护细胞免受紫外线诱导的氧化应激损伤[54]。相关的肿瘤耐药机制研究发现,miR-141通过下调Keap1的表达,激活Nrf2-ARE抗氧化通路,增加肝癌细胞对抗癌药物5-氟尿嘧啶的抵抗性[55],因此,研发抑制miR-141表达的药物,将有望增加肝癌细胞的药物敏感性,为临床治疗提供新思路。
在缺血缺氧性心肌细胞中,过表达miR-200a能显著增加Nrf2的核转移以及下游抗氧化酶基因的表达;抑制miR-200a的表达显示相反的效果,进一步的实验证实miR-200a通过与Keap1的3′-UTR结合(图1),下调Keap1蛋白的表达。由此说明miR-200a可通过抑制Keap1来增加Nrf2,激活Nrf2-ARE信号通路,保护心肌细胞免受低氧和ROS诱导的损伤,发挥细胞保护作用[56]。此外,miR-200a在肝星形细胞中也可以通过靶向Keap1,激活Nrf2-ARE通路,抵抗氧化应激,预防肝细胞纤维化病变[57]。
研究发现在食管鳞状细胞和乳腺上皮细胞中,miR-200a可直接结合Keap1 mRNA的3′-UTR使其降解(图1),抑制Keap1表达,诱导Nrf2向核内转移,增强ARE启动子活性,激活Nrf2-ARE抗氧化通路,发挥肿瘤的化学预防作用[58,59]。而Akdemir等[60]研究发现,miR-432-3p通过直接结合Keap1编码区,下调Keap1表达,增强Nrf2活性,诱导Ⅱ相解毒酶表达,导致食管鳞状细胞癌对顺铂的敏感性降低。
此外,有研究发现脑细胞中高度表达的miR-7在人神经母细胞瘤细胞中也能够与Keap1 mRNA的3′-UTR结合(图1),抑制Keap1表达,进而导致Nrf2活性增加,促进其向核内转移,使下游靶基因HMOX1、GCLM等表达增加,减少ROS诱导的细胞死亡[61]。
尽管目前已发现多种miRNAs可以通过直接靶向Keap1的表达,上调Nrf2-ARE信号通路,参与调节机体的氧化还原反应(表1),但是否还有其他miRNAs调控Keap1仍需进一步研究。
3.3 靶向通路中部分E3泛素化酶的miRNAs
在正常生理状况下,Nrf2与Keap1结合,不断被Cul3(Cullin 3)-E3泛素连接酶泛素化后,通过蛋白酶体途径降解,使Nrf2保持较低水平。因此,Cul3的水平可以影响Nrf2的泛素化,从而影响Nrf2的表达,调控Nrf2-ARE信号通路。
有文献报道,miRNAs可以直接调控Cul3。研究发现,低氧可以诱导miR-101的表达,进一步通过实验证实miR-101能够与Cul3 mRNA的3′-UTR结合,抑制Cul3蛋白表达,从而抑制蛋白酶体降解途径,增加Nrf2的稳定性。此外,有研究显示,过表达miR-101能够促进Nrf2向核内转移,促进HMOX1、血管内皮生长因子的基因表达,对于血管生成、血管重建以及血液脊髓屏障的完整性起到重要作用[62,63]。以上研究提示miR-101可以作为血管生成和血管重建的潜在治疗靶点。
目前,miRNAs调控E3泛素化酶的研究尚少,关于其在泛素化酶系统中的作用尚需进一步研究。
3.4 靶向HMOX1的miRNAs
血红素加氧酶-1(HO-1)是Nrf2-ARE信号通路调控的主要抗氧化酶之一,由HMOX1基因编码,是血红素降解过程中的关键限速酶,可将血红素降解为胆绿素、一氧化碳和二价铁离子,具有抗氧化、抗炎、抗凋亡、抗纤维化等多种生物学作用。
miR-155是与免疫调节最密切相关的一种miRNA,可以调控T细胞的成熟、分化,维持内环境稳态,广泛参与炎症性疾病和肿瘤的形成。相关研究发现,在耗竭性CD4+T细胞中,miR-155表达增加;通过基因芯片对比筛选出了miR-155的潜在靶基因HMOX1,并进一步通过双荧光素酶报告基因和RNA免疫共沉淀实验发现,miR-155 可以与HMOX1 mRNA 3′-UTR 结合(图1),导致HO-1表达降低[64],使机体免疫保护及免疫监视等功能发生障碍,最终可能会导致自身免疫性疾病、慢性感染性疾病的发生。
然而,另有文献报道,HO-1的表达是通过miR-155间接调控,而非直接调控。在人脐静脉内皮细胞中,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)通过 NF-κB 通路诱导 miR-155 的表达,miR-155抑制转录因子BACH1的蛋白质表达,但对胞浆和核内Nrf2的蛋白质表达无影响。BACH1是HMOX1基因的抑制因子,研究进一步发现HMOX1的mRNA和蛋白质表达增加。荧光素酶报告基因实验显示,miR-155能够降低含有BACH1 mRNA 3′-UTR的报告基因活性,并且预测出4个结合位点。以上结果说明,miR-155通过靶向BACH1的表达,降低其活性,从而间接上调HO-1的表达[65],提高细胞的抗炎能力。
大多数miRNAs与靶基因的作用方式主要是通过其5′端的种子序列与mRNA的3′-UTR结合,抑制基因表达。然而,有文献报道在人非小细胞肺癌中,miR-1254可以通过其种子序列和非种子序列对HMOX1发挥双重调控作用(图1)。其一,miR-1254通过其种子序列直接与HMOX1 3′-UTR结合,抑制HO-1蛋白翻译;其二,miR-1254通过其非种子序列与HMOX1的转录激活因子AP2A结合,抑制HMOX1基因转录。miR-1254通过以上两种方式抑制HO-1表达,诱导细胞凋亡和细胞周期阻滞,从而抑制人非小细胞肺癌生长[23]。
HO-1参与调控炎症反应、肿瘤发展,目前关于miRNAs调控HMOX1的报道较少,因此,还需进一步研究发现更多调控HMOX1的miRNAs,从而为免疫性疾病、慢性感染性疾病及肿瘤的防治提供更多的基础数据。
3.5 靶向GCL的miRNAs
γ-谷氨酸半胱氨酸连接酶(γ-glutamyl-cysteine ligase,GCL)是Nrf2-ARE信号通路下游的重要抗氧化酶,包括两个亚基:催化亚基(GCLC)和修饰亚基(GCLM),是谷胱甘肽(GSH)生物合成过程的限速酶,能够调控细胞的氧化还原稳态,维持机体正常的生理功能。
研究发现,在人脐静脉血管内皮细胞中过表达miR-433可下调GCLC、GCLM和GSH的水平,但对Nrf2的表达无影响。更进一步研究发现miR-433可以直接作用于GCLC、GCLM的mRNA 3′-UTR(图1),影响其蛋白质表达,增加血管内皮细胞的氧化损伤,而这种直接调控作用不依赖于Nrf2 的水平[66]。
除了miR-433外,目前尚未查到其他文献报道直接调控GCL的相关miRNAs,因此,还需进一步探索以GCL为靶基因的miRNAs。
综上可知,Nrf2-ARE通路参与调控多种生理病理途径,与多种疾病的发生密切相关,主要包括肿瘤、氧化损伤性疾病、免疫相关性疾病等。除靶向通路相关因子的miRNAs外,还有许多miRNAs间接参与调控该通路中相关因子的表达或活性,本文主要列举了靶向调控Nrf2-ARE通路相关的miRNAs 序列及靶基因[17,23,37~52,54~62,64~70](表1)。
4 展望
关于miRNAs调控Nrf2-ARE信号通路中关键因子Nrf2、Keap1的研究较多,但是miRNAs调控该通路中其他因子的报道较少,并且尚未查到可以直接作用sMaf蛋白,从而间接影响Nrf2-ARE通路的miRNAs,因此,仍需要进一步研究miRNAs与Nrf2-ARE通路的调控关系,以便进一步了解该通路活化或失活的分子机制,为疾病预防提供新的思路。
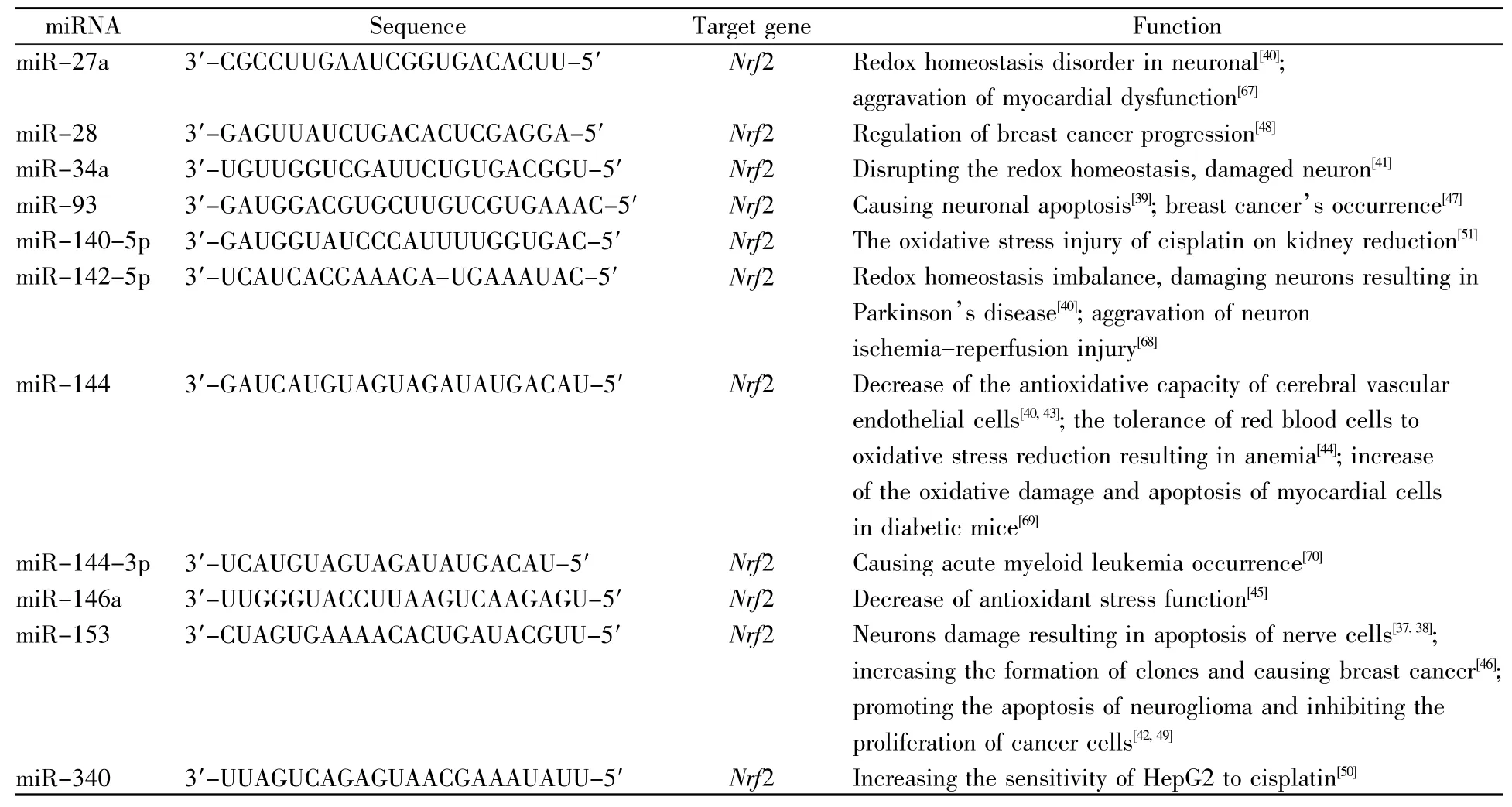
表1 靶向调控Nrf2-ARE通路的miRNAsTable1 miRNAs targeting the regulation of Nrf2-ARE pathway
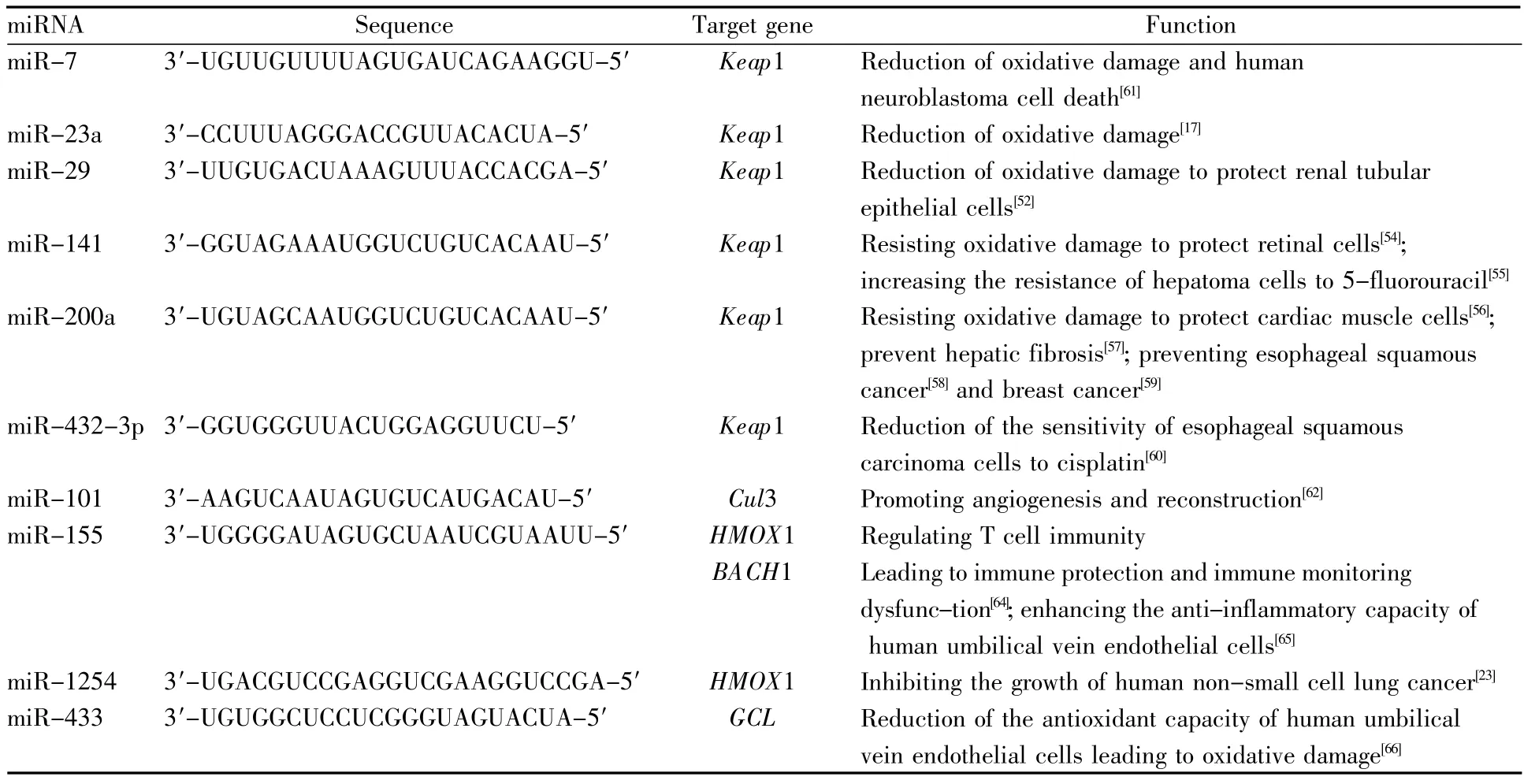
(接上表)
随着miRNAs研究的不断进展,将会发现更多与疾病发生发展有关的miRNAs,可以此为生物标志物,应用于临床检测;同时为研发以miRNAs为治疗靶点的药物提供依据,为将来疾病的诊断、防治提供新策略。
参考文献(References):
[1]Owusu-Ansah E,Banerjee U.Reactive oxygen species primeDrosophilahaematopoietic progenitors for differentiation[J].Nature,2009,461(7263):537-541.
[2]Roy K,Wu Y J,Meitzler J L,et al.NADPH oxidases and cancer[J].Clinical Science,2015,128(12):863-875.
[3]Reuter S,Gupta S C,Chaturvedi M M,et al.Oxidative stress,inflammation,and cancer:how are they linked?[J].Free Radical Biology and Medicine,2010,49(11):1603-1616.
[4]Li M,Marin-Muller C,Bharadwaj U,et al.MicroRNAs:control and loss of control in human physiology and disease[J].World Journal of Surgery,2009,33(4):667-684.
[5]Ludwig N,Becker M,Schumann T,et al.Bias in recent miRBase annotations potentially associated with RNA quality issues[J].Scientific Reports,2017,7(1):5162.
[6]Friedman R C,Farh K K,Burge C B,et al.Most mammalian mRNAs are conserved targets of microRNAs[J].Genome Research,2009,19(1):92-105.
[7]Espinosa-Diez C,Miguel V,Mennerich D,et al.Antioxidant responses and cellular adjustments to oxidative stress[J].Redox Biology,2015,6:183-197.
[8]Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[9]McMahon M,Itoh K,Yamamoto M,et al.Keap1-dependent proteasomal degradation of transcription factor Nrf2 contributes to the negative regulation of antioxidant response element-driven gene expression[J].The Journal of Biological Chemistry,2003,278(24):21592-21600.
[10]Kobayashi A,Kang M I,Okawa H,et al.Oxidative stress sensor Keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2[J].Molecular and Cellular Biology,2004,24(16):7130-7139.
[11]Cullinan S B,Gordan J D,Jin J,et al.The Keap1-BTB protein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase:oxida tive stress sensing by a Cul3-Keap1 ligase[J].Molecular and Cellular Biology,2004,24(19):8477-8486.
[12]Rada P,Rojo A I,Chowdhry S,et al.SCF/β-TrCP promotes glycogen synthase kinase 3-dependent degradation of the Nrf2 transcription factor in a Keap1-independent manner[J].Molecular and Cellular Biology,2011,31(6):1121-1133.
[13]Qin S,Chen J,Tanigawa S,et al.Gene expression profiling and pathway network analysis of hepatic metabolic enzymes targeted by baicalein[J].Journal of Ethnopharmacology,2012,140(1):131-140.
[14]Qin S,Chen J,Tanigawa S,et al.Microarray and pathway analysis highlight Nrf2/ARE-mediated expression profiling by polyphenolicmyricetin[J].MolecularNutrition&FoodResearch,2013,57(3):435-446.
[15]Tanigawa S,Fujii M,Hou D.Action of Nrf2 and Keap1 in ARE-mediated NQO1 expression by quercetin[J].Free Radical Biology and Medicine,2007,42(11):1690-1703.
[16]Li L,Dong H,Song E,et al.Nrf2/ARE pathway activation,HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling[J].Chemico-Biological Interactions,2014,209:56-67.
[17]Danilenko M,Studzinski G P.Keep harm at bay:oxidative phosphorylation induces Nrf2-driven antioxidant response via ERK5/MEF2/miR-23a signaling to Keap-1[J].EBioMedicine,2016,3:4-5.
[18]Shan J L,He H T,Li M X,et al.APE1 promotes antioxidant capacity by regulating Nrf-2 function through a redox-dependent mechanism[J].Free Radical Biology and Medicine,2015,78:11-22.
[19]Tertil M,Golda S,Skrzypek K,et al.Nrf2-heme oxygenase-1 axis in mucoepidermoid carcinoma of the lung:antitumoral effects associated with down-regulation of matrix metalloproteinases[J].Free Radical Biology and Medicine,2015,89:147-157.
[20]Cheng Z G,Zhang G D,Shi P Q,et al.Expression and antioxidation of Nrf2/ARE pathway in traumatic brain injury[J].Asian Pacific Journal of Tropical Medicine,2013,6(4):305-310.
[21]Saw C L L,Guo Y,Yang A Y,et al.The berry constituents quercetin,kaempferol,and pterostilbene synergistically attenuate reactive oxygen species:involvement of the Nrf2-ARE signaling pathway[J].Food and Chemical Toxicology,2014,72:303-311.
[22]Karnati H K,Panigrahi M K,Gutti R K,et al.MiRNAs:key players in neurodegenerative disorders and epilepsy[J].Journal of Alzheimer’s Disease,2015,48(3):563-580.
[23]Pu M,Li C,Qi X,et al.MiR-1254 suppresses HO-1 expression through seed region-dependent silencing and non-seed interaction with TFAP2A transcript to attenuate NSCLC growth[J].PLoS Genetics,2017,13(7):e1006896.
[24]Miao L,Yao H,Li C,et al.A dual inhibition:microRNA-552 suppresses both transcription and translation of cytochrome P450 2E1[J].Biochimica et Biophysica Acta-Gene Regulatory Mechanisms,2016,1859(4):650-662.
[25]Kim D H,Saetrom P,Snøve O,et al.MicroRNA-directed transcriptional gene silencing in mammalian cells[J].Proceedings of the National Academy of Sciences USA,2008,105(42):16230-16235.
[26]Prasad K N.Oxidative stress and pro-inflammatory cytokines may act as one of the signals for regulating microRNAs expression in Alzheimer’s disease[J].Mechanisms of Ageing and Development,2016,162:63-71.
[27]Lytle J R,Yario T A,Steitz J A.Target mRNAs are repressed as efficiently by microRNA-binding sites in the 5′UTR as in the 3′UTR[J].Proceedings of the National Academy of Sciences USA,2007,104(23):9667-9672.
[28]Lee I,Ajay S S,Yook J I,et al.New class of microRNA targets containing simultaneous 5′-UTR and 3′-UTR interaction sites[J].Genome Research,2009,19(7):1175-1183.
[29]Moretti F,Thermann R,Hentze M W.Mechanism of translational regulation by miR-2 from sites in the 5′untranslated region or the open reading frame[J].RNA,2010,16(12):2493-2502.
[30]Jin Y,Wang C,Liu X,et al.Molecular characterization of the microRNA-138-Fos-like antigen 1(FOSL1)regulatory module in squamous cell carcinoma[J].The Journal of Biological Chemistry,2011,286(46):40104-40109.
[31]Jopling C L,Schütz S,Sarnow P.Position-dependent function for a tandem microRNA miR-122-binding site located in the hepatitis C virus RNA genome[J].Cell Host&Microbe,2008,4(1):77-85.
[32]Orom U A,Nielsen F C,Lund A H.MicroRNA-10a binds the 5′UTR of ribosomal protein mRNAs and enhances their translation[J].Molecular Cell,2008,30(4):460-471.
[33]Tsai N P,Lin Y L,Wei L N.MicroRNA miR-346 targets the 5′-untranslated region of receptor-interacting protein 140(RIP140)mRNA and up-regulates its protein expression[J].Biochemical Journal,2009,424(3):411-418.
[34]Kurinna S,Werner S.Nrf2 and microRNAs:new but awaited relations[J].Biochemical Society Transactions,2015,43(4):595-601.
[35]Zhang C,Shu L,Kong A N.MicroRNAs:new players in cancer prevention targeting Nrf2,oxidative stress and inflammatory pathways[J].Current Pharmacology Reports,2015,1(1):21-30.
[36]Ayers D,Baron B,Hunter T.MiRNA influences in Nrf2 pathway interactions within cancer models[J].Journal of Nucleic Acids,2015,2015:143636.
[37]Ji Q,Gao J,Zheng Y,et al.Inhibition of microRNA-153 protects neurons against ischemia/reperfusion injury in an oxygen-glucose deprivation and reoxygenation cellular model by regulating Nrf2/HO-1 signaling[J].Journal of Biochemical and Molecular Toxicology,2017,31(7):e21905.
[38]Narasimhan M,Riar A K,Rathinam M L,et al.Hydrogen peroxide responsive miR153 targets Nrf2/ARE cytoprotection in paraquat induced dopaminergic neurotoxicity[J].Toxicology Letters,2014,228(3):179-191.
[39]Wang P,Liang X,Lu Y,et al.MicroRNA-93 downregulation ameliorates cerebral ischemic injury through the Nrf2/HO-1 defense pathway[J].Neurochemical Research,2016,41(10):2627-2635.
[40]Narasimhan M,Patel D,Vedpathak D,et al.Identification of novel microRNAs in post-transcriptional control of Nrf2 expression and redox homeostasis in neuronal,SH-SY5Y cells[J].PLoS One,2012,7(12):e51111.
[41]Ba Q,Cui C,Wen L,et al.Schisandrin B shows neuroprotective effect in 6-OHDA-induced Parkinson’s disease via inhibiting the negative modulation of miR-34a on Nrf2 pathway[J].Biomedicine&Pharmacotherapy,2015,75:165-172.
[42]Zhang X S,Ha S,Wang X L,et al.Tanshinone IIA protects dopaminergic neurons against 6-hydroxydopamine-induced neurotoxicity through miR-153/NF-E2-related factor 2/antioxidant response element signaling pathway[J].Neuroscience,2015,303:489-502.
[43]Csiszar A,Gautam T,Sosnowska D,et al.Caloric restriction confers persistent anti-oxidative,pro-angiogenic,and anti-inflammatory effects and promotes anti-aging miRNA expression profile in cerebromicrovascular endothelial cells of aged rats[J].American Journal of Physiology-Heart and Circulatory Physi ology,2014,307(3):H292-H306.
[44]Sangokoya C,Telen M J,Chi J T.MicroRNA miR-144 modulates oxidative stresstolerance and associates with anemia severity in sickle cell disease[J].Blood,2010,116(20):4338-4348.
[45]Smith E J,Shay K P,Thomas N O,et al.Age-related loss of hepatic Nrf2 protein homeostasis:potential role for heightened expression of miR-146a[J].Free Radical Biology and Medicine,2015,89:1184-1191.
[46]Wang B,Teng Y,Liu Q.MicroRNA-153 regulates Nrf2 expression and is associated with breast carcinogenesis[J].Clinical Laboratory,2016,62(1-2):39-47.
[47]Singh B,Ronghe A M,Chatterjee A,et al.MicroRNA-93 regulates Nrf2 expression and is associated with breast carcinogenesis[J].Carcinogenesis,2013,34(5):1165-1172.
[48]Yang M,Yao Y,Eades G,et al.MiR-28 regulates Nrf2 expression through a Keap1-independent mechanism[J].Breast Cancer Research and Treatment,2011,129(3):983-991.
[49]黄龙.Nrf2在miR-153调控神经胶质瘤细胞增殖与凋亡中的作用[D].南京:南京大学(Huang Long.The Role of Nrf2 on miR-153 in the Regulation of Proliferation and Apoptosis of Glioblastoma Cells[D].Nanjing:Nanjing University),2013.
[50]Shi L,Chen Z G,Wu L L,et al.MiR-340 reverses cisplatin resistance of hepatocellular carcinoma cell lines by targeting Nrf2-dependent antioxidant pathway[J].Asian Pacific Journal of Cancer Prevention,2014,15(23):10439-10444.
[51]Liao W,Fu Z,Zou Y,et al.MicroRNA-140-5p attenuated oxidative stress in cisplatin induced acute kidney injury by activating Nrf2/ARE pathway through a Keap1-independent mechanism[J].Experimental Cell Research,2017,360(2):292-302.
[52]Zhou L,Xu D Y,Sha W G,et al.High glucose induces renal tubular epithelial injury via Sirt1/NF-kappaB/microR-29/Keap1 signal pathway[J].Journal of Translational Medicine,2015,13:352.
[53]Kurinna S,Schafer M,Ostano P,et al.A novel Nrf2-miR-29-desmocollin-2 axis regulates desmosome function in keratinocytes[J].Nature Communications,2014,5:5099.
[54]Cheng L B,Li K R,Yi N,et al.MiRNA-141 attenuates UV-induced oxidative stress via activating Keap1-Nrf2 signaling in human retinal pigment epithelium cells and retinal ganglion cells[J].Oncotarget,2017,8(8):13186-13194.
[55]Shi L,Wu L,Chen Z,et al.MiR-141 activates Nrf2-dependent antioxidant pathway via down-regulating the expression of Keap1 conferring the resistance of hepatocellular carcinoma cells to 5-fluorouracil[J].Cellular Physiology Biochemistry,2015,35(6):2333-2348.
[56]Sun X,Zuo H,Liu C,et al.Overexpression of miR-200a protects cardiomyocytes against hypoxia-induced apoptosis by modulating the kelch-like ECH-associated protein 1-nuclear factor erythroid 2-related factor 2 signaling axis[J].International Journal of Molecular Medicine,2016,38(4):1303-1311.
[57]Yang J J,Tao H,Hu W,et al.MicroRNA-200a controls Nrf2 activation by target Keap1 in hepatic stellate cell proliferation and fibrosis[J].Cellular Signalling,2014,26(11):2381-2389.
[58]Liu M,Hu C,Xu Q,et al.Methylseleninic acid activates Keap1/Nrf2 pathway via up-regulating miR-200a in human oesophageal squamous cell carcinoma cells[J].Bioscience Reports,2015,35(5):e00256.
[59]Eades G,Yang M,Yao Y,et al.MiR-200a regulates Nrf2 activation by targeting Keap1 mRNA in breast cancer cells[J].The Journal of Biological Chemistry,2011,286(47):40725-40733.
[60]Akdemir B,Nakajima Y,Inazawa J,et al.MiR-432 induces Nrf2 stabilization by directly targeting Keap1[J].Molecular Cancer Research,2017,15(11):1570-1578.
[61]Kabaria S,Choi D C,Chaudhuri A D,et al.MicroRNA-7 activates Nrf2 pathway by targeting Keap1 expression[J].Free Radical Biology and Medicine,2015,89:548-556.
[62]Kim J H,Lee K S,Lee D K,et al.Hypoxia-responsive microRNA-101 promotes angiogenesis via heme oxygenase-1/vascular endothelial growth factor axis by targeting cullin3[J].Antioxidants&Redox Signaling,2014,21(18):2469-2482.
[63]Yu D,Wang Y,Bi Y,et al.Salvianolic acid A ameliorates the integrity of blood-spinal cord barrier via miR-101/Cul3/Nrf2/HO-1 signaling pathway[J].Brain Research,2017,1657:279-287.
[64]张晋渝.MicroRNA-155在T细胞耗竭中的作用及其机制研究[D].重庆:第三军医大学(Zhang Jin-yu.The Characteristics and Roles of MicroRNA-155 in T Cell Exhaustion[D].Chongqing:Third Military Medical University),2013.
[65]Pulkkinen K H,Yla-Herttuala S,Levonen A L.Heme oxygenase 1 is induced by miR-155 via reduced BACH1 translation in endothelial cells[J].Free Radical Biology and Medicine,2011,51(11):2124-2131.
[66]Espinosa-Diez C,Fierro-Fernandez M,Sanchez-Gomez F,et al.Targeting of gamma-glutamyl-cysteine ligase by miR-433 reduces glutathione biosynthesis and promotes TGF-β-dependent fibrogenesis[J].Antioxidants&Redox Signaling,2015,23(14):1092-1105.
[67]Xue W,Bai X,Zhang L.RhTNFR:Fc increases Nrf2 expression via miR-27a mediation to protect myocardium against sepsis injury[J].Biochemical and Biophysical Research Communications,2015,464(3):855-861.
[68]Wang N,Zhang L,Lu Y,et al.Down-regulation of microRNA-142-5p attenuates oxygen-glucose deprivation and reoxygenation-induced neuron injury through up-regulating Nrf2/ARE signaling pathway[J].Biomedicine&Pharmacotherapy,2017,89:1187-1195.
[69]Yu M,Liu Y,Zhang B,et al.Inhibiting microRNA-144 abates oxidativestress and reducesapoptosis in heartsof streptozotocininduced diabetic mice[J].Cardiovascular Pathology,2015,24(6):375-381.
[70]Sun X,Liu D,Xue Y,et al.Enforced miR-144-3p expression as a non-invasive biomarker for the acute myeloid leukemia patients mainly by targeting Nrf2[J].Clinical Laboratory,2017,63(4):679-687.
