秀丽隐杆线虫在神经退行性疾病研究中的应用
2018-06-02王雅丽吴德玲王桐生梁德勤许双旺
凌 伟,王雅丽,吴德玲,王桐生,张 伟,梁德勤,李 正,许双旺
(安徽中医药大学药学院现代中药安徽省重点实验室,中国安徽合肥230012)
神经退行性疾病(neurodegenerative diseases,NDs)是典型的由渐进性神经功能障碍和特定神经通路结构及功能的丧失而导致的行为症状。近年,有关NDs包括阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)和肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)等疾病中分子生物学研究和一些致病突变因子的鉴定技术不断成熟,但全球数百万人的痛苦和社会巨大的负担并没有得到很好的缓解。随着年龄的增长,人们患病风险会迅速增加[1],而中国正处于老龄化人口迅速增长的阶段,这使得NDs成为更多医学研究者关注的焦点。NDs可以由遗传引起(如亨廷顿病),但在大多数情况下具有散发性的发病特点(如阿尔茨海默病和帕金森病)。其发病的机制通常包括蛋白质异常磷酸化、蛋白质棕榈化、致病蛋白质的乙酰化作用、蛋白质错误折叠、缺乏泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)、自噬清除致病蛋白质能力降低、RNA代谢改变、氧化应激、线粒体功能障碍、轴突运输中断、神经炎症和小胶质细胞的激活等[2,3]。
迄今为止,关于NDs的研究进展缓慢,其中一个重要原因就是缺乏合适的疾病动物模型。啮齿类动物模型不能完全模拟NDs的病理特征和疾病发展过程,并且有研究者发现许多药物在啮齿类模型动物实验中有良好治疗效果,但在临床测验中被发现无效,这在一定程度上说明啮齿类动物作为NDs模型可能存在重大的缺陷[4]。与人类更为接近的灵长类动物模型,却存在着生长周期长、基因操作困难、费用高昂等缺陷,难以被广泛应用。因此,为了寻找治疗NDs的有效方法,有研究者采用多种动物模型来筛选药物。目前,关于NDs的致病基因及其调节因子遗传变异的原因尚未完全阐明,而秀丽隐杆线虫(Caenorhabditis elegans),这一模式生物,在解决这些问题以及NDs相关研究中具有独特的优势[5]。
秀丽隐杆线虫通常生活在20℃的环境中,幼虫经历3.5 d生长为成虫,在正常情况下,其生命周期为3周左右。当族群拥挤或食物不足时,会进入另一种幼虫期,叫做dauer幼虫,进入这个时期的线虫可存活数月之久。以秀丽隐杆线虫作为模型研究神经退行性疾病有诸多优点。其一,在秀丽隐杆线虫基因组中,大约有42%的基因与人类疾病存在相关性。许多由遗传因素引起的人类疾病能够在线虫中找到相应的同源染色体,一些重要的基因只有单个位点,从而方便我们进行机理的研究;其二,秀丽隐杆线虫体积小,生命周期短,易于在实验室条件下培养,其成虫长度只有1 mm左右,在100 mm的培养皿中能够培养上千只线虫,这对于药物的筛选非常重要;其三,秀丽隐杆线虫整个生命周期都是透明的,可以通过荧光标记来跟踪研究线虫体内物质的变化,比如绿色和红色荧光蛋白的应用,以及活体检测跨膜蛋白热扩散(x)。秀丽隐杆线虫已经被广泛应用于轴突导向、神经退行性疾病、内吞作用、脂肪代谢等领域的研究;其四,线虫拥有简单但完整的神经系统,有利于深入研究人类神经系统结构和功能。虽然线虫仅包含302个神经元,2 000个神经肌肉接点,大约5 000个突触,但它拥有与人类相似的神经递质,如多巴胺(dopamine,DA)、γ-氨基丁酸(gamma-aminobutyric acid,GABA)、5-羟色胺(5-hydroxytryptamine,5-HT)、乙酰胆碱(acetylcholine,ACh)和谷氨酸等;其五,许多生物学工具都可以在线虫中运用。线虫的基因组和细胞谱系能够被完整的绘制,RNA干扰(RNA interference,RNAi)能够沉默90%的基因。目前,专门用于线虫的基因芯片探针技术已经被商业化,并且能从美国线虫中心获得各种各样的基因敲除突变体。此外,相关遗传学操作(正向遗传学筛选、反向遗传学RNAi筛选和转基因线虫)能够很容易的完成,特定神经元的荧光标记能够在荧光显微镜中直接观察,这就使线虫成为研究神经退行性疾病良好的模型。目前,秀丽隐杆线虫已经被用于建立多种模型,包括与Aβ相关的阿尔茨海默病[6]、与α-synuclein相关的帕金森病[7]、与SOD-1相关的肌萎缩侧索硬化[8]等。近期,就有研究者利用秀丽隐杆线虫转基因模型,研究药物的神经保护作用,发现竹荪多糖具有恢复被百草枯损伤的线粒体的功能,包括膜电位和ATP含量,在多糖的抗氧化活性中主要是压力响应转录因子DAF-16/FOXO起作用,并通过调节多聚谷氨酰胺和β-淀粉样蛋白(amyloidβ-protein,Aβ),从而降低 ROS 水平并缓解行为障碍[9]。除此之外,相关的检测技术也有了很大进步,Cornaglia等[10]利用新的多功能平台建立自动纵向监测NDs秀丽隐杆线虫模型体内蛋白质的聚集状态,为今后实现全自动化和高通量筛选奠定了基础。本文主要回顾近几年来秀丽隐杆线虫在神经退行性疾病研究中的应用,从疾病(阿尔茨海默病、帕金森病和肌萎缩侧索硬化病)的发病机制和潜在治疗药物的筛选两个方面来阐述。
1 秀丽隐杆线虫在阿尔茨海默病(AD)中的应用
阿尔茨海默病是痴呆最常见的一种形式,开始伴随着轻微的记忆缺失和混淆,最终导致严重的精神损伤。通过全基因组关联研究和连锁分析已经确定了695个基因与阿尔茨海默病(AD)有关,其中绝大多数与迟发性AD相关[11]。目前,病人的医疗花费给家庭和社会带来了巨大的负担,因此,预防和治疗AD已经成为人们迫切想要解决的难题之一。
AD神经病变逐渐损害思维能力、沟通能力和记忆力。引发AD的原因有很多,比如遗传因素、环境因素、自身因素等。AD患者的大脑皮质主要以Aβ沉积的方式形成老年斑。Aβ是由β淀粉样前体蛋白(amyloid precursor protein,APP)通过β-分泌酶和γ-分泌酶的逐步裂解而产生的、由40~42个氨基酸组成的小分子多肽[12]。有研究发现高脂血症可与Aβ产生协同作用,进而加重Aβ对神经元的损伤,并促进tau蛋白Thr181位点的过度磷酸化,是引发AD的危险因素[13]。有趣的是,与AD有关的tau基因突变,并不会直接导致AD,而是发生其他NDs,如连锁于17号染色体伴帕金森病的额颞叶痴呆(FTDP-17)[14]。
早发型AD被称为家族性老年痴呆,是由APP突变或早老素1基因(presenilin-1)和早老素2基因(presenilin-2)的突变致使Aβ增加而导致的。晚发型AD又被称为散发性老年痴呆,可能是由于1个或多个基因(APOE,PICALM,CLU/APOJ等)以及环境的变化而产生的[15]。大量实验数据证明,Aβ1~42相对于 Aβ1~40更容易形成低聚物,具有更大毒性[16]。因此,Aβ1~40成为探究AD病情发展和筛选药物新的研究方向。秀丽隐杆线虫体内存在3种早老素基因,分别为sel-12、hop-1和spe-4,对LIN-12/Notch信号传导有着重要的作用[17]。LIN-12/Notch受体在动物生长发育过程中调节细胞与细胞间的相互作用,有研究报道γ-分泌酶复合体除了Notch和APP外还有其他的靶点[18]。这就表明,有必要进一步探讨γ-分泌酶在生物体中的作用。
秀丽隐杆线虫表达的Aβ42源于人类淀粉样蛋白前体cDNA,通过特异性启动子unc-54表达得到。第一个秀丽隐杆线虫Aβ模型就是在线虫体内表达人类的Aβ1~42而获得[19]。目前,已经得到多种不同的秀丽隐杆线虫AD转基因模型[20](表1)。秀丽隐杆线虫所表达的Aβ并不是完整长度的Aβ1~42,而主要是 Aβ3~42的截断产物。体外实验证明Aβ3~42聚集体和 Aβ1~42相似,但是更容易形成纤维状结构。同时 Aβ3~42也是产生 Aβ1~40聚集现象的诱发剂[21]。这个发现使线虫成为研究Aβ3~42加工过程和毒理作用较为理想的模型。此外,相关研究还发现在人的细胞和秀丽隐杆线虫模型中,Aβ能够提高铁含量并且容易产生氧化应激现象[22]。由此可见,线虫体内Aβ的表达与铁含量的积累密切相关。运用Aβ模型研究发现,分子伴侣蛋白HSP-16.2能够保护机体免受Aβ毒性的损伤。与该观点一致的是转基因线虫经过热激处理(35℃,2 h)后,会显著降低Aβ毒性和Aβ低聚物的含量[23]。这些结果证明内源性分子伴侣蛋白对Aβ毒性的调控具有重要作用,同时也为治疗AD提供了新的思路和方法。除此之外,当线虫饮食受到限制时,不仅可以提高线虫的寿命,还能够降低Aβ的毒性[24]。因此,在生物体中机体的衰老和Aβ之间有着密切的联系。
β-淀粉样蛋白染料—硫代黄素T能够提高蛋白质的稳态和线虫的寿命,同时抑制与蛋白质聚集相关的麻痹症状并降低转基因线虫体内Aβ的聚集。这些作用主要与HSF-1、SKN-1、分子伴侣、自体吞噬和蛋白酶体的功能密切相关[25]。这就表明蛋白质内稳态的调节可能对疾病具有奇特的治疗效果。在秀丽隐杆线虫Aβ模型中,缺乏OGlcNAc转移酶(O-GlcNAc transferase,OGT)能够减缓Aβ的毒性,相反,缺乏β-N-乙酰葡糖胺糖苷酶的功能会加剧Aβ的毒性[26]。由此可见,OGT或可成为AD治疗潜在的靶点。
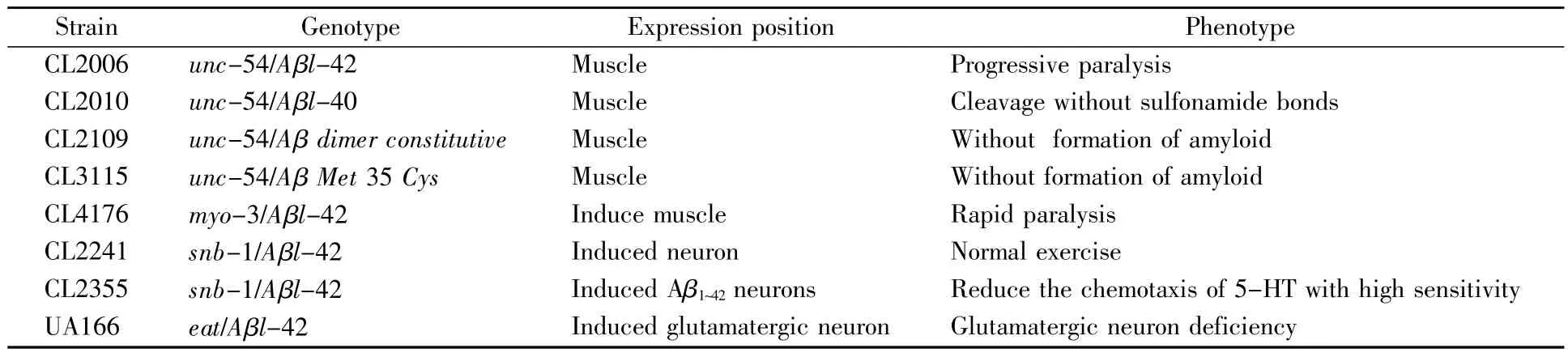
表1 秀丽隐杆线虫的AD转基因模型Table1 Transgenic C.elegans models of AD
过度磷酸化tau蛋白聚集是AD的第二大标志,tau蛋白的聚集也代表着一些其他的神经退行性疾病,比如皮克氏病、唐氏综合征和连锁于17号染色体伴帕金森病的额颞叶痴呆等。
随着研究的不断深入,越来越多的物质被发现具有抗AD的作用,如中药提取物、金属元素、海洋生物等。有研究者通过实验发现小分子物质四环素、铜对Aβ线虫模型均具有很好的保护作用[27,28],因此,四环素曾被提议用于治疗AD。尽管四环素和铜对机体调节的分子机制并不清楚,但有研究发现它们主要与Aβ低聚物相互作用,从而防止它们聚集。在秀丽隐杆线虫中,我们观察到四环素能防止线虫体内Aβ低聚物的聚集并降低其麻痹症状。最近,红芽木提取物被发现可以降低秀丽隐杆线虫AD模型中Aβ毒性,其主要通过调控热休克蛋白HSP-16.2来发挥功能[29]。氧化异阿朴菲生物碱衍生物8-1可以通过调节APP的水平、乙酰胆碱酯酶活力、氧化应激和自我吞噬而降低Aβ毒性。这个研究结果表明通过一种化合物多靶点效应可以抑制AD相关的神经毒性,在未来可能成为治疗AD的有效方法[30]。中药复方六味地黄丸经乙醇提取,含有一些酚类如没食子酸和丹皮酚,这些成分通过上调热激蛋白和降低活性氧类(reactive oxygen species,ROS)含量,来减轻Aβ的毒性[31]。除此之外,蔓越橘提取物[32]、水飞蓟素[33]、咖啡提取物[34]、白藜芦醇[35]、生脉方[36]及石榴[37]等物质也都可以在线虫模型中通过降低Aβ的种类减轻Aβ毒性,从而延缓AD的发病进程。
2 秀丽隐杆线虫在帕金森病(PD)中的应用
帕金森病是继AD后与年龄相关的、在中老年人群中较为常见的中枢神经系统变性疾病,自发或散发的PD影响近2%的65岁以上的老人[38]。其临床表现主要为失眠、抑郁、思觉失调和认知障碍[39]。大脑黑质中多巴胺能神经元缺失导致的多巴胺水平的逐渐减少和身体逐渐失去随意运动的能力是帕金森病的两个特征。然而,这种神经元的缺失不仅仅发生在多巴胺能神经中,胆碱能神经、5-羟色胺能神经、去甲肾上腺素能神经也会被影响。帕金森病重要的神经组织学特征是其神经元中出现路易氏体和营养障碍性神经突两种典型的内含物。这些内含物的出现被当成PD临床症状出现前的信号。除此之外,路易氏体还被当成其他的神经退行性疾病如路易体痴呆的发病信号[40]。突触核蛋白α-synuclein(α-syn,PARK1 基因编码)一般以一种低聚物或纤维状的形式出现在路易氏体和营养障碍性神经突中[41]。近年有报道称,在非变性条件下从神经元和非神经元细胞系、脑组织及人体细胞中分离出的α-syn蛋白是以一种约58 kD折叠四聚物的形式出现[42]。这为人们探究α-syn在生物体中的存在状态及作用提供了重要的线索。
中国近90%PD患者为散发病例,出现在没有明确病史的家庭中。尽管这些病例的病因尚不清楚,但大多数人认为是由遗传和环境因素共同造成的。目前为止,近10%的已知病例是由遗传因素引起的,即众所周知的家族性帕金森病。他们大脑区域由于神经元退变被高度影响,一些遗传性的点突变,如A30P、A53T、E46K、H50Q和G51D,以及3对同作用的SNCA基因,都与常染色体显性遗传的家族性帕金森病有关,这些发现引起更多的人探究自发性帕金森病病理中α-syn的作用[43]。α-syn和富亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2,又名PARK8)编码基因的突变对于常染色体显性遗传帕金森病的产生起重要作用。利用秀丽隐杆线虫开展的相关研究发现,LRRK2蛋白的过度表达导致多巴胺能神经元的缺失;LRRK2的突变会提高激酶活性从而引起神经毒性,在线虫体内通过激酶活性抑制剂GW5074和索拉非尼,可以预防LRRK2蛋白诱导的神经退行性疾病[44]。基于这些结果,有人提出采用LRRK2蛋白活性抑制剂来治疗PD。同样,谷氧还蛋白缺乏也会加剧秀丽隐杆线虫PD模型的神经变性[45]。此外,一些研究发现家族性PD除了PARK1和LRRK2基因产生突变之外,也会涉及其他基因的突变,比如PARK2、PARK6和PARK7的突变[46]。PARK2编码parkin蛋白,parkin具有泛素连接酶E3的活性,能修饰各种蛋白质;PARK6编码蛋白激酶PINK1;PARK7编码DJ-1蛋白,它们主要与常染色体隐性遗传的PD(如少年型帕金森综合征)有关[47]。Hamamichi等[48]通过 RNAi系统的筛选发现,在线虫体内可能存在与PD相关的基因靶点和通路约868个。在体壁神经肌肉中,研究人员通过异体表达人类的α-syn并使用绿色荧光特异性标记DA神经元(Pdat-1::GFP)来观察DA神经元的变化,同时发现如果敲除其中20个基因能够显著增强α-syn的错误折叠率,在这些基因中,存在之前未经报道但在转基因线虫中对多巴胺能神经元损伤具有明显保护作用的基因。这就为PD治疗提供了更多的思路。
原则上,秀丽隐杆线虫并不是最好的PD模型,因为它缺乏α-syn编码基因的同源基因。但线虫遗传多样性使人类基因的转基因表达和多巴胺能神经元退化研究在线虫中得以实现。更重要的是,关于分子遗传学的方法在秀丽隐杆线虫中的运用不断成熟,在不同遗传背景条件下,有关疾病基因的突变对神经元存活率和功能上的影响都能被仔细观察。此外,通过控制实验条件也能同时研究基因和环境对疾病的影响。目前,已有20多个与帕金森病相关的基因被发现,其中也有部分在秀丽隐杆线虫中存在同源基因(表2),为PD的研究提供了极大的方便。
雌雄同体的秀丽隐杆线虫具有相对简单的多巴胺系统,共有8个神经元,分别为头部6个多巴胺能神经元和尾部2个多巴胺能神经元。雄性线虫较雌雄同体线虫有6个额外的多巴胺能神经元分布在尾部[49]。多巴胺的合成、储存和转运机制在线虫体内都是遗传保守的,并且多巴胺神经末梢和突触小泡具有与哺乳动物神经元相似的作用机理。大部分秀丽隐杆线虫PD模型主要是将其暴露在神经毒素或一些金属元素中,使其选择性地损伤多巴胺能神经元而诱导造模。神经毒素主要包括6-羟多巴胺(6-hydroxydopamin,6-OHDA)、CuO、锰、l-甲基-4-苯基吡啶(1-methyl-4-phenylpyridinium,MPP+)、甲基水银等。当秀丽隐杆线虫暴露在6-OHDA中,表现出一种渐进性与选择性的多巴胺能神经元变性和缺失,以神经递质小泡在轴突和树突的形成作为观察依据[50]。
秀丽隐杆线虫PD模型可以用来筛选具有神经保护作用的化合物。Lou等[51]发现柚皮素可以通过激活Nrf2/ARE信号通路来预防6-OHDA诱导的神经毒性损伤。对于抗PD的药物,中药具有独特的疗效,如川芎嗪、远志皂苷、人参皂苷等均具有一定的保护作用[52]。Liu等[53]利用秀丽隐杆线虫PD模型发现,红藻角叉菜提取物能够增强线虫对于氧化应激的耐受力,同时上调应激反应基因sod-3和skn-1,从而产生对生物神经系统的保护作用。此外,人们还发现糙海参提取物也具有抗PD的作用[54]。这些研究都表明,秀丽隐杆线虫模型在研究抗PD药物中具有极大的优势,方便人们对于疗效好的药物进一步开发和利用。
3 秀丽隐杆线虫在肌萎缩侧索硬化(ALS)中的应用
肌萎缩侧索硬化是一种成人型并具有致命性的大脑和脊髓运动神经元功能紊乱与退化的麻痹症。大约10%的ALS患者为家族性ALS(familial ALS,FALS),20%的ALS患者与Cu/Zn超氧化物歧化酶基因1(superoxide dismutase1,SOD1)的突变有关[55]。此外,ubiquilin2[56]、profiling1 等突变不断在ALS中被发现,ALS相关基因在秀丽隐杆线虫模型中的应用也不断丰富(表3)。SOD1在生物体内较为常见,能够表达胞质蛋白质,将超氧阴离子转变成过氧化氢。第一个SOD1错义突变在1993年被发现,SOD1的突变通常会使其功能获得显著的增强,而不是活性的丧失[57]。第一个ALS模型是在启动子hsp16-2或myo-3的启动下,通过引入FALS相关的突变(A4V,G37R和G93A)SOD1而建立的。ALS转基因线虫在一般条件下没有明显的表型,但是在百草枯诱导的氧化应激条件下,线虫突变SOD1的表达就变得非常敏感。并且,氧化应激能够显著延迟秀丽隐杆线虫突变SOD1蛋白的降解并导致突变SOD1在肌肉细胞中异常的聚合[58]。这项发现为探究晚发型FALS提供了新的思路。
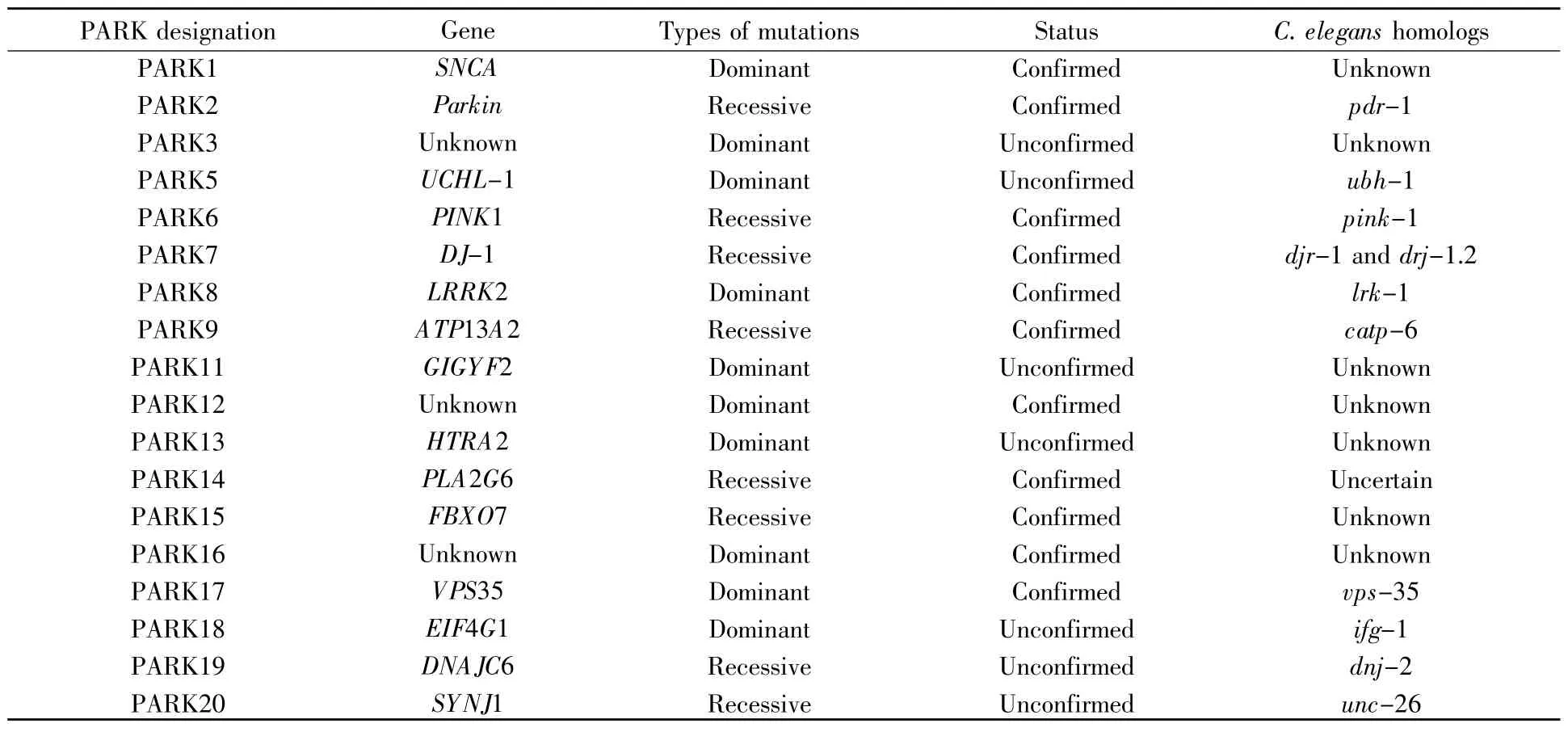
表2 PD相关基因及其在秀丽隐杆线虫中的同源基因Table2 PD-related genes and their homologs in C.elegans
Gidalevitz等[59]以秀丽隐杆线虫为模型,unc-54为启动子,将野生型或突变SOD1蛋白在体壁肌肉细胞中表达黄色荧光蛋白作为标记来研究SOD1聚集所带来的影响。此外,Silva等[60]进行了全基因组RNAi筛选,确定23个基因能够抑制G93A SOD1蛋白聚集并恢复动物的运动能力,为后期的研究奠定了基础。
除了unc-54启动子外,秀丽隐杆线虫神经元在启动子snb-1的启动下也可以表达G85R SOD1,表现出明显的运动缺陷。Lim等[61]利用G85R SOD1转基因线虫发现当aak-2被抑制时,不溶性的SOD1并没有降低,却能够显著增强线虫运动能力。aak-2与老鼠腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)同源,当ALS老鼠模型的AMPK被抑制时,同样能观察到类似的保护作用。AMPK是细胞能量状态的主要传感器,当ATP供应跟不上需求时就会被激活。由此可见,AMPK参与ALS有关的代谢,能量代谢异常可能与运动神经元疾病相关。
众所周知,线虫体内daf-2基因编码胰岛素/胰岛素样生长因子受体,胰岛素/胰岛素样生长因子1信号通路是机体衰老关键的调节器,而daf-2的突变能够显著延长线虫的寿命[62]。机体衰老在多种神经退行性疾病中是共同的危险因素,上述实验结果表明调节胰岛素/胰岛素样生长因子1信号通路可能会为ALS的治疗带来新的突破口。
TDP-43主要分布在细胞核中,能够在体内广泛表达,它主要与DNA和RNA结合,具有多重功能,如转录抑制、选择性剪接mRNA以及调节mRNA的稳定性。在ALS患者的运动神经元中,TDP-43是泛素阳性包涵体的主要组成部分[63]。第一个与TDP-43有关的ALS秀丽隐杆线虫模型是以神经元经snb-1启动子异体表达人类TDP-43蛋白而获得[64]。有研究者通过M337V TDP-43转基因线虫寻找能够防止TDP-43磷酸化作用的靶点,从而探究细胞分裂周期相关蛋白激酶7(cell division cycle 7-related protein kinase,CDC7)在ALS中作用,发现调节CDC7的表达可能是ALS有效的治疗方法[65]。
FUS是细胞核DNA和RNA重要的结合蛋白,参与了RNA的加工,约5%FALS患者是由于FUS基因的突变而导致的。通过对FUS突变影响的研究发现,细胞质的错位分布和聚集与渐进性运动功能障碍有关;而且,运动功能障碍并不能通过表达FUS蛋白而被治愈,表明这可能与FUS的突变或其RNA功能紊乱有关[66]。除此之外,Vaccaro等[67]发现亚甲蓝能够抑制线虫体内TDP-43和FUS的神经毒性;Aaron等[68]报道枫糖浆能够降低线虫ALS模型中TDP-43蛋白毒性,为今后筛选、治疗ALS提供了新的方向。

表3 ALS相关基因在秀丽隐杆线虫模型中的应用Table3 Application of ALS-related genes in C.elegans model
4 小结与展望
综上所述,秀丽隐杆线虫可以作为单基因模型来研究与人类同源的特定基因,还能以人类的基因进行转基因表达,从而对药物的活性进行筛选。由于线虫只有1 mm长,其行为能够在液体中被清楚的观察,这就意味着可以用作各种药物的高通量筛选,有助于寻找新的特定临床治疗药物。许多人类疾病相关基因的发现让我们对于神经退行性疾病的认识更加深入,一些与神经退行性疾病相关的通路已经通过秀丽隐杆线虫和其他无脊椎动物模型表示出来,这就使得我们可以通过基因技术在无脊椎生物模型中描述众多守恒的机制,包括细胞凋亡、Ras/MAPK、PINK1-Parkin以及其他信号通路[69]。细胞蛋白质稳态和伴侣蛋白的功能在病理中至关重要,如特定分子伴侣的过度表达能够改善神经毒性[70]。此外,胰岛素样信号通路在衰老过程中的作用也能帮助我们探索机体衰老对神经退行性疾病的影响。
在模式生物中分析与疾病相关的基因对于理解疾病的进程具有很大帮助。尽管秀丽隐杆线虫并不是研究人类神经退行性疾病最好的病理生理学模型,但由于线虫形体小且透明,利于对某些疾病相关蛋白质的神经毒性进行观察和分类,且非常适合化合物的光活化,使得新的技术如光遗传学技术很容易在其中得以应用。最重要的是,关于遗传学的研究发展迅速,例如正向遗传学和反向遗传学在线虫模型中的应用,已经确定了许多与神经退行性疾病相关的新的基因和通路,使我们在研究与基因相关的疾病时能够广泛地使用线虫模型。这能帮助我们探究与疾病相关蛋白质的毒性机制,从而确定最终导致神经元缺失的体内因素。尽管人类某些与神经退行性疾病有关的基因已经被确定,但对于神经变性的机理还不能完全解释清楚。对于这些基因导致神经元退化的原因及疾病相关蛋白质导致神经功能障碍的原因还没有明确的定义。随着这些难题的解决,将会为NDs的治疗提供更好的思路和方法。由此可见,随着科技的不断发展,新的技术和新的致病因子不断被发现,人们对于神经退行性疾病必然有更加深入的了解和突破,秀丽隐杆线虫在神经退行性疾病及其他疾病上的应用也会更加广泛。
参考文献(References):
[1]Labbadia J,Morimoto R I.The biology of proteostasis in aging and disease[J].Annual Review of Biochemistry,2015,84(1):435-464.
[2]Dreser A,Vollrath J T,Sechi A,et al.The ALS-linked E102Q mutation in Sigma receptor-1 leads to ER stress-mediated defects in protein homeostasis and dysregulation of RNA-binding proteins[J].Cell Death and Differentiation,2017,24(10):1655-1671.
[3]Ehrnhoefer D E,Wong B K,Hayden M R.Convergent pathogenic pathways in Alzheimer’s and Huntington’s diseases:shared targets for drug development[J].Nature Reviews Drug Discovery,2011,10(11):853-867.
[4]姚紫彤,王舒波,卢静,等.阿尔茨海默病致病基因突变相关的啮齿类动物和非人灵长类动物模型[J].实验动物科学(Yao Zi-tong,Wang Shu-bo,Lu Jing,et al.Rodent and non-human primate models of Alzheimer’s disease related gene mutation[J].Laboratory Animal Science),2016,33(6):59-63.
[5]Wang Y A,Kammenga J E,Harvey S C.Genetic variation in neurodegenerative diseases and its accessibility in the model organismCaenorhabditis elegans[J].Human Genomics,2017,11:12.
[6]Luo Y,Yue W,Quan X,et al.Asymmetric dimethylarginine exacerbates Aβ-induced toxicity and oxidative stress in human cell andCaenorhabditis elegansmodels of Alzheimer disease[J].Free Radical Biology&Medicine,2015,79:117-126.
[7]Nagarajan A,Bodhicharla R,Winter J,et al.A fluorescence resonance energy transfer assay for monitoring α-synclein aggregation in aCaenorhabditis elegansmodel for Parkinson’s disease[J].CNS&Neurological Disorders Drug Targets,2015,14(8):1054-1068.
[8]Zhai J,Zhang L,Mojsilovic-Petrovic J,et al.Inhibition of cytohesins protects against genetic models of motor neuron disease[J].Journal of Neuroscience,2015,35(24):9088-9105.
[9]Wang X,Cao M,Dong Y.Royal jelly promotes DAF-16-mediated proteostasis to tolerateβ-amyloid toxicity inC.elegansmodel of Alzheimer’s disease[J].Oncotarget,2016,7(34):54183-54193.
[10]Cornaglia M,Krishnamani G,Mouchiroud L,et al.Automated longitudinal monitoring ofin vivoprotein aggregation in neurodegenerative diseaseC.elegansmodels[J].Molecular Neurodegeneration,2016,11:17.
[11]Vahdati Nia B,Kang C,Tran M G,et al.Meta analysis of human AlzGene database:benefits and limitations of usingC.elegansfor the study of Alzheimer’s disease and co-morbid conditions[J].Frontiers in Genetics,2017,8:55.
[12]Omtri R S,Davidson M W,Arumugam B,et al.Differences in the cellular uptake and intracellular itineraries of amyloid beta proteins 40 and 42:ramifications for the Alzheimer’s drug discovery[J].Molecular Pharmaceutics,2012,9(7):1887-1897.
[13]侯江淇,张欣,龙倩,等.高脂血症与Aβ的协同作用促进引发阿尔茨海默症[J].中国药理学通报(Hou Jiang-qi,Zhang Xin,Long Qian,et al.Study of synergistic effects of hyperlipoproteinemia and Aβin processing of Alzheimer’s disease[J].Chinese Pharmacological Bulletin),2017,33(4):498-506.
[14]Yotsumoto K,Saito T,Asada A,et al.Effect of Pin1 or microtubule binding on dephosphorylation of FTDP-17 mutant tau[J].The Journal of Biological Chemistry,2009,284(25):16840-16847.
[15]Tong M,Leão R,Vimbela G V,et al.Altered temporal lobe white matter lipid ion profiles in an experimental model of sporadic Alzheimer’s disease[J].Molecular and Cellular Neuroscience,2017,82:23-34.
[16]Bergkvist L,Sandin L,Kågedal K,et al.AβPP processing results in greater toxicity per amount of Aβ1-42than individually expressed and secreted Aβ1-42inDrosophila melanogaster[J].Biology Open,2016,5(8):1030-1039.
[17]Jarriault S,Greenwald I.Suppressors of the egg-laying defective phenotype ofsel-12 presenilin mutants implicate the CoREST corepressor complex in LIN-12/Notch signaling inC.elegans[J].Genes&Development,2002,16(20):2713-2728.
[18]Tomita T.Probing the structure and function relationships of presenilin by substituted-cysteine accessibility method[J].Methods in Enzymology,2017,584:185-205.
[19]Link C D.Expression of human beta-amyloid peptide in trans genicCaenorhabditis elegans[J].Proceesings of the National A-cademy of Sciences USA,1995,92(20):9368-9372.
[20]Van Raamsdonk J M,Hekimi S.Reactive oxygen species and aging inCaenorhabditis elegans:causal or casual relationship[J].Antioxidants&Tedox Signaling,2010,13(12):1911-1953.
[21]Maman M,Carvalhal Marques F,Volovik Y,et al.A neuronal GPCR is critical for the induction of the heat shock response in the nematodeC.elegans[J].Journal of Neuroscience,2013,33(14):6102-6111.
[22]Meadowcroft M D,Peters D G,Dewal R P,et al.The effect of iron in MRI and transverse relaxation of amyloid-beta plaques in Alzheimer’s disease[J].NMR in Biomedicine,2015,28(3):297-305.
[23]Wu Y,Cao Z W,Luo Y.Heat shock treatment reduces beta amyloid toxicityin vivoby diminishing oligomers[J].Neurobiology of Aging,2010,31(6):1055-1058.
[24]Greer E L,Brunet A.Different dietary restriction regimens extend lifespan by both independent and overlapping genetic pathways inC.elegans[J].Aging Cell,2009,8(2):113-127.
[25]Bose S,Cho J.Targeting chaperones,heat shock factor-1,and unfolded protein response:promising therapeutic approaches for neurodegenerative disorders[J].Ageing Research Reviews,2017,35:155-175.
[26]Wang P,Lazarus B D,Forsythe M E,et al.O-GlcNAc cycling mutants modulate proteotoxicity inCaenorhabditis elegansmodels of human neurodegenerative diseases[J].Proceedings of the NationalAcademyofSciencesUSA,2012,109(43):17669-17674.
[27]Diomede L,Cassata G,Fiordaliso F,et al.Tetracycline and its analogues protectCaenorhabditis elegansfrom beta amyloidinduced toxicity by targeting oligomers[J].Neurobiolgy of Disease,2010,40(2):424-431.
[28]Rebolledo D L,Aldunate R,Kohn R,et al.Copper reduces A-beta oligomeric species and ameliorates neuromuscular synaptic defects in aC.elegansmodel of inclusion body myositis[J].Journal of Neuroscience,2011,31(28):10149-10158.
[29]Keowkase R,Weerapreeyakul N.Cratoxylum formosumextract protects against amyloid-beta toxicity in aCaenorhabditis elegansmodel of Alzheimer’s disease[J].Planta Medica,2016,82(6):516-523.
[30]Huang L,Luo Y,Pu Z,et al.Oxoisoaporphine alkaloid derivative 8-1 reduces Aβ1-42 secretion and toxicity in human cell andCaenorhabditis elegansmodels of Alzheimer’s disease[J].Neurochemistry International,2017,108:157-168.
[31]Sangha J S,Sun X,Wally O S,et al.Liuwei Dihuang(LWDH),a traditional Chinese medicinal formula,protects againstβ-amyloid toxicity in transgenicCaenorhabditis elegans[J].PLoS One,2012,7(8):e43990.
[32]Guo H,Cao M,Zou S,et al.Cranberry extract standardized for proanthocyanidins alleviatesβ-amyloid peptide toxicity by improving proteostasis through HSF-1 inCaenorhabditis elegansmodel of Alzheimer’s disease[J].Journals of Gerontology Series A-Biological Sciences and Medical Sciences,2016,71(12):1564-1573.
[33]Kumar J,Park K C,Awasthi A,et al.Silymarin extends lifespan and reduces proteotoxicity inC.elegansAlzheimer’s model[J].CNS&Neurological Disorders Drug Targets,2015,14(2):295-302.
[34]Dostal V,Roberts C M,Link C D.Genetic mechanisms of coffee extract protection in aCaenorhabditis elegansmodel of betaamyloid peptide toxicity[J].Genetics,2010,186(3):857-866.
[35]Regitz C,Fitzenberger E,Mahn F L,et al.Resveratrol reduces amyloid-beta(Aβ1-42)-induced paralysis through targeting proteostasis in an Alzheimer model ofCaenorhabditis elegans[J].European Journal of Nutrition,2016,55(2):741-747.
[36]Zhang W,Zhi D,Ren H,et al.Shengmai Formula ameliorates pathological characteristics in ADC.elegans[J].Cellular and Molecular Neurobiology,2016,36(8):1291-1302.
[37]Yuan T,Ma H,Liu W,et al.Pomegranate’s neuroprotective effects against Alzheimer’s disease are mediated by urolithins,its ellagitannin-gut microbial derived metabolites[J].ACS Chemical Neuroscience,2016,7(1):26-33.
[38]邓婕,李怡芳,栗原博,等.线粒体损伤与修复在帕金森病中的作用[J].中国药理学通报(Deng Jie,Li Yi-fang,Li Yuanbo,et al.The role of mitochondrial damage and repair in Parkinson’s disease[J].Chinese Pharmacological Bulletin),2015,31(7):906-909.
[39]JostWH.Anupdateontherecognitionandtreatment of autonomic symptoms in Parkinson’s disease[J].Expert Review of Neurotherapeutics,2017,17(8):791-799.
[40]McKeith I,Cummings J.Behavioural changes and psychological symptoms in dementia disorders[J].The Lancet Neurology,2005,4(11):735-742.
[41]Wood H.Parkinson disease:plasmaα-synuclein-a potential marker of cognitive impairment in Parkinson disease[J].Nature Review Neurology,2017,13(8):450.
[42]Bartels T,Choi J G,Selkoe D J.Alpha-synuclein occurs physiologically as a helically folded tetramer that resists aggregation[J].Nature,2011,477(7362):107-110.
[43]Proukakis C,Dudzik C G,Brier T,et al.A novel alpha-synuclein missensemutationin Parkinson disease[J].Neurology,2013,80(11),1062-1064.
[44]Liu Z,Hamamichi S,Lee B D,et al.Inhibitors of LRRK2 kinase attenuate neurodegeneration and Parkinson-like phenotypes inCaenorhabditis elegansandDrosophilaParkinson’s disease models[J].Human Molecular Genetics,2011,20(20):3933-3942.
[45]Johnson W M,Yao C,Siedlak S L,et al.Glutaredoxin deficiency exacerbates neurodegeneration inC.elegansmodels of Parkin son’s disease[J].Human Molecular Genetics,2015,24(5):1322-1335.
[46]Angeles D C,Ho P,Chua L L,et al.Thiol peroxidases ameliorate LRRK2 mutant-induced mitochondrial and dopaminer gic neuronal degeneration inDrosophila[J].Human Molecular Genetics,2014,23(12):3157-3165.
[47]Lopez-Fabuel I,Martin-Martin L,Resch-Beusher M,et al.Mitochondrial respiratory chain disorganization in Parkinson’s disease-relevant PINK1 and DJ1 mutants[J].Neurochemistry International,2017,109:101-105.
[48]Hamamichi S,Rivas R N,Knight A L,et al.Hypothesis-based RNAi screening identifies neuroprotective genes in a Parkinson’s disease model[J].Proceedings of the National Academy of Sciences USA,2008,105(2):728-733.
[49]Valente E M,Abou-Sleiman P M,Caputo V,et al.Hereditary early-onsetParkinson’sdiseasecausedbymutationsinPINK1[J].Science,2004,304(5674):1158-1160.
[50]Li H,Shi R,Ding F,et al.Astragalus polysaccharide suppresses 6-hydroxydopamine-induced neurotoxicity inCaenorhabditis elegans[J].Oxidative Medicine and Cellular Longevity,2016,2016:4856761.
[51]Lou H,JingX,WeiX,etal.Naringenin protectsagainst 6-OHDA-induced neurotoxicity via activation of the Nrf2/ARE signaling pathway[J].Neuropharmacology,2014,79:380-388.
[52]袁惠莉,汪璇,张丽娟,等.中药在防治帕金森病中的作用及研究进展[J].中国药理学通报(Yuan Hui-li,Wang Xuan,Zhang Li-juan,et al.Mechanism and research progress of Chinese traditional medicine in the prevention and treatment of Parkinson’s disease[J].Chinese Pharmacological Bulletin),2010,26(7):850-854.
[53]Liu J,Banskota A H,Critchley A T,et al.Neuroprotective effects of the cultivatedChondrus crispusin aC.elegansmodel of Parknson’s disease[J].Marine Drugs,2015,13(4):2250-2266.
[54]Chalorak P,Jattujan P,Nobsathian S,et al.Holothuria scabraextracts exhibit anti-Parkinson potential inC.elegans:a model for anti-Parkinson testing[J].Nutritional Neuroscience,2017,9(5):1-12.
[55]Robberecht W,Philips T.The changing scene of amyotrophic lateral sclerosis[J].Nature Reviews Neuroscience,2013,14(4):248-264.
[56]Scotter E L,Smyth L,Bailey J A,et al.C9ORF72 andUBQLN2 mutations are causes of amyotrophic lateral sclerosis in New Zealand:a genetic and pathologic study using banked human brain tissue[J].Neurobiology of Aging,2017,49:214.e1-214.e5.
[57]Valentine J S,Doucette P A,Zittin S P.Copper-zinc superoxide dismutase and amyotrophic lateral sclerosis[J].Annual Review Biochemistry,2005,74(74):563-593.
[58]Oeda T,Shimohama S,Kitagawa N,et al.Oxidative stress causes abnormal accumulation of familial amyotrophic lateral sclerosisrelated mutant SOD1 in transgenicCaenorhabditis elegans[J].Human Molecular Genetics,2001,10(19):2013-2023.
[59]Gidalevitz T,Krupinski T,Garcia S,et al.Destabilizing protein polymorphisms in the genetic background direct phenotypic expression of mutant SOD1 toxicity[J].PLoS Genetics,2009,5(3):e1000399.
[60]Silva M C,Fox S,Beam M,et al.A genetic screening strategy identifies novel regulators of the proteostasis network[J].PLoS Genetics,2011,7(12):e1002438.
[61]Lim M A,Selak M A,Xiang Z,et al.Reduced activity of AMP-activated protein kinase protects against genetic models of motor neuron disease[J].Neuroscience,2012,32(3):1123-1141.
[62]Yan B,Sun W,Shi X,et al.Angiostrongylus cantonensisdaf-2 regulates dauer,longevity and stress inCaenorhabditis elegans[J].Veterinary Parasitology,2017,15(240):1-10.
[63]Cykowski M D,Powell S Z,Peterson L E,et al.Clinical significance of TDP-43 neuropathology in amyotrophic lateral sclerosis[J].Journal of Neuropathology and Experimental Neurology,2017,76(5):402-413.
[64]Ash P,Zhang Y J,Roberts C M,et al.Neurotoxic effects of TDP-43 overexpression inC.elegans[J].Human Molecular Genettics,2010,19(16):3206-3218.
[65]Liachko N F,McMillan P J,Guthrie C R,et al.CDC7 inhibition blocks pathological TDP-43 phosphorylation and neurodegeneration[J].Annals of Neurology,2013,74(1):39-52.
[66]Murakami T,Qamar S,Lin J Q,et al.ALS/FTD mutation induced phase transition of FUS liquid droplets and reversible hydrogels into irreversible hydrogels impairs RNP granule function[J].Neuron,2015,88(4):678-690.
[67]Vaccaro A,Patten S A,Ciura S,et al.Methylene blue protects against TDP-43 and FUS neuronal toxicity inC.elegansandD.rerio[J].PLoS One,2012,7(7):e42117.
[68]Aaron C,Beaudry G,Parker J A,et al.Maple syrup decreases TDP-43 proteotoxicity in aCaenorhabditis elegansmodel of amyotrophic lateral sclerosis(ALS)[J].Journal of Agricultural and Food Chemistry,2016,64(17):3338-3344.
[69]Liu Y,Zhi D,Li M,et al.Shengmai Formula suppressed overactivated Ras/MAPK pathway inC.elegansby opening mitochondrial permeability transition pore via regulating cyclophilin D[J].Scientific Reports,2016,6:38934.
[70]Dimitriadi M,Hart A C.Neurodegenerative disorders:insights from the nematodeCaenorhabditis elegans[J].Neurobiology of Disease,2010,40(1):4-11.
