广州地区中老年男性RANK/RANKL/OPG和WNT信号通路基因多态性与髋部骨强度的关联分析
2018-06-02王希丹肖苏妹陈裕明
王希丹,肖苏妹,陈裕明
(中山大学公共卫生学院,中国广东广州510080)
骨质疏松是中老年人群中一种常见的慢性疾病,可导致骨强度降低和骨折风险显著增加[1]。目前,针对骨质疏松的研究中,骨密度(bone mineral density,BMD)是最常用的研究表型,它主要体现影响骨强度的骨量。但是越来越多的证据显示,骨强度的另一个决定因素,即反映骨骼质量的骨几何结构,对骨质疏松也具有独立影响[2]。相比于BMD,BMD结合骨几何结构可以更好地预测骨折风险[3]。骨质疏松有较强的遗传决定性,遗传率在0.50到0.85之间[4]。现有研究显示,RANK/RANKL/OPG信号通路在调节骨重建方面具有不可忽视的功能[5],WNT信号通路不仅能够诱导成骨细胞分化,促进骨沉积,而且还能调节破骨细胞的形成和功能[6],它们是骨代谢中两条重要的信号通路。全基因组关联研究和大型荟萃分析发现,位于这两条信号通路中的基因与BMD显著相关[7]。然而,这些研究多以欧洲人群以及绝经后女性为研究对象。有研究提出遗传因素对骨质疏松的影响可能存在种族和性别差异[8]。目前,在中国男性人群中的相关研究相对较少,特别是对骨几何结构的影响并不清楚。因此,本研究探讨了位于RANK/RANKL/OPG和WNT信号通路中6个基因的10个单核苷酸多态性(single nucleotide poly-morphism,SNP)位点与中国广州中老年男性人群髋部BMD和骨几何结构参数的关联,为全面理解骨强度的影响因素以及有效防治骨质疏松提供一定的理论依据。
1 材料和方法
1.1 研究对象
本研究人群来自于中山大学5010项目之一的广州营养健康研究队列[9],该队列建立于2008年,每3年进行一次随访,主要用于研究骨质疏松和心血管相关疾病。研究对象招募于广州市越秀区农林社区。纳入标准为:40岁以上,且在广州本地居住超过5年的男性志愿者。排除标准包括:1)曾患/现患影响骨、钙代谢的相关疾病,如骨代谢障碍,或一些慢性内分泌疾病如甲亢、甲旁亢等,以及有重大胃肠手术史;2)曾经/现在服用影响骨、钙代谢的药物,如磷酸盐、降钙素、活性维生素D3代谢物等;3)存在影响本研究骨表型测量的因素,如左侧髋部骨折等。本研究选取该队列2011年第一次随访数据进行横断面研究,共有788名满足纳入排除标准的男性进入分析。本研究获得了所有研究对象的书面知情同意,并且通过了中山大学公共卫生学院伦理委员会的批准。
1.2 研究方法
1.2.1 骨表型的测定
本研究采用美国Hologic公司生产的HO LOGIC Discovery-W型号双能X线吸收仪(dualenergy X-ray absorptiometry,DXA)检测研究对象左侧髋部BMD(g/cm2),并且应用仪器自带的APEX 3.2程序对髋部扫描片中股骨颈进行测量和分析,得到以下骨几何结构参数:1)横截面积(cross-sectional area,CSA,cm2):除去软组织和骨小梁后骨的横截面积;2)平均皮质厚度(average cortical thickness,ACT,cm):骨内径和外径之差的二分之一;3)剖面模数(section modulus,SM,cm3):反映了骨骼承受最大侧面压力时的抗弯曲强度;4)抗屈曲率(buckling ratio,BR):评价骨骼屈曲时皮质的稳定性。BMD、CSA、ACT、SM 越大,BR 越小,则骨强度越大。以上各项骨表型指标的变异系数分别是:BMD,1.92%;CSA,1.55%;ACT,2.19%;SM,2.99%;BR,4.62%。
1.2.2 SNP位点基因分型
取研究对象外周血3 mL,采用天根生化科技(北京)有限公司生产的DP318-03型号血液基因组DNA提取试剂盒提取外周血白细胞DNA。本研究选取了全基因组关联研究或荟萃分析中报道的与BMD显著关联的SNP位点,同时参考千人基因组计划中国人群的数据(http://browser.1000genomes.org/),当多个SNP位点存在连锁不平衡(r2>0.8)时仅取其中一个SNP进行分析,最终选择了位于RANK/RANKL/OPG和WNT信号通路中的6个基因的10个SNP位点,即RANK/RANKL/OPG信号通路:骨保护素(osteoprotegerin,OPG)基因中的 rs2073617、rs2073618、rs3134069,核因子 Kappa-B受体活化因子(receptor activator of nuclear factor-kappa B,RANK)基因中的rs3018362,核因子Kappa-B受体活化因子配体(receptor activator of nuclear factor-kappa B ligand,RANKL)基因中的rs9594738;WNT信号通路:低密度脂蛋白受体相关蛋白5(low-density lipoprotein receptor-relat-ed protein5,LRP5)基因中的 rs3736228、rs491347,WNT16基因中的rs3801387以及硬骨素(sclerostin,SOST)基因中的rs1107748和rs1513670。采用美国SEQUENOM公司MassArray时间飞行质谱技术完成样品SNP位点的基因分型。其中,基因分型成功率低于95%,次等位基因频率(minor allele frequency,MAF)小于5%或基因型分布不满足哈-温平衡(Hardy-Weinberg equilibrium,HWE)检验(P<0.05)的SNP位点则被剔除。
1.2.3 混杂因素的测量
本研究由经过统一培训的调查员利用问卷形式对研究对象的基本信息、疾病史、用药史、生活饮食习惯(如吸烟、饮酒等)以及体力活动进行面对面询问并记录。研究中将每天至少吸一支烟且累计超过6个月和每周至少饮酒一次且累计超过6个月分别定义为有吸烟和饮酒习惯。体力活动评价是基于一份19项的问卷调查,计算每天各种体力活动的代谢当量(metabolic equivalent,MET)时间加权的总和(MET·h/d)。此外,每位研究对象的身高(cm)、体重(kg)以及体重指数(body mass index,BMI,kg/m2)均采用标准方法进行测量和计算。
1.3 统计学分析
采用SPSS 19.0(SPSS Inc.,Chicago,IL,USA)软件进行研究对象基本资料统计描述。本研究的定量资料均满足正态分布,用均数±标准差(±s)进行描述,定性资料用频数(n)和频率(%)进行描述。SNP位点的质量检测及其与骨表型的关联分析,以及基因-基因交互作用分析均采用PLINK 1.07软件(http://pngu.mgh.harvard.edu/purcell/plink)进行。采用加性模型下的多重线性回归分析所检测SNP位点与骨表型的关联,次等位基因为效应等位基因,校正的混杂因素包括年龄、身高、体重、吸烟、饮酒以及体力活动。由于本研究是根据已报道的与BMD显著关联的SNP位点进行验证研究,因此在SNP位点的关联分析中认为单侧检验P<0.05,且关联方向与已报道的研究中方向一致则具有统计学意义。基因-基因交互作用采用相乘模型进行分析,应用Bonferroni法进行多重检验校正。
2 结果
2.1 研究对象基本情况
本研究中788名男性的基本情况见表1。研究对象的平均年龄和BMI分别是62.240±5.893岁和24.076±3.026 kg/m2。吸烟人数为386人,占总人群的48.985%。有饮酒习惯的共有125人,占总人群的15.863%。股骨颈BMD、CSA、ACT、SM以及BR的均值(标准差)分别为:0.749(0.112)g/cm2,3.062(0.479)cm2,0.180(0.030)cm,1.622(0.313)cm3,10.997(2.362)。
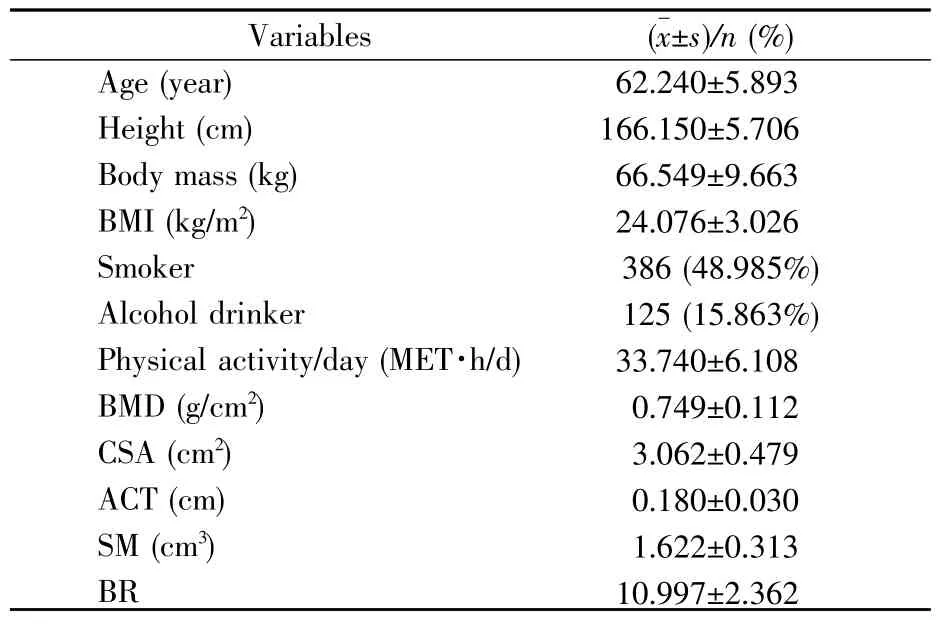
表1 研究对象的一般情况(n=788)Table1 Basic characteristics of the studied samples(n=788)
2.2 SNP位点基本情况
本研究共基因分型了两条通路中6个基因的10个SNP位点。检测结果显示788人的10个SNP位点的基因型检出率均为100%。此外,所有SNP位点在研究人群中的MAF均大于5%,并且基因型分布均符合HWE(P>0.05)。这些SNP位点的基本情况见表2。
2.3 SNP位点与骨表型关联分析
SNP位点与骨表型的关联分析结果见表3。在校正混杂因素年龄、身高、体重、吸烟、饮酒和体力活动后,RANK/RANKL/OPG信号通路中OPG基因SNP位点rs3134069的次等位基因C与BMD和ACT呈负向关联(BMD:β=-0.017,P=0.024;ACT:β=-0.004,P=0.040),RANK基因中rs3018362的次等位基因G与BR呈临界性正相关(β=0.204,P=0.070)。WNT信号通路中,携带LRP5基因中rs3736228次等位基因T的人群相对于携带C等位基因的人群具有更低的BMD(β=-0.016,P=0.009)、CSA(β=-0.050,P=0.021)、ACT(β=-0.003,P=0.024)和较高的BR(β=0.242,P=0.043)。同时,LRP5基因中rs491347的次等位基因G亦与BMD呈显著负向关联(β=-0.012,P=0.046),与CSA和ACT呈临界性负向关联(CSA:β=-0.040,P=0.053;ACT:β=-0.003,P=0.066)。本研究中,其他6个SNP位点与骨表型的关联无统计学意义(P>0.05),但其中位于OPG基因的rs2073617和SOST基因的rs1513670对BMD以及各个骨几何结构参数的影响均与已报道研究中的关联方向一致。
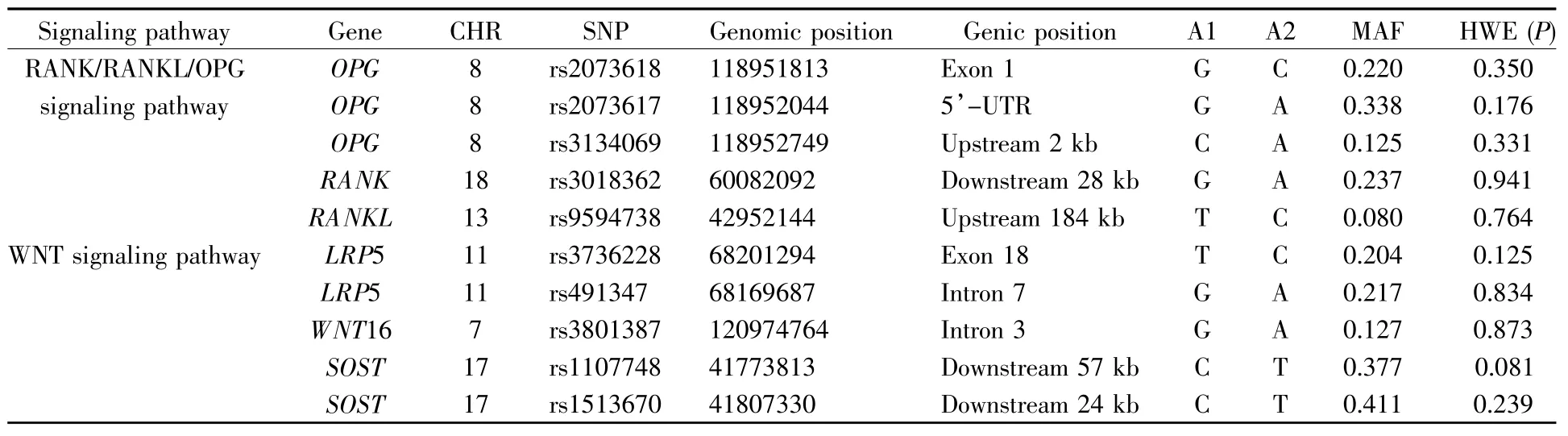
表2 SNP位点的基本情况Table2 The characteristics of genotyped SNPs
2.4 基因-基因交互作用
本研究针对两个信号通路的6个基因,以研究骨表型为基础进行了基因-基因交互作用分析,结果见表4。在调整了年龄、身高、体重、吸烟、饮酒以及体力活动的影响后,结果提示:位于RANK/RANKL/OPG信号通路中的OPG与RANK、OPG与RANKL对BMD和各骨几何结构参数具有交互作用(P<0.05);位于WNT信号通路中的LRP5与SOST、LRP5与WNT16对BMD和ACT具有交互作用(P<0.05)。不同基因间SNP的两两交互作用共进行了40次检测,采用Bonferroni法校正多重检验后,这些交互作用未显示出统计学意义(P>1.25×10-3)。此外,本研究中未检测到两条信号通路之间的基因对骨表型有显著交互作用(P>0.05)。
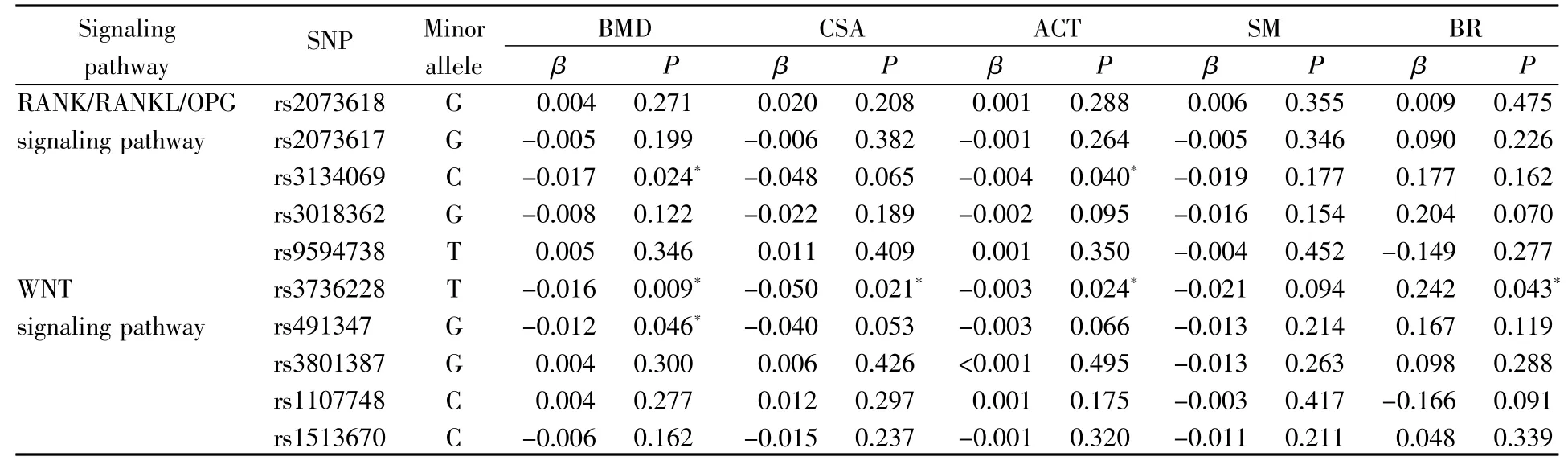
表3 SNP位点与骨表型的关联分析结果(n=788)Table3 Association results of SNPs with bone phenotypes(n=788)
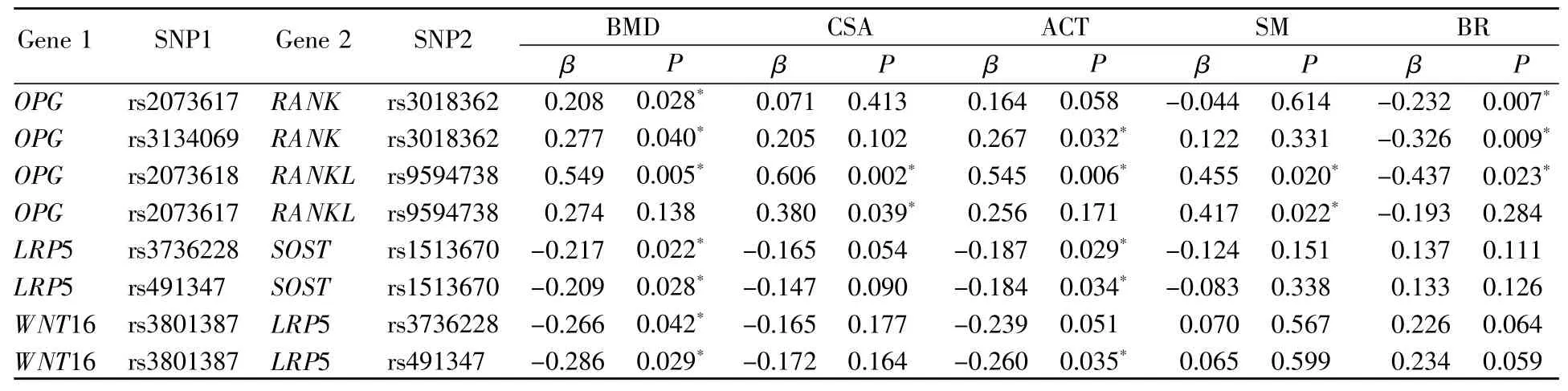
表4 基因-基因交互作用关联分析结果(n=788)Table4 Results of gene-gene interaction analysis(n=788)
3 讨论
本研究探讨了既往全基因组关联研究以及大型荟萃分析中已报道的位于RANK/RANKL/OPG和WNT信号通路中和BMD相关的6个基因与中国广州中老年男性人群髋部BMD以及骨几何结构参数的关系。研究结果显示,在校正了年龄、身高、体重、吸烟、饮酒和体力活动的混杂作用之后,RANK/RANKL/OPG信号通路中的OPG基因以及WNT信号通路中的LRP5基因的SNP位点与BMD以及骨几何结构参数呈现显著关联。
RANK/RANKL/OPG信号通路由RANK、RANKL和OPG3个基因组成。RANK基因表达在破骨细胞表面,而RANKL基因表达于成骨细胞表面,RANKL与RANK结合可以提高破骨细胞分化效率,促进骨吸收[10]。OPG与RANK结构相似,能够与RANK竞争结合RANKL,从而抑制破骨细胞的分化及活化,诱导成熟破骨细胞的凋亡,阻碍骨质吸收[11]。目前,有关OPG基因中SNP位点rs3134069的研究多以绝经后女性为研究对象,本研究中检测到该位点的次等位基因C与中国中老年男性BMD和ACT呈显著负相关,与既往绝经后女性人群的研究结果[12]相同。SNP位点rs3134069位于OPG基因启动子区域,其等位基因从A突变成C,C与其之后的G进一步形成CpG双核苷酸序列,CpG会使该区域甲基化程度增加,可能因此导致了该基因mRNA转录水平下降,从而降低了OPG蛋白的表达水平,增加了骨质疏松的易感性。OPG基因中另一个SNP位点rs2073617与BMD以及骨几何结构参数的负相关在本研究中虽未能达到统计学意义,但是其对本研究中5个骨表型的影响具有内部一致性,且与既往报道的关联方向[13]一致。本研究中位于RANK基因的rs3018362的G等位基因对BMD以及骨几何结构的作用都倾向于消极影响,该结果与既往欧洲人群荟萃分析提出的G等位基因是骨质疏松保护因素的结论[14]相悖。但是该荟萃分析纳入的人群主要是欧洲人群,而该SNP在欧洲人群和亚洲人群的基因型分布频率有较大差异,千人基因组计划中的数据显示,亚洲人群中的次等位基因G在欧洲人群中的频率高达0.636。同时,在既往中国人群中的研究显示,该SNP位点的G等位基因是骨质疏松的风险等位基因[15],结果与本研究相同。由此可见,目前有关RANK基因rs3018362位点与亚洲人群骨健康的关系值得我们进行更深入的研究。
WNT信号通路中,WNT蛋白的配体与细胞表面相应的受体结合,活化一系列复杂的生物通路,包括β-catenin依赖的经典信号途径以及非β-catenin依赖的信号途径。本研究主要针对其中的LRP5、SOST和WNT16三个基因展开分析。LRP5蛋白参与了经典WNT/β-catenin途径,作为辅助受体与WNT蛋白以及FZD蛋白家族受体结合,激活细胞内信号转导,促进β-catenin向核内转运,参与下游靶基因转录调节,促进成骨细胞前体的增殖分化,抑制成骨细胞的凋亡,从而调节骨量[16]。LRP5基因中rs3736228的次等位基因T在关联分析中与BMD、CSA、ACT的下降以及BR的上升呈现显著相关,这与既往的BMD全基因组关联研究的荟萃分析结果[7]一致。此外,LRP5基因中rs491347的G等位基因在本研究人群中观察到与BMD具有负相关,并与CSA和ACT也显示出临界性负向关联,这与Xiong等[17]在733名中国人以及1 873名白人研究对象中发现的该SNP的G等位基因与腰椎低BMD显著相关的结论一致。根据哈佛大学的Genetic Power Calculator软件计算,本研究的样本量已经具有约80%的统计功效,能够检测到约1.2%的遗传效应,然而本研究针对SOST基因与WNT16基因SNP位点进行的分析却未能检测到其与骨表型存在有统计学意义的关联,这可能是因为这些SNP位点的效应较小,本研究的样本量还不足以检测到效应较小的遗传位点。但是位于SOST基因的rs1513670位点在本研究所研究表型中都趋向于是骨强度的危险因素,与既往的全基因组关联研究所得的关联方向[18]一致。
本研究中有些基因SNP位点的检测结果与既往研究不完全相同,这可能是由于骨质疏松是一个由多因素决定的疾病。尽管我们在纳入年龄、身高、体重这些常见混杂因素的同时,还考虑到生活习惯如吸烟、饮酒以及体力活动的影响。然而,目前已有研究发现营养摄入等其他环境因素以及环境与基因之间交互作用也会影响骨骼的密度和结构[19]。因此,这些易感基因对中国人群骨质疏松的影响有待进一步探讨。
综上所述,本研究支持了OPG基因和LRP5基因与中国中老年男性人群髋部骨强度相关的结论。
参考文献(References):
[1]Cummings S R,Melton L J.Epidemiology and outcomes of osteoporotic fractures[J].The Lancet,2002,359(9319):1761-1767.
[2]LaCroix A Z,Beck T J,Cauley J A,et al.Hip structural geometry and incidence of hip fracture in postmenopausal women:what does it add to conventional bone mineral density?[J].Osteoporosis International,2010,21(6):919-929.
[3]Leslie W D,Pahlavan P S,Tsang J F,et al.Prediction of hip and other osteoporotic fractures from hip geometry in a large clinical cohort[J].Osteoporosis International,2009,20(10):1767-1774.
[4]Ozbas H,Tutgun O S,Ozdamar K.Genetic and environmental factorsinhumanosteoporosis[J].MolecularBiologyReports,2012,39(12):11289-11296.
[5]Trouvin AP,Goeb V.Receptor activator of nuclear factor-kappaB ligand and osteoprotegerin:maintaining the balance to prevent boneloss[J].Clinical Interventions in Aging,2010,5:345-354.
[6]Regard J B,Zhong Z,Williams B O,et al.Wnt signaling in bone development and disease:making stronger bone with Wnts[J].ColdSpringHarborPerspectivesinBiology,2012,4(12):a007997.
[7]Estrada K,Styrkarsdottir U,Evangelou E,et al.Genome-wide meta-analysis identifies 56 bone mineral density loci and reveals 14 loci associated with risk of fracture[J].Nature Genetics,2012,44(5):491-501.
[8]Zhang F,Tan L J,Lei S F,et al.The differences of femoral neck geometric parameters:effects of age,gender and race[J].Osteoporosis International,2010,21(7):1205-1214.
[9]Zhang Z Q,He L P,Liu Y H,et al.Association between dietary intake of flavonoid and bone mineral density in middle aged and elderly Chinese women and men[J].Osteoporosis International,2014,25(10):2417-2425.
[10]Mencej-Bedrac S,Prezelj J,Marc J.TNFRSF11Bgene polymorphisms 1181G>C and 245T>G as well as haplotype CT influence bone mineral density in postmenopausal women[J].Maturitas,2011,69(3):263-267.
[11]Wada T,Nakashima T,Hiroshi N,et al.RANKL-RANK signaling in osteoclastogenesis and bonedisease[J].Trends in Molecular Medicine,2006,12(1):17-25.
[12]Boronova I,Bernasovska J,Macekova S,et al.TNFRSF11B gene polymorphisms,bone mineral density,and fractures in Slovak postmenopausal women[J].Journal of Applied Genetics,2015,56(1):57-63.
[13]Wang C,Zhang Z,Zhang H,et al.Susceptibility genes for osteoporotic fracture in postmenopausal Chinese women[J].Journal of Bone and Mineral Research,2012,27(12):2582-2591.
[14]Kemp J P,Sayers A,Paternoster L,et al.Does bone resorption stimulate periosteal expansion?A cross-sectional analysis ofβ-C-telopeptides of typeⅠcollagen(CTX),genetic markers of the RANKL pathway,and periosteal circumference as measured by pQCT[J].Journal of Bone and Mineral Research,2014,29(4):1015-1024.
[15]Shang M,Lin L,Cui H.Association of genetic polymorphisms of RANK,RANKL and OPG with bone mineral density in Chinese peri-and post-menopausal women[J].Clinical Biochemistry,2013,46(15):1493-1501.
[16]Lerner U H,Ohlsson C.The WNT system:background and its role inbone[J].JournalofInternalMedicine,2015,277(6):630-649.
[17]Xiong D H,Lei S F,Yang F,et al.Low-density lipoprotein receptor-related protein 5(LRP5)gene polymorphisms are associated with bone mass in both Chinese and whites[J].Journal of Bone and Mineral Research,2007,22(3):385-393.
[18]Styrkarsdottir U,Halldorsson B V,Gretarsdottir S,et al.New sequence variants associated with bone mineral density[J].Nature Genetics,2009,41(1):15-17.
[19]Crabtree N,Lunt M,Holt G,et al.Hip geometry,bone mineral distribution,and bone strength in European men and women:the EPOS study[J].Bone,2000,27(1):151-159.
