脂肪源性干细胞促进大鼠神经施万细胞增殖和分泌功能
2018-05-30宋起滨王哲王宇令李杨林爽
宋起滨,王哲,王宇令,李杨,林爽
(中国医科大学附属盛京医院 1. 整形美容科; 2. 病理科,沈阳 110004)
虽然周围神经损伤后具有一定的再生潜能,但是一般情况下损伤的周围神经很难实现完全的再生[1]。周围神经损伤后,施万细胞可以快速地从成髓鞘状态向生长支持的形态转换,损伤的神经远端会有大量的施万细胞增殖,增殖的同时施万细胞会向近端迁移构成基底膜束或者形成Bungner带,一般情况下,在损伤3 d后施万细胞的增殖和转换会达到高峰。施万细胞能够分泌大量的神经营养因子、细胞因子和细胞外基质分子,刺激周围神经再生,促进轴突生长。但因施万细胞自体来源有限,作用时间较短,导致神经损伤难以完全再生[2-4]。
干细胞是组织工程与再生医学中常用的种子细胞,具有快速自我更新和多向分化的能力。其中,脂肪源性干细胞(adipose-derived stem cells,ADSCs)因具有产量高、获取过程损伤小等优势而被广泛应用。研究[5]发现促有丝分裂和分化因子可以诱导ADSCs向类似施万细胞分化,分化后的细胞能够表达胶质细胞标记物和营养因子受体。但也有研究[6-7]指出ADSCs很难分化成完全的施万细胞,其旁分泌功能对周围神经再生的作用要远大于分化功能。
本研究将大鼠神经施万细胞用ADSCs条件培养基培养或与ADSCs共培养后,发现ADSCs条件培养基及ADSCs共培养均能促进大鼠神经施万细胞的增殖及分泌功能,为周围神经再生的研究提供了新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:4周龄健康成年SD大鼠,体质量90~130 g,用于分离培养ADSCs,由我院实验动物中心提供。本实验获得我院动物伦理委员会审批。
1.1.2 主要试剂:大鼠神经施万细胞(沈阳汇佰生物有限公司);Ⅱ型胶原酶(美国Sigma公司),胎牛血清(杭州四季青生物工程有限公司),DMEM培养基(美国Hyclone公司),胰蛋白酶(美国Corning公司),四甲基偶氮唑蓝(北京汇佰生物有限公司),FITC标记的抗大鼠CD31、CD90、CD45和CD44(美国BD公司),神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)、血 管 内 皮 生 长因 子(vascular endothelial growth factor,VEGF) 和GAPDH抗体(美国Santa Cruz公司),二抗、ELISA试剂盒(北京中杉金桥生物技术有限公司),SYBR试剂盒(日本TaKaRa公司)。
1.2 方法
1.2.1 ADSCs分离培养:用Hanks液清洗SD大鼠双侧腹股沟区脂肪,剪碎脂肪,加入Ⅱ型胶原酶,37℃消化40 min。培养基终止消化后1 000 r/min离心5 min,用培养基重悬细胞,吹打均匀,置37 ℃、5%CO2培养箱中培养。此后每2~3 d换液1次,待细胞融合至90%时用胰蛋白酶消化传代。
1.2.2 细胞培养:将大鼠神经施万细胞接种于含10%灭活胎牛血清的DMEM培养基中,置37 ℃、5%CO2培养箱中培养。
1.2.3 ADSCs表面标记物鉴定:取第三代ADSCs消化离心计数后,用PBS将细胞浓度调节为5×105/mL。取500 μ L细胞悬液,分别加入FITC标记的CD31、CD90、CD45和CD44抗体(PBS作为对照),4 ℃孵育30 min,PBS洗1次,PBS重悬细胞,使用流式细胞仪检测。
1.2.4 ADSCs条件培养基获取:待第三代ADSCs在完全培养基中达到90%融合时,更换为含1%胎牛血清的DMEM培养基,继续培养48 h后收集培养液,0.22 μ L滤器过滤,获得ADSCs条件培养基。
1.2.5 ADSCs与大鼠神经施万细胞的间接培养:将大鼠神经施万细胞接种于transwell下室中,实验组在transwell上室中接种200 μ L浓度为5×105/mL的ADSCs,对照组则不添加ADSCs。
1.2.6 ELISA:按照ELISA试剂盒说明书,使用双抗体夹心法,包被上样,加抗体,底物显色,通过酶标仪分析结果。
1.2.7 MTT实验:将用ADSCs条件培养基培养的大鼠神经施万细胞以1×104/mL浓度接种于96孔培养板中,终体积200 μ L,以正常培养基培养的大鼠神经施万细胞作为对照。待细胞贴壁后,于0、12、24、36和48 h(每个浓度、每个时间点分别设3个复孔)分别加入5 mg/mL MTT溶液10 μ L,置37 ℃、5%CO2培养箱中培养4 h后,弃上清,每孔中加入200 μ L DMSO,震荡10 min,在490 nm处记录吸光值。于0、12、24、36和48 h(每个浓度、每个时间点分别设3个复孔)在与ADSCs共培养的大鼠神经施万细胞中加入5 mg/mL MTT溶液10 μ L,置37 ℃、5%CO2培养箱中培养4 h后,弃上清,每孔中加入200 μ L DMSO,震荡10 min,在490 nm处记录吸光值。
1.2.8 Western blotting:细胞培养48 h后使用RIPA裂解液搜集并裂解细胞,提取蛋白,通过G250定量后,取30 μ g蛋白进行电泳(80~120V)、转膜(100 V,1 h)后,用5%脱脂奶粉室温封闭1 h。加入一抗4 ℃过夜后,TBST清洗3次。二抗室温孵育1 h后,TBST清洗3次。ECL发光。
1.2.9 实时PCR:TRIZOL法提取培养48 h的大鼠神经施万细胞RNA,反转录成cDNA,进行实时PCR反应。NGF正向引物序列为5’-ATGTCCATGTTGTTCT AC-3’,反向引物序列为5’-CAGCCTCTTCTTGCAGC C-3’;BDNF 正向引物序列为5’-GACCATCCTTTTC CTTAC-3’,反向引物序列为5’-CTATCTTCCCCTTTT AATGG-3’;GDNF 正向引物序列为5’-GAACCAAGC CAGTGTATCTCC-3’,反向引物序列为5’-CGTCTCT GCCTTTGTCCTC-3’;VEGF正向引物序列为5’-GAT GAAGCCCTGGAGTGC-3’,反向引物序列为5’-GGT GGTGTGGTGGTGACAT-3’;GAPDH 正向引物序列为5’-GGCAAATTCAACGGCACAGT-3’,反向引物序列为5’-TAGGGCCTCTCTTGCTCAGT-3’。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,用非配对t检验比较2组数据,P < 0.05为差异有统计学意义。
2 结果
2.1 ADSCs细胞鉴定
流式分析结果显示,所提取的细胞CD31阴性(0.38%),CD45阴 性(17.53%),CD44阳 性(92.31%),CD90阳性(96.42%),证明ADSCs细胞提取培养成功。见图1。
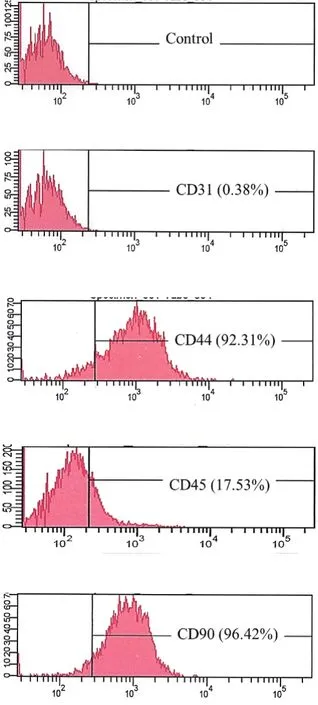
图1 ADSCs表面抗原标记物检测Fig.1 Detection of surface antigen markers on ADSCs
2.2 ADSCs条件培养基中神经营养因子的检测
通过ELISA检测发现,ADSCs条件培养基中含有大量常见的与神经再生相关的因子,其中,NGF、BDNF、GDNF、VEGF的含量分 别为(85.12±1.92)、(184.22±18.32)、(96.97±1.39)、(488.18±4.82)pg/mL,均明显高于对照组,差异有统计学意义(P <0.05)。见图2。
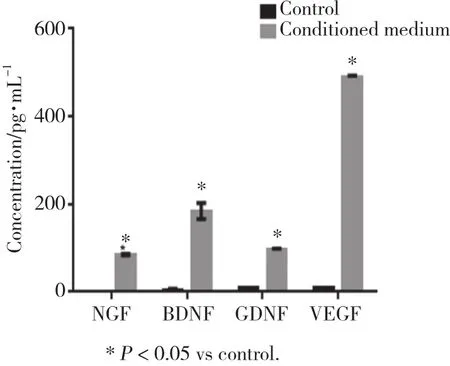
图2 不同培养基中神经营养因子的含量Fig.2 Contents of neurotrophic factors in different mediums
2.3 ADSCs条件培养基及ADSCs对大鼠神经施万细胞增殖的影响
MTT检测结果显示,ADSCs条件培养基可以明显促进大鼠神经施万细胞增殖(图3A);与ADSCs共培养也可促进大鼠神经施万细胞的增殖(图3B)。
2.4 不同浓度ADSCs对大鼠神经施万细胞中神经营养因子表达的影响
Western blotting与实时PCR结果显示,与对照组相比,使用ADSCs条件培养基培养或与ADSCs共培养的实验组大鼠神经施万细胞中NGF、BDNF、GDNF和VEGF蛋白及mRNA表达水平均增高,差异有统计学意义(均P < 0.05),提示用条件培养基培养或与ADSCs共培养大鼠神经施万细胞能够促进细胞中神经营养因子的表达,见图4、5。
3 讨论
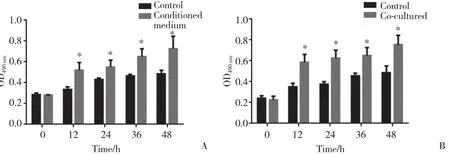
图3 ADSCs条件培养基及ADSCs共培养对大鼠神经施万细胞增殖的影响Fig.3 Effects of medium conditioned with ADSCs or co-cultured with ADSCs on the proliferation of Schwann cells
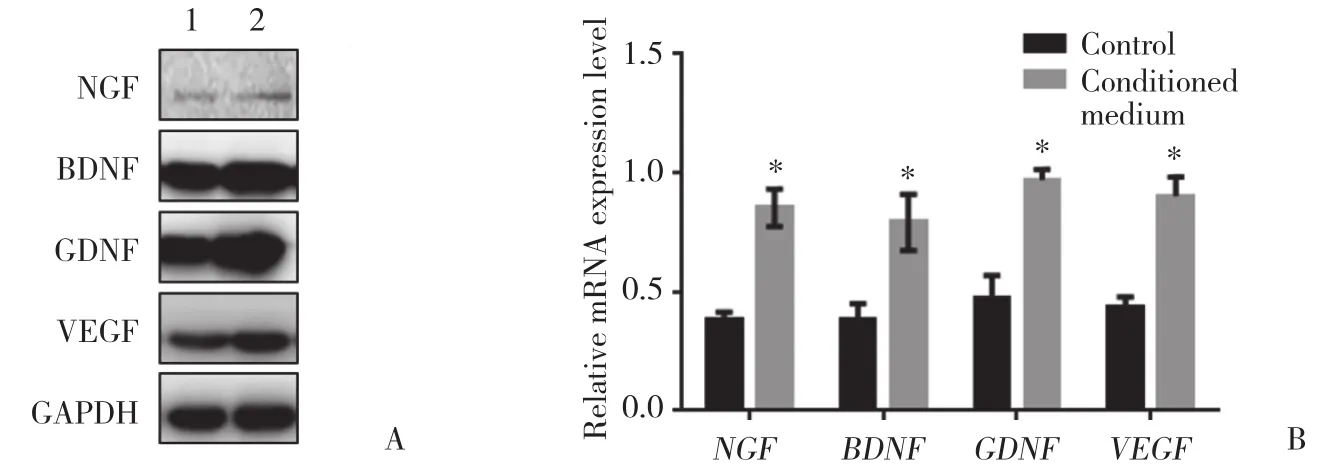
图4 ADSCs条件培养基对大鼠神经施万细胞中神经营养因子表达的影响Fig.4 Effects of medium conditioned with ADSCs on the expression of neurotrophic factor in rat Schwann cells
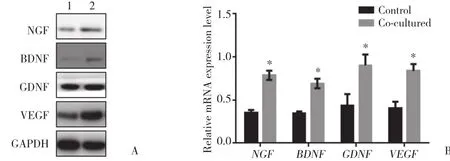
图5 ADSCs共培养对大鼠神经施万细胞中神经营养因子表达的影响Fig.5 The expression of neurotrophic factors in rat Schwann cells when co-cultured with ADSCs
干细胞能够促进周围神经的再生,但其作用机制目前尚不清楚[8]。研究[9-11]表明,骨髓间充质干细胞及ADSCs可以分化为施万细胞,进而在神经修复中发挥重要作用,但也有研究认为干细胞所分化出的施万细胞仅为类施万细胞,仅具有施万细胞的表型,并不能够在体内发挥施万细胞的生理功能。体内实验[12]证明,骨髓间充质干细胞及ADSCs移植到坐骨神经损伤处后,仅有极小部分能够分化成施万细胞,对整体的神经修复作用不大。目前,大多数研究[13]认为,在促进周围神经损伤修复中发挥重要作用的是干细胞的旁分泌作用,为了明确ADSCs在外周神经损伤修复中的作用,本研究在获取大鼠ADSCs后,分别将大鼠神经施万细胞用ADSCs条件培养基培养或与ADSCs共培养,并检测了ADSCs对大鼠神经施万细胞的影响。
很多细胞因子能够在周围神经系统中发挥重要作用。周围神经受损后NGF表达上调,可以促进信号的传递以及轴突的生长;周围神经损伤后,BDNF的表达也有一定程度的上升,BDNF可以促进周围神经髓鞘的形成;周围神经受损后,GDNF表达大量增加,促进感觉神经等的再生[14];新生血管能够为神经再生提供营养,VEGF的表达可以促进血管的再生,也可以刺激轴突的生长,促进施万细胞的增殖并抑制其凋亡[15-16]。本研究通过ELISA检测发现ADSCs条件培养基中含有大量的神经营养因子,这些成分都可以促进周围神经的再生,促进大鼠神经施万细胞的增殖。
本研究还发现,ADSCs条件培养基和ADSCs细胞共培养均可促进大鼠神经施万细胞的增殖,并促进该细胞中NGF、BDNF、GDNF和VEGF的表达。提示ADSCs不仅自身能够分泌神经营养因子,还能促进大鼠神经施万细胞增殖并分泌神经营养因子。
综上所述,ADSCs可以分泌大量有利于周围神经再生的生长因子,ADSCs及其条件培养基能促进大鼠神经施万细胞增殖并分泌神经营养因子,从而有助于周围神经的再生。
[1] XIE S,LU F,HAN J,et al. Efficient generation of functional Schwann cells from adipose-derived stem cells in defined conditions [J].Cell Cycle,2017,16(9):841-851. DOI:10.1080/15384101.2017.1304328.
[2] REICHENBERGER MA,MUELLER W,HARTMANN J,et al. ADSCs in a fibrin matrix enhance nerve regeneration after epineural suturing in a rat model [J]. Microsurgery,2016,36(6):491-500. DOI:10.1002/micr.30018.
[3] HSIEH SC,CHANG CJ,CHENG WT,et al. Effect of an epineurial-like biohybrid nerve conduit on nerve regeneration[J]. Cell Transplant,2016,25(3):559-574. DOI:10.3727/096368915X688920.
[4] JIANG L,ZHENG Y,CHEN O,et al. Nerve defect repair by differentiated adipose-derived stem cells and chondroitinase ABC-treated acellular nerves [J]. Int J Neurosci,2015,20:1-9. DOI:10.3109/0020 7454.2015.1048547.
[5] ZACK-WILLIAMS SD,BUTLER PE,KALASKAR DM. Current progress in use of adipose derived stem cells in peripheral nerve regeneration [J]. World J Stem Cells,2015,7(1):51-64. DOI:10.4252/wjsc.v7.i1.51.
[6] TSE KH,NOVIKOV LN,WIBERG M,et al. Intrinsic mechanisms underlying the neurotrophic activity of adipose derived stem cells[J]. Exp Cell Res,2015,331(1):142-151. DOI:10.1016/j.yexcr.2014.08.034.
[7] LIU Y,ZHANG Z,QIN Y,et al. A new method for Schwann-like cell differentiation of adipose derived stem cells [J]. Neurosci Lett,2013,551(13):79-83. DOI:10.1016/j.neulet.2013.07.012.
[8] RAZAVI S,MARDANI M,KAZEMI M,et al. Effect of leukemia inhibitory factor on the myelinogenic ability of Schwann-like cells induced from human adipose-derived stem cells [J]. Cell Mol Neurobiol,2013,33(2):283-289. DOI:10.1007/s10571-012-9895-2.
[9] RAZAVI S,AHMADI N,KAZEMI M,et al. Efficient transdifferentiation of human adipose-derived stem cells into Schwann-like cells:A promise for treatment of demyelinating diseases [J]. Adv Biomed Res,2012,1(11):12. DOI:10.4103/2277-9175.96067.
[10] LUO H,ZHANG Y,ZHANG Z,et al. The protection of MSCs from apoptosis in nerve regeneration by TGFβ1 through reducing inflammation and promoting VEGF-dependent angiogenesis [J].Biomaterials,2012,33(17):4277-4287. DOI:10.1016/j.biomaterials.2012.02.042.
[11] WAND Y,ZHAO Z,REN Z,et al. Recellularized nerve allografts with differentiated mesenchymal stem cells promote peripheral nerve regeneration [J]. Neurosci Lett,2012,514(1):96-101. DOI:10.1016/j.neulet.2012.02.066.
[12] SOWA Y,IMURA T,NUMAJIRI T,et al. Adipose-derived stem cells produce factors enhancing peripheral nerve regeneration:influence of age and anatomic site of origin [J]. Stem Cells Dev,2012,21(11):1852-1862. DOI:10.1089/scd.2011.0403.
[13] REID AJ,SUN M,WIBERG M,et al. Nerve repair with adipose-derived stem cells protects dorsal root ganglia neurons from apoptosis[J]. Neuroscience,2011,199(10):515-522. DOI:10.1016/j.neuroscience.2011.09.064.
[14] YANG L,FANG JS,WANG W,et al. Transplantation of Schwann cells differentiated from adipose-derived stem cells modifies reactive gliosis after contusion brain injury in rats [J]. J Int Med Res,2011,39(4):1344-1357. DOI:10.1177/147323001103900421.
[15] SUN F,ZHOU K,MI WJ,et al. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats [J].Biomaterials,2011,32(32):8118-8128. DOI:10.1016/j.biomaterials.2011.07.031.
[16] ZHANG H,YANG R,WANG Z,et al. Adipose tissue-derived stem cells secrete CXCL5 cytokine with neurotrophic effects on cavernous nerve regeneration [J]. J Sex Med,2011,8(2):437-446. DOI:10.1111/j.1743-6109.2010.02128.x.
