一氧化碳中毒后迟发性脑病患者S100β、JNK通路蛋白及相关细胞因子水平变化及其临床意义
2018-05-30张前燕朱滨冯家银黄年平
张前燕 朱滨 冯家银 黄年平
一氧化碳中毒后迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP)是指一氧化碳中毒患者经抢救在急性中毒症状恢复后数天或数周表现正常或接近正常的“假愈期”后再次出现以急性痴呆为主的一组神经精神症状[1]。目前对DEACMP的发病机制尚不明确。研究结果显示,DEACMP的发生与免疫功能紊乱有关[2]。Jun氨基末端激酶(jun amino-terminal kinase,JNK)信号转导通路是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的重要成员,是细胞外信号向细胞内转导的关键通路。研究显示,JNK信号转导通路的激活与多种脑组织疾病的发病过程相关[3]。S100β蛋白是脑组织中与脑功能和神经系统功能维系的关键蛋白,可作为脑损伤后的神经生化标识物[4]。本研究探讨了DEACMP患者脑脊液中S100β、JNK通路蛋白、白细胞介素-4(IL-4)、IL-10、转化生长因子β1(TGF-β1)及干扰素γ(IFN-γ)水平的变化及其临床意义。
1 对象和方法
1.1对象收集2010-1—2016-12作者医院收治的DEACMP患者20例(DEACMP组),其中男12例、女8例,年龄24~68岁,平均(39.9±9.8)岁,病程19~72 d,平均(38.6±14.0)d,平均假愈期(25.6±9.3)d,受教育年限5~16年,平均(11.3±3.2)年。另收集同期发生一氧化碳中毒但未发生迟发性脑病的患者37例作为对照组,其中男21例、女16例,年龄22~69岁,平均(37.5±11.3)岁,病程3~18 d,平均(5.2±2.0)d,受教育年限6~16年,平均(11.0±3.5)年。两组患者年龄、性别、受教育年限比较无统计学差异(P>0.05)。纳入标准:(1)年龄18~69岁;(2)DEACMP诊断标准参考《职业性急性一氧化碳中毒诊断标准》(GBZ23-2002);(3)具有明确的一氧化碳中毒病史,中毒时具有昏迷史;(4)DEACMP患者入院后经CT、MRI检查可发现器质性损伤病灶,脑电图检查异常;(5)资料完整;(6)患者及家属知情同意。排除标准:(1)既往具有精神疾病、认知功能障碍、痴呆等疾病;(2)既往具有脑血管病史;(3)伴有颅内占位性病变或颅脑创伤病史。
1.2方法
1.2.1血标本采集:于入院后第2天采集空腹静脉血5 mL,经离心取上清液,置于-20℃冰箱保存待测。
1.2.2S100β蛋白测定:采用酶联免疫吸附法检测S100β蛋白含量,试剂盒购自研域(上海)化学试剂有限公司,所有操作严格按照试剂盒说明书进行。使用Statfax 4200美国酶标仪检测。
1.2.3JNK通路蛋白检测:采用酶联免疫吸附法(ELISA)进行检测,JNK通路蛋白JNK1和JNK2蛋白检测试剂盒购自Hyclone公司,TNF-ɑ蛋白检测试剂盒购自武汉博士德生物工程有限公司,所有操作过程均按照试剂盒说明书进行。
1.2.4IL-4、IL-10、TGF-β1及IFN-γ检测:采用双抗体夹心ELISA法检测,试剂盒购自上海乔羽生物有限公司,所有操作严格按照试剂盒说明书进行。
1.2.5简易精神状态量表(MMSE)评分:于治疗2周后进行MMSE量表评价。MMSE评分主要包括定向力(10分)、注意力和计算力(5分)、记忆力(3分)、回忆能力(3分)、语言能力(9分),总分为30分,MMSE得分≥27分为正常。
1.3统计学处理采用SPSS16.0统计软件进行分析,符合正态分布的计量资料以均数±标准差表示,两均数间比较采用独立样本t检验,相关性分析采用Pearson线性相关分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1两组脑脊液相关蛋白及细胞因子比较DEACMP组脑脊液S100β、JNK1、JNK2、TNF-ɑ、IFN-γ水平均高于对照组(P<0.01),而IL-4、IL-10、TGF-β1水平均低于对照组(P<0.01)。结果见表1。
2.2两组患者MMSE评分比较DEACMP组MMSE评分低于对照组〔(18.64±3.15)分比(25.00±2.09)分;t=9.139,P<0.01〕。
2.3脑脊液相关蛋白及细胞因子与MMSE评分的相关性DEACMP组患者MMSE评分与脑脊液S100β、JNK1、JNK2、TNF-ɑ、IFN-γ水平呈负相关(P<0.05),与脑脊液IL-4、IL-10、TGF-β1水平呈正相关(P<0.05)。具体结果见表2。

表1 两组患者脑脊液相关蛋白及细胞因子比较(±s)
注:DEACMP:一氧化碳中毒后迟发性脑病,JNK:Jun氨基末端激酶,TNF-ɑ:肿瘤坏死因子ɑ,IL-4:白细胞介素4,TGF-β1:转化生长因子β1,IFN-γ:γ干扰素;表2同。a检测结果以与β-actin比值表示
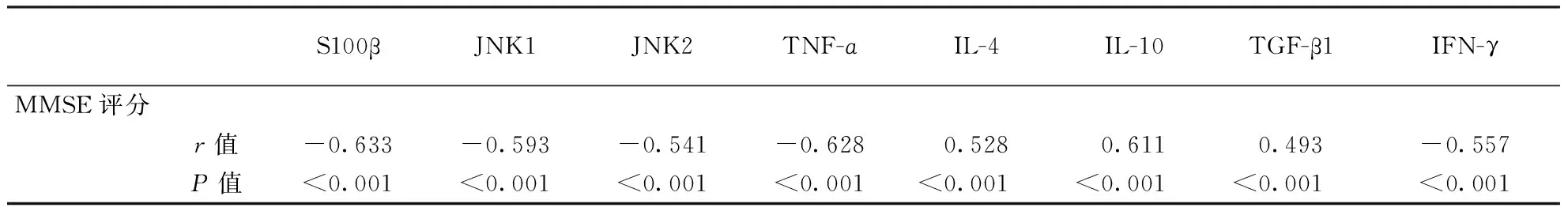
表2 DEACMP患者MMSE评分与脑脊液指标的相关性分析
注:MMSE:简易精神状态量表
3 讨论
DEACMP 是以痴呆、精神和锥体外系症状为主的脑功能障碍[5]。目前关于其确切的发病机制尚不明确。因此,探索其发病的相关分子机制对临床诊断和早期治疗具有重要价值。
S100β蛋白是一种酸性钙结合蛋白,主要存在于中枢神经系统的星形胶质细胞液中。研究显示,生理浓度的S100β蛋白具有神经营养作用,高浓度的S100β蛋白具有神经毒性,S100β蛋白的过表达将提高大脑对缺血缺氧的易感性,导致神经元的凋亡[6-7]。正常状态时,脑脊液及血浆中S100β蛋白含量极低,当中枢神经系统损伤时,S100β蛋白溢出血-脑脊液屏障进入血液循环,引起外周血其含量升高。因此,脑脊液以及血清S100β蛋白浓度变化与中枢神经系统损伤密切相关。急性一氧化碳中毒主要引起全身细胞的缺氧性损害,其中以对大脑的损害最早。有研究认为,S100β蛋白可以作为评估一氧化碳中毒后脑损伤程度的判断指标[8]。Brvar等[9]通过对动物研究发现,S100β蛋白与一氧化碳中毒预后密切相关。Liu等[10]研究显示,血清S100β蛋白水平增高是急性一氧化碳中毒患者出现迟发性神经系统后遗症的独立危险因素。Phelps-Polirer等[11]研究发现,血清s100β蛋白浓度升高是一氧化碳中毒患者早期脑损伤的重要标记。JNK信号通路是细胞外信号转导的关键通路,与多种脑疾病的发病相关,可能是药物治疗的靶点,是目前研究的热点。研究结果显示,JNK信号通路通过调控海马区神经元凋亡在帕金森病、缺血缺氧性脑病中起着重要的作用[12]。但目前关于JNK信号通路与迟发型脑病的相关性报道较少。本研究结果显示,DEACMP患者脑脊液中S100β、JNK1、JNK2、TNF-ɑ水平均显著高于对照组,其MMSE评分与脑脊液中S100β、JNK1、JNK2、TNF-ɑ水平呈负相关,表明脑脊液中S100β、JNK通路蛋白与DEACMP的发病过程密切相关,提示血清S100β蛋白、JNK1、JNK2、TNF-ɑ水平可作为判断一氧化碳中毒脑损害程度的客观指标。
近年来研究发现,在DEACMP患者的脑损伤过程中,免疫反应也起了重要作用[13-14]。IL-4作为特征性细胞因子,具有抑制细胞免疫,促进体液免疫,进而增强细胞杀伤的作用。本研究发现,DEACMP患者IL-4水平低于对照组,提示IL-4具有保护作用,表明神经免疫损伤机制有可能参与了DEACMP的发生。TGF-β1、IL-10是体内主要的抑制性细胞因子,TGF-β1在机体免疫系统中的作用以负性调节为主,即主要起抑制免疫功能的作用。本研究发现,DEACMP组患者脑脊液中TGF-β1水平显著低于对照组,而IFN-γ显著高于对照组,提示TGF-β1参与抑制DEACMP患者免疫反应的作用减弱,导致IFN-γ水平上升,从而可能引起迟发性脑病的发生[15]。IL-10可以下调促炎性反应因子的表达,可以抑制炎性反应、巨噬细胞的杀伤活性。本研究发现,DEACMP组患者脑脊液中IL-10水平低于对照组,表明DEACMP的发生与神经免疫损伤机制有关,IL-10、TGF-β1可能协同进行免疫抑制。
综上所述,DEACMP患者脑脊液中S100β、JNK 通路蛋白及相关细胞因子水平发生明显改变,且与患者恢复期认知功能损害有关,提示脑脊液中S100β、JNK通路蛋白与DEACMP的发病过程密切相关。
[1]余小骊,刘莉琼,吴豫,等.一氧化碳中毒后迟发性脑病与神经免疫的相关性研究[J]. 临床神经病学杂志,2015,28(3):185-187.
[2]唐庆,李颖,王永义,等.糖皮质激素联合高压氧防治急性一氧化碳中毒迟发性脑病疗效与安全性Meta分析[J]. 第三军医大学学报,2016,38(2):207-214.
[3]张露勇,张淼,刘师卜,等.神经酰胺通过JNK/c-Jun信号通路诱导胶质瘤细胞自噬性死亡[J]. 中国康复理论与实践,2015,21(8):905-912.
[4]Silva FP,Schmidt AP,Valentin LS,et al.S100B protein and neuron-specific enolase as predictors of cognitive dysfunction after coronary artery bypass graft surgery.[J]. Eur J Anaesthesiol,2016,33(9):1.
[5]宋健楠,孙义,张析哲,等.大鼠脑缺血/再灌注后血清S100β蛋白对脑损伤的诊断价值[J]. 实用医技杂志,2016,23(3):238-240.
[6]王晶,殷亮,吕涌涛,等.S100B在癫痫患者脑脊液和血清中的表达[J]. 实用医学杂志,2016,32(20):3422-3424.
[7]Yardan T,Cevik Y,Donderici O,et al.Elevated serum S100B protein and neuron-specific enolase levels in carbon monoxide poisoning[J]. Am J Emerg Med,2009,27(7):838-842.
[8]Akelma AZ,Celik A,Ozdemir O,et al.Neuron-specific enolase and S100B protein in children with carbon monoxide poisoning: children are not just small adults[J]. Am J Emerg Med,2013,31(10):1531.
[9]Brvar M,Mozina H,Osredkar J,et al.S100B protein in carbon monoxide poisoning: a pilot study[J]. Resuscitation,2004,61(3):357-360.
[10]Liu H,Zhang Y,Ren YB,et al.Serum S100B level may be correlated with carbon monoxide poisoning[J]. Int Immunopharmacol,2015,27(1):69-75.
[11]Phelps-Polirer K,Abt MA,Smith D,et al.Co-Targeting of JNK and HUNK in resistant HER2-positive breast cancer[J]. PLos One,2016,11(4):e0153025.
[12]朱雯,王雪蕊,杨静雯,等.针刺对血管性痴呆模型大鼠大脑皮质神经元凋亡及p-JNK表达的影响[J]. 中医杂志,2017,58(11):956-959.
[13]刘苏,孙李颖,吴勤峰,等.趋化因子CCL2在重度颅脑损伤患者中的表达[J]. 重庆医学,2016,45(24):3406-3408.
[14]周志天,陆明岳.一氧化碳中毒后迟发性脑病患者血清中白细胞介素4、白细胞介素10、干扰素γ、转换生长因子β1的水平变化及意义[J]. 中国基层医药,2015,22(13):2028-2030.
[15]林泽辉,李彦军,杜永明,等.急性一氧化碳中毒迟发型脑病IL-10、MDA及IFN-γ水平变化的意义[J]. 中西医结合心脑血管病杂志,2016,14(17):2063-2065.
