中国汉族人群CXCR5单核苷酸多态性与NMOSD的相关性
2018-05-30谢璟璐连志云刘举陈虹西张勤石紫燕姚绍莉周红雨
谢璟璐 连志云 刘举 陈虹西 张勤 石紫燕 姚绍莉 周红雨
视神经脊髓炎(neuromyelitis optica,NMO)是一种累及中枢神经系统的炎性脱髓鞘疾病,其主要临床特征表现为视神经炎和长节段横贯性脊髓炎。国际上将视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)定义为包含典型的NMO、视神经炎、急性脊髓炎、大脑综合征及其组合在内的整个谱系疾病[1]。随着水通道蛋白4(AQP4)的发现,又将NMOSD分为血清AQP4-IgG阳性的NMOSD和血清AQP4-IgG阴性的NMOSD(或未知的)[2]。目前研究普遍认为NMOSD的发病机制与AQP4-IgG介导的自身免疫反应有明显的相关性[3-4],但其确切病因和发病机制仍不完全清楚。既往研究发现遗传和环境因素均与NMOSD的发病有关[5-7]。Lill等一项研究表明,趋化因子受体5(CXCR5)基因或其临位的常见基因变异与MS发病相关[8]。作者假设CXCR5的单核苷酸多态性(single nucleotide polymorphisms,SNPs)也可能与NMOSD的发病机制有关,目前尚未检索到有相关研究证实该假设。因此,本研究对CXCR5基因SNPs与NMOSD的关系进行了探讨。
1 对象和方法
1.1对象收集2014-09—2017-04作者医院就诊的NMOSD患者312例,其中女271例,男41例,平均年龄(41.97±12.25)岁。诊断均符合2015年美国神经病学会发表的NMOSD诊断标准。另收集同期的健康对照人群(HCs)487例,其中女407例,男80例,平均(40.67±11.56)岁。两组间年龄、性别构成相匹配(P>0.05)。本研究经四川大学华西医院医学伦理委员会批准,所有患者及家属签署知情同意书。
1.2方法
1.2.1资料收集:收集受试者性别、年龄、发病年龄、病程、年复发率、扩大残疾状态评分(EDSS)量表、AQP4-IgG、临床表型和初始症状等资料。
1.2.2SNP的选择和单倍型分析:中国汉族人群CXCR5基因SNPs位点的选择来源于1000基因组计划(1KGP)数据库。标签SNPs由Haploview软件4.2版本根据以下条件进行选择:次要等位基因频率(MAF)>0.05,哈迪-温伯格平衡(HWE)P值>0.05,连锁不平衡(LD)r2>0.8。最终选择9个标签SNPs,分别为:rs11574667、rs523604、rs118182497、rs1623316、rs78146216、rs497916、rs598207、rs676925、rs581063(包含上游2 k和下游1 k)。另外1个SNPs rs10892301来源于系统性红斑狼疮(SLE)的研究[9]。因此该研究包含了10个CXCR5基因的SNPs位点(表1)。
1.2.3SNP检测:采用乙二胺四乙酸管采集所有受试者外周静脉血标本3~5 mL。基因组DNA由AxyPrep血基因组DNA中量制备试剂盒25-prep(AxyGen,中国)提取,置-20℃储存待测。9个标签SNPs由基于双连锁和多重荧光聚合酶链反应技术的SNP基因分型专利技术自主研发的48位SNPscan试剂盒(Cat#:G0104,上海天昊生物科技有限公司)进行基因分型,而另一个SNPs(rs10892301)由改进的多重连接酶检测应答技术(天昊生物科技有限公司)进行基因分型。随后,从总的DNA样本中随机抽取出5%(n=35)用Big Dye-terminator 3.1版本和ABI3730XL自动测序仪(美国应用生物系统公司)再次测试以确认结果,所得结果一致。
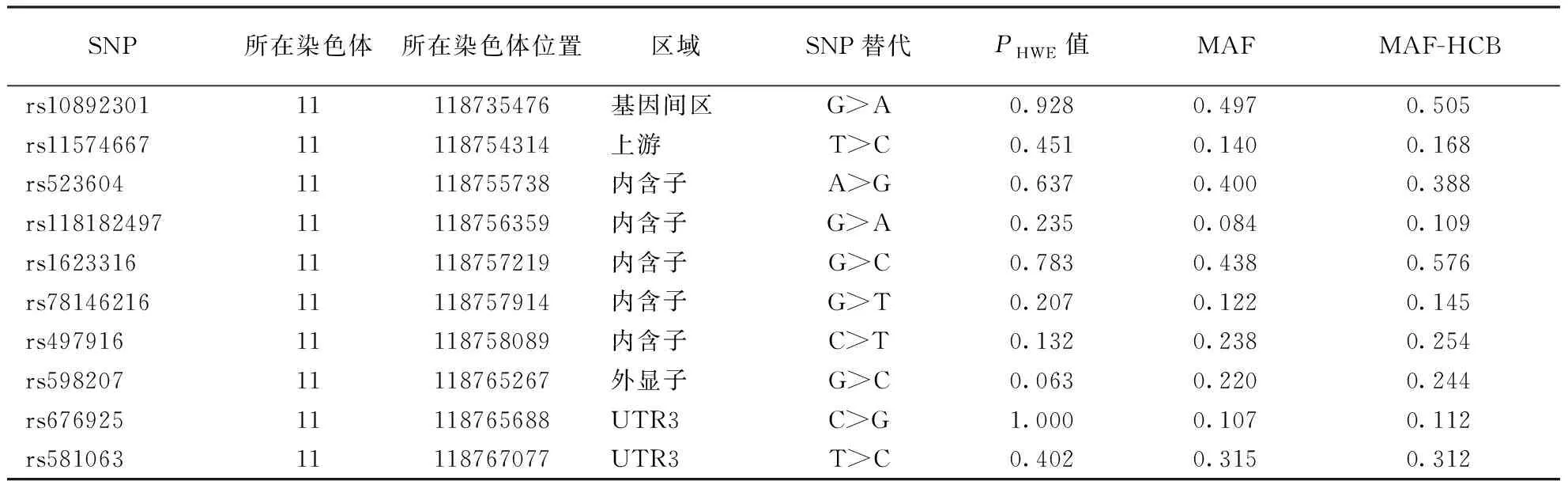
表1 CXCR5基因SNPs位点
注:CXCR5:趋化因子受体5,SNPs:单核苷酸多态性;表2~3、图1同。PHWE值:哈迪-温伯格平衡检验P值;MAF:次要等位基因频率;HCB:中国北京汉族人群
1.3统计学处理使用PLINK v1.07和SPSS 21.0统计软件进行统计学分析,两组性别差异和哈迪-温伯格平衡采用卡方检验;计量资料以均数±标准差表示,采用t检验;计数资料采用卡方检验;采用校正年龄和性别的Logistic回归分析法对加性、显性和隐性模型进行分析,计算优势比(odds ratio,OR)和95%可信区间(95%CI)来评估NMOSD的发病风险。通过Haploview软件4.2版本进行连锁不平衡和单倍型分析。P值由功耗和样本量计算软件3.1.2版本(Power and Sample Size Calculation)计算,以P<0.05为差异有统计学意义。
2 结果
2.1NMOSD患者临床特征NMOSD患者发病平均年龄(37.48±13.27)岁,病程中位数4.42年,四分位数间距5.76年,扩展残疾状态量表(EDSS)评分(2.7±2.3)分。年复发率(0.64±0.56)次。AQP4-IgG阳性238例(81.2%,共293例患者进行了抗体检查)。临床表型:仅表现为横贯性脊髓炎97例(31.1%),仅表现为视神经炎22例(7.1%),横贯性脊髓炎+视神经炎188例(60.2%),其他5例(1.6%)。发病初始症状:视神经炎87例(27.9%),横贯性脊髓炎160例(51.3%),横贯性脊髓炎+视神经炎34例(10.9%),脑干综合征17例(5.4%),极后区综合征12例(3.8%),症状性脑综合征2例(0.7%)。
2.2等位基因与基因型比较NMOSD患者与健康对照组CXCR5基因SNPs位点的等位基因与基因型频率见表2。等位基因关联分析显示rs11574667的次等位基因C与NMOSD易感性相关(OR=1.33,95%CI:1.01~1.75,P=0.03),但加性、显性及隐性模型中10个SNPs均与NMOSD易感性无关(P>0.05)。
2.3连锁不平衡与单倍型分析连锁不平衡结果见图1。其中确定了2个连锁不平衡模块,分别为rs1574667-rs523604-rs118182497(模块1)与rs598207-rs676925(模块2)。在模块1中确定了C-G-A、C-G-G、T-A-G和T-G-G 4个单倍型(频率>5%),模块2中确定了C-C、C-G和G-C 3个单倍型(频率>5%)。结果显示模块1中单倍型C-G-G与NMOSD易感性相关(OR=1.50,95%CI:1.00~2.23,P=0.046),模块2中3个单倍型均未显示出与NMOSD发病相关(P>0.05)。结果见表3。
3 讨论
NMO曾一度被认为是多发性硬化(multiple sclerosis,MS)的一种亚型,直到AQP4-IgG的发现,人们认识到NMO是一种独立于MS的疾病,大部分NMO患者AQP4-IgG阳性,而MS患者则为阴性[10-11]。研究证实CXCR5或其临位常见基因的变异与MS的发病相关[8]。亦有研究表明CYP7A1启动子多态性、CD58基因多态性和STAT4多态性均与NMOSD的发病风险相关[12-14]。目前尚未检索到CXCR5基因与NMOSD相关性研究的报道。本研究对中国汉族人群中CXCR5基因多态性与NMOSD发病风险的相关性进行了探讨。
NMOSD是一种自身免疫介导的中枢神经系统炎性脱髓鞘疾病,其核心的发病机制是自身免疫介导的组织损伤。有国外研究指出抗原特异性B细胞及T细胞发生免疫应答的基本结构是淋巴滤泡,其主要存在于次级淋巴组织或器官中,亦存在于自身免疫介导的慢性炎症组织或器官内[15]。滤泡辅助性T细胞(TFH)和TFH相关分子可能参与了自身免疫性疾病的发病过程,CXCR5在TFH表面表达,并在其特异性受体选择性B细胞趋化因子CXCL13的作用下迁移至B细胞,作用于B细胞生发中心,发挥体液免疫作用,对TFH和B细胞的激活、分化及存活都至关重要[16-17]。有研究发现血液中CXCR5+辅助性T细胞17(Th17)可能参与了抗体相关的免疫应答[18]。因此,作为TFH的标志物,CXCR5与自身抗体及自身免疫性疾病的相关产物有密切关系[9,19],多项研究已经在MS、NMOSD、重症肌无力(myasthenia gravis,MG)以及其他一些自身免疫性疾病(如自身免疫性甲状腺疾病、原发性干燥综合征)的发病机制中证实了这一点[8,15-16]。在疾病的炎性反应过程中,外周活化的B细胞表达迟缓抗原-4(VLA-4),并转移至中枢神经系统;另外,CXCL13通过结合B细胞上的CXCR5,也将B细胞转移至中枢神经系统,故NMO患者脑脊液中B细胞活化因子受体明显升高[20]。
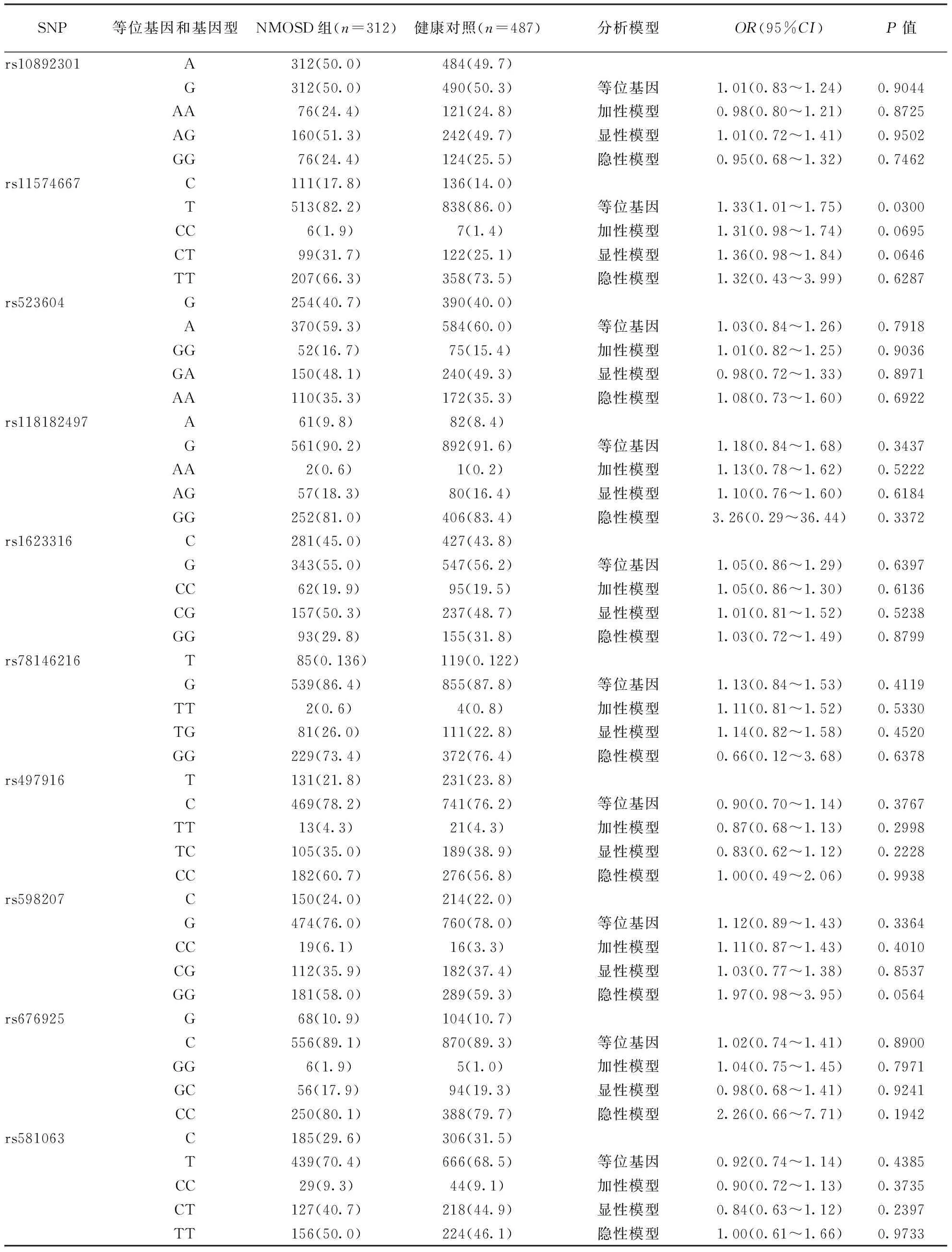
表2 NMOSD患者和健康对照组CXCR5 SNPs等位基因和基因型频率
注:NMOSD:视神经脊髓炎谱系疾病,表3同;加性模型:aavs. Aavs.AA,显性模型:aa+Aavs. AA,隐性模型:aavs.Aa+AA,其中a表示次要等位基因,A表示主要等位基因
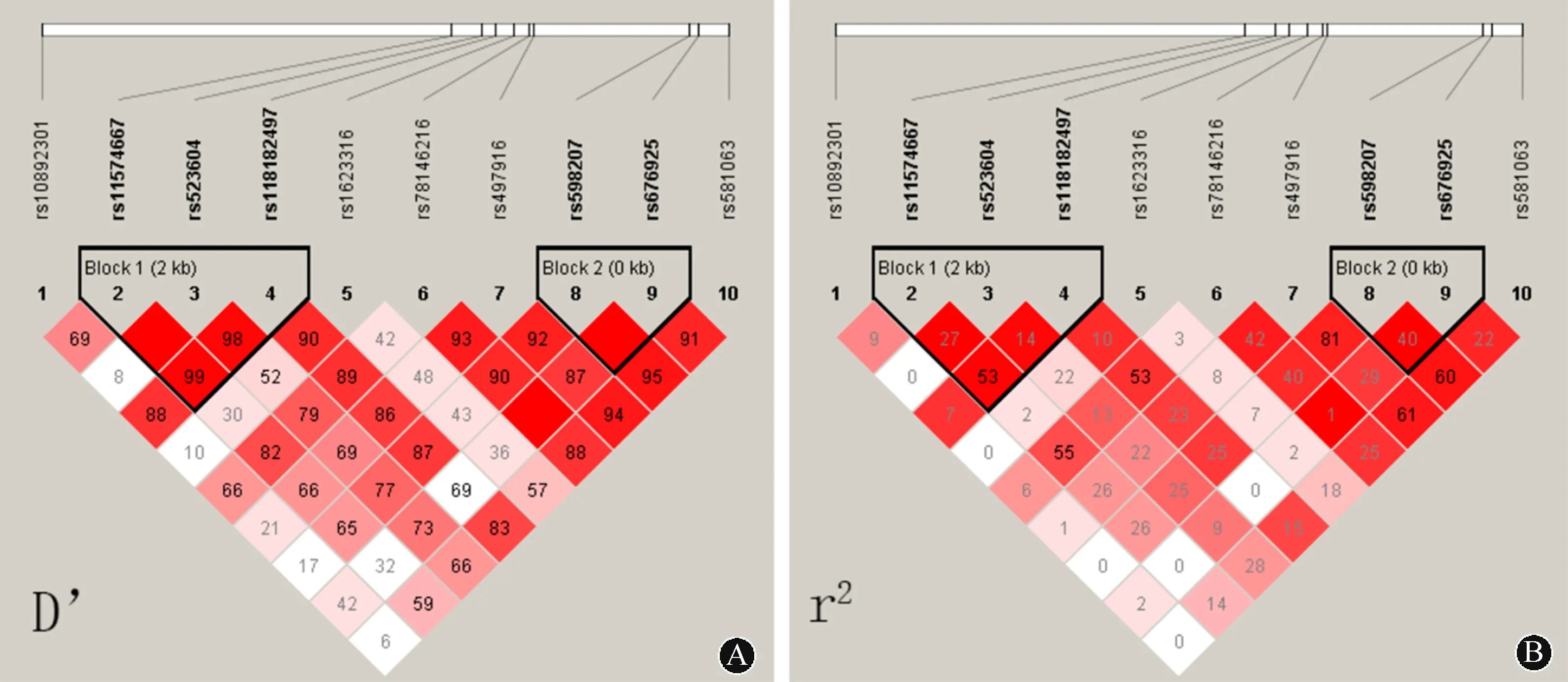
图 1 CXCR5 SNPs的连锁不平衡的D’值(A)和r2(B)
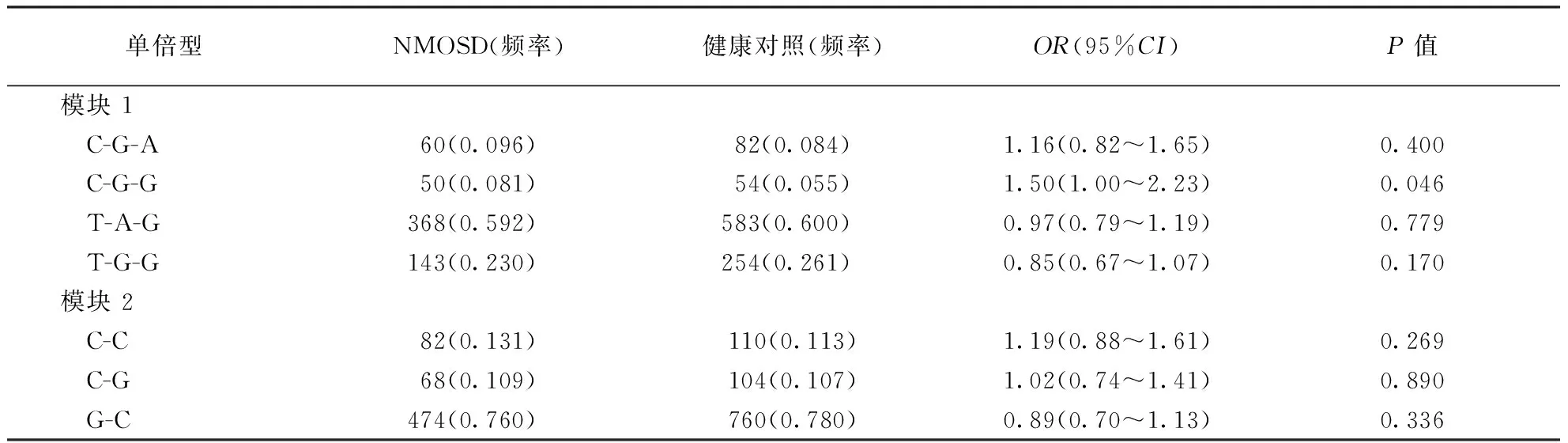
单倍型NMOSD(频率)健康对照(频率)OR(95%CI)P值模块 1C-G-A60(0.096)82(0.084)1.16(0.82^1.65)0.400C-G-G50(0.081)54(0.055)1.50(1.00^2.23)0.046T-A-G368(0.592)583(0.600)0.97(0.79^1.19)0.779T-G-G143(0.230)254(0.261)0.85(0.67^1.07)0.170模块 2C-C82(0.131)110(0.113)1.19(0.88^1.61)0.269C-G68(0.109)104(0.107)1.02(0.74^1.41)0.890G-C474(0.760)760(0.780)0.89(0.70^1.13)0.336
注:模块1:rs1574667-rs523604-rs118182497;模块2:rs598207-rs676925
CXCR5基因编码了趋化因子受体家族的多通道膜蛋白[9]。研究证实CXCR5 SNPs可改变B细胞的活性,从而增加患干燥综合征和SLE的风险[21]。CXCR5 SNPs还可能改变核因子活化B细胞κ轻链增强子(NFKB)的结合,影响CXCR5基因的转录,进一步增加MS的发病风险[8]。作者推测,CXCR5 SNPs的这些影响也可能存在于NMOSD患者中。迄今为止,尚未检索到CXCR5 SNPs与NMOSD发病风险关系的研究。本研究结果显示,rs11574667的次等位基因C与NMOSD易感性相关,单倍型C-G-G也体现出相似的结果,初步证实CXCR5 SNPs在自身免疫介导的中枢神经系统疾病中的作用。然而,本研究存在以下不足:(1)由于NMOSD患者分为血清AQP4-IgG阳性和血清AQP4-IgG阴性(或未知的),CXCR5 SNPs是否与AQP4-IgG的表达有关还需进一步研究。(2)CXCR5 SNPs与NMOSD临床表型有无相关性尚需进一步研究。(3)本研究限于中国汉族人群,但NMOSD的发病具有种族差异。流行病学研究发现在亚洲和其他非白种人的发病率较高[22]。(4)NMOSD的发病受遗传因素和环境因素相互作用,所以环境因素对其影响也有待进一步扩大样本研究。这对NMOSD发病机制的研究具有重要意义。
综上所述,本研究结果提示中国汉族人群中CXCR5 SNP rs11574667的次等位基因C及rs1574667-rs523604-rs118182497的单倍型C-G-G与NMOSD易感性相关,这可能对NMOSD发病机制的研究提供了新的思路,但有关两者间确切关系尚需进一步研究。
[1]Wingerchuk DM,Banwell B,Bennett JL,et al.International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology,2015,85(2):177-189.
[2]Akaishi T,Nakashima I,Sato DK,et al.Neuromyelitis optica spectrum disorders[J]. Neuroimag Clin N Am,2017,27(2):251-265.
[3]Jarius S,Wildemann B.AQP4 antibodies in neuromyelitis optica: diagnostic and pathogenetic relevance[J]. Nat Rev Neurol,2010,6(7):383-392.
[4]Ratelade J,Verkman AS.Neuromyelitis optica: aquaporin-4 based pathogenesis mechanisms and new therapies[J]. Int J Biochem Cell Biol,2012,44(9):1519-1530.
[5]Lan W,Fang S,Zhang H,et al.The Fc receptor-like 3 polymorphisms(rs7528684,rs945635,rs3761959 and rs2282284) and the risk of neuromyelitis optica in a Chinese population[J]. Medicine(Baltimore),2015,94(38):e1320.
[6]Asgari N,Nielsen C,Stenager E,et al.HLA,PTPN22 and PD-1 associations as markers of autoimmunity in neuromyelitis optica[J]. Mult Scler,2012,18(1):23-30.
[7]Yoshimine S,Sakai T,Ogasawara M,et al.Anti-aquaporin-4 antibody-positive familial neuromyelitis optica in mother and daughter[J]. Jpn J Ophthalmol,2011,55(6):647-650.
[8]Lill CM,Schjeide BM,Graetz C,et al.MANBA,CXCR5,SOX8,RPS6KB1 and ZBTB46 are genetic risk loci for multiple sclerosis[J]. Brain,2013,136(6):1778-1782.
[9]Zhang J,Zhang Y,Yang J,et al.Three SNPs in chromosome 11q23.3 are independently associated with systemic lupus erythematosus in Asians[J]. Hum Mol Genet,2014,23(2):524-533.
[10]Lennon VA,Wingerchuk DM,Kryzer TJ,et al.A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis[J]. Lancet,2004,364(9451):2106-2112.
[11]Verkman AS,Phuan PW,Asavapanumas N,et al.Biology of AQP4 and anti-AQP4 antibody: therapeutic implications for NMO[J]. Brain Pathol,2013,23(6):684-695.
[12]Kim HJ,Park HY,Kim E,et al.Common CYP7A1 promoter polymorphism associated with risk of neuromyelitis optica[J]. Neurobiol Dis,2010,37(2):349-355.
[13]Liu J,Shi Z,Lian Z,et al.Association of CD58 gene polymorphisms with NMO spectrum disorders in a Han Chinese population[J]. J Neuroimmunol,2017,309:23-30.
[14]Shi Z,Zhang Q,Chen H,et al.STAT4 polymorphisms are associated with neuromyelitis optica spectrum disorders[J]. Neuromolecular Med,2017,19(4):493-500.
[15]Aust G,Sittig D,Becherer L,et al.The role of CXCR5 and its ligand CXCL13 in the compartmentalization of lymphocytes in thyroids affected by autoimmune thyroid diseases[J]. Eur J Endocrinol,2004,150(2):225-234.
[16]Fan X,Lin C,Han J,et al.Follicular helper CD4+T cells in human neuroautoimmune diseases and their animal models[J]. Mediators Inflamm,2015,2015(12):1-11.
[17]Charbonneau B,Wang AH,Maurer MJ,et al.CXCR5 polymorphisms in non-Hodgkin lymphoma risk and prognosis[J]. Cancer Immunol Immunother,2013,62(9):1475-1484.
[18]Li XY,Wu ZB,Ding J,et al.Role of the frequency of blood CD4(+) CXCR5(+) CCR6(+) T cells in autoimmunity in patients with Sjogren’s syndrome[J]. Biochem Biophys Res Commun,2012,422(2):238-244.
[19]Moser B.CXCR5,the defining marker for follicular B helper T(TFH) cells[J]. Front Immunol,2015,6:296.
[20]Quan C,Yu H,Qiao J,et al.Impaired regulatory function and enhanced intrathecal activation of B cells in neuromyelitis optica: distinct from multiple sclerosis[J]. Mult Scler,2013,19(3):289-298.
[21]Burbelo PD,Ambatipudi K,Alevizos I.Genome-wide association studies in Sjogren’s syndrome: What do the genes tell us about disease pathogenesis?[J]. Autoimmu Rev,2014,13(7):756-761.
[22]Pandit L,Asgari N,Apiwattanakul M,et al.Demographic and clinical features of neuromyelitis optica: A review[J]. Mult Scler,2015,21(7):845-853.
