合并胸腺异常重症肌无力患者的临床特征分析
2018-05-30王淑辉尚延昌李尧姜彬赵媛张丽燕谢琰臣
王淑辉 尚延昌 李尧 姜彬 赵媛 张丽燕 谢琰臣
重症肌无力(myasthenia gravis,MG)是一种主要由乙酰胆碱受体(acetylcholine receptor,AChR)抗体介导的神经-肌肉接头间传递功能障碍所引起的慢性自身免疫性疾病[1],可发生于任何年龄,主要表现为骨骼肌无力,易疲劳,具有晨轻暮重等特点[2]。MG的确切发病机制目前尚未完全阐明[3]。大量证据表明,MG的发病与胸腺密切相关[4],推测异常胸腺组织中的胸腺细胞可能由于不成熟而失去了正常胸腺细胞所具有的自体耐受功能,从而导致免疫紊乱引起MG的发病[5]。研究表明部分MG患者合并胸腺增生或胸腺瘤等异常情况[6],胸腺瘤患者亦可合并MG等自身免疫性疾病[7],提示两者之间存在密切联系。目前国内对于合并胸腺异常MG患者临床特征的研究较少。本研究通过回顾性分析中国北方汉族人群合并胸腺异常MG患者的临床特点,以更好地指导临床诊疗工作。
1 对象和方法
1.1研究对象回顾性收集2008-06—2013-06北京友谊医院住院及门诊随诊的有胸腺增强CT结果且临床病历记录完备的MG患者共91例,其中有胸腺增强CT结果记录并且临床病历记录完备的病例共91例,均随访2年以上。MG诊断标准参考中国重症肌无力诊断和治疗指南[8]:(1)诊断必要条件:1)骨骼肌无力,有典型的活动后加重,休息后减轻,或“晨轻暮重”现象;2)疲劳试验阳性;3)新斯的明试验阳性或胆碱酯酶抑制剂治疗有效。(2)诊断支持条件:1)血清AChR抗体阳性;2)肌电图检查结果表明低频重复电刺激波幅递减,无高频波幅递增和/或单纤维肌电图显示颤抖增宽。胸部增强CT检查判断是否存在胸腺增生或胸腺瘤,并将MG患者分为胸腺增生组、胸腺瘤组及胸腺正常组。
1.2方法收集患者的姓名、性别、年龄、发病时间、发病时症状表现、发病时Osserman分型、是否存在MG进展、进展后最重临床表现及Osserman分型、伴发其他疾病情况等。按照中国重症肌无力治疗专家共识和指南建议[8-9],所有病例均给予溴吡斯的明对症治疗,根据不同情况部分病例接受糖皮质激素、硫唑嘌呤、环磷酰胺、他克莫司等免疫抑制治疗以及大剂量免疫球蛋白、血浆置换等治疗,部分病例行胸腺切除术及术后辅助放化疗。出现肌无力危象患者给予气道支持及对症治疗。
1.3统计学处理应用SPSS(V22)进行统计学分析,计量资料以均数±标准差表示,多组均数比较应用单因素方差分析;计数资料以率表示,采用χ2检验或Fisher精确概率法,两两比较采用卡方分割方法,并采用Bonferroni法校正P值;有序分类变量采用Kruskal-Wallis H检验。以P<0.05表示差异有统计学意义。
2 结果
2.1一般临床特征合并胸腺增生者16例(17.6%),胸腺瘤者20例(22.0%),胸腺正常者55例,其中18例经手术后病理确诊。3组间平均年龄、性别构成、发病类型、病情进展比较无统计学差异(均P>0.05),而在合并免疫性疾病方面存在统计学差异(χ2=22.841,P<0.05)。结果见表1。
2.2首发症状及临床分型3组患者以眼部症状和球部症状发病者所占比例间比较无统计学差异,而以肢体无力症状起病者在胸腺增生组和胸腺瘤组所占比例较胸腺正常组升高(P=0.026)。3组间入院时Osserman分型分布比较存在统计学差异(H=6.049,P<0.05),胸腺增生组Ⅱa型、Ⅱb型以及胸腺瘤组Ⅱb型和Ⅲ型分布比例均高于胸腺正常组。结果见表2、表3。

表1 各组MG患者一般临床特征比较
注:MG:重症肌无力,表2~5同;a与胸腺正常组比,Bonferroni法校正P值<0.0167;b与胸腺增生组比,Bonferroni法校正P值<0.0167
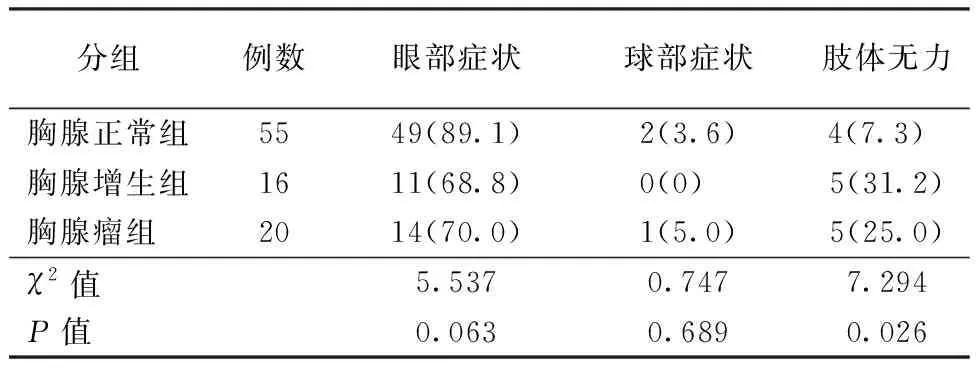
表2 各组MG患者首发症状构成比较〔n(%)〕

表3 各组MG患者入院时Osserman分型分布情况比较〔n(%)〕
注:与胸腺正常组比较,aP<0.01
2.3病情最重时症状及临床分型随访2年期间,胸腺增生组和胸腺瘤组分别有6例(37.5%)和10例(50.0%)患者出现受累肌肉范围进一步扩大,均高于胸腺正常组的15例(27.3%),但差异无统计学意义(χ2=3.475,P>0.05)。病情最重时Osserman分型比例在3组间存在统计学差异(H=16.85,P<0.01),且胸腺增生组和胸腺瘤组Ⅱb型、Ⅲ型所占比例均高于胸腺正常组(P<0.01)。结果见表4。
2.4伴发疾病胸腺增生组合并自身免疫性疾病比例最高(10例,62.5%),包括自身免疫性甲状腺疾病9例,关节炎2例,过敏性哮喘1例,过敏体质2例。胸腺瘤组合并自身免疫性疾病患者4例(20.0%),而在胸腺正常组该比例为52.7%,胸腺瘤组合并免疫性疾病比例低于胸腺正常组和胸腺增生组(Bonferroni校正P值<0.0167)。
2.5治疗方案选择(1)药物治疗:所有MG患者均给予抗胆碱酯酶抑制剂治疗,3组患者抗胆碱酯酶抑制剂联合激素比例间比较存在统计学差异(P<0.01),胸腺增生组和胸腺瘤组联合激素+免疫抑制剂(包括硫唑嘌呤、环磷酰胺、环孢素、他克莫司等)治疗比例均高于胸腺正常组,但差异无统计学意义(P>0.05)。由于存在激素应用禁忌证而采用抗胆碱酯酶抑制剂+免疫抑制剂者比例在3组间比较差异无统计学意义(P>0.05)。(2)手术治疗:胸腺增生组手术治疗2例(12.5%),术后病理证实均为胸腺组织增生;胸腺瘤组16例(80%),术后病理证实为胸腺瘤A型1例,AB型2例,B1型2例,B2型2例,B2/B3混合型3例,B3型2例,另4例患者于外院手术,具体病理类型不详。结果见表5。
3 讨论
本研究结果显示,成人MG患者合并胸腺增生占17.6%,合并胸腺瘤占22.0%,以肢体无力为首发症状者在胸腺增生组和胸腺瘤组所占比例高于胸腺正常组;入院时Osserman分型和最重时Osserman各分型所占比例在3组间存在统计学差异;随访期间,胸腺增生组和胸腺瘤组分别有37.5%和50.0%患者出现受累肌肉范围进一步扩大;胸腺增生组和胸腺瘤组治疗药物方案的选择与胸腺正常组存在不同。上述临床特征提示合并胸腺异常MG患者具有自身的临床特点。
正常生理状态下,胸腺的主要功能是参与T细胞的分化和建立自身免疫耐受。在胸腺皮质部未成熟的CD4+/8+T细胞通过T细胞受体与胸腺上皮细胞表达的主要组织相容性抗议复合物分子相互作用,通过阳性选择和阴性选择,使分化的T细胞产生免疫耐受能力[10]。部分MG患者合并胸腺结构和功能异常,包括胸腺滤泡增生以及胸腺瘤等。胸腺瘤引起MG的可能机制为胸腺瘤导致T细胞在胸腺髓质内的阴性选择障碍,从而产生会对自身肌样细胞抗原发生免疫反应的T细胞,这些T细胞被释放到外周血,从而对自身肌肉细胞抗原产生免疫反应[11]。其主要病理特点为胸腺内出现生发中心和新生血管的活跃增生,这些生发中心由大量B细胞聚集形成,而新生的高内皮静脉和淋巴内皮血管则是B细胞进入胸腺的通道,许多趋化因子参与了这一过程[12]。本研究结果显示,近40%的MG患者合并胸腺异常,且合并胸腺增生MG患者合并其他自身免疫性疾病的比例高达62.5%。

表4 各组MG患者症状最重时Osserman分型分布情况〔n(%)〕
注:与胸腺正常组比较,aP<0.01

表5 各组MG患者药物治疗情况〔n(%)〕
既往研究表明合并胸腺异常MG患者临床特征与胸腺正常者MG存在不同。Li等[13]研究结果显示合并胸腺瘤MG患者发生肌无力危象和球部症状的比例显著增高。Wu等[14]研究表明,合并胸腺瘤MG患者胸腺切除术后发生肌无力危象的比例显著高于无胸腺瘤MG患者。合并侵袭性胸腺瘤的MG患者预后较差,肌无力症状较难控制,合并其他免疫疾病的风险较大[7,15]。本研究结果亦显示,合并胸腺异常者病情进展比例也较胸腺正常组高,病情最重时合并胸腺异常MG患者Osserman分型的Ⅱb和Ⅲ型比例也高于单纯MG组,提示是否合并胸腺异常对于MG的进展和分型均存在影响。
目前对于合并胸腺瘤MG患者进行胸腺切除术的有效性已经获得肯定,但对于胸腺增生或无胸腺异常者是否可从中获益还存疑问。Uzawa等[16]对胸腺增生MG患者胸腺切除治疗2年的随访研究表明,全身型迟发性MG患者术后症状缓解发生比例较高,接受泼尼松治疗的剂量下降,患者接受小剂量泼尼松(≤5 mg/d)保持最轻表现或改善的患者比例显著增高,提示胸腺切除术对于全身型迟发性MG有益。Nazarbaghi等[17]研究表明,给予扩大经胸骨胸腺切除术,术后应用溴吡斯的明和泼尼松治疗可使合并胸腺增生MG获得快速临床改善。2016年Wolfe等[18]对无胸腺异常的18~65岁全身型MG行扩大经胸骨胸腺切除术加激素的3年随访研究表明,行胸腺切除术者临床评分下降较单纯口服泼尼松者更为显著,泼尼松治疗剂量以及需加用硫唑嘌呤、病情恶化重新住院者比例均显著下降,提示胸腺切除术能够改善非胸腺瘤MG的3年期临床预后。本组资料中,胸腺瘤患者行手术治疗比例较高,而胸腺增生MG和胸腺正常者行手术比例较低或无,提示国内对于胸腺增生和胸腺正常MG患者进行手术治疗比较保守,推测可能与患者和家属接受程度,胸腺切除术的临床疗效还不确切,围手术期会诱发肌无力危象风险较高等因素有关。
对于无MG病史的胸腺瘤患者进行手术切除胸腺治疗后是否会诱发MG,Yamada等[19]研究表明,术前AChR抗体阳性,胸腺瘤病理类型为B1/B2/B3型,采用不完全胸腺切除术的术式,均是术后发生MG的危险因素,因此建议无MG病史的胸腺瘤患者术前应完善AChR抗体检查,对于行不完全性胸腺切除术的患者围手术期化疗或放疗可能会减少术后发生MG的风险。
除传统的胆碱酯酶抑制剂和糖皮质激素药物外,近年来其他一些免疫抑制剂也逐渐用于MG的治疗,应用比较多的是硫唑嘌呤,其他还有环磷酰胺、环孢素、他克莫司等。合并胸腺异常MG患者往往临床症状比较难控制,常规激素治疗效果不佳,因此更倾向于选择免疫抑制剂治疗[7]。本研究结果显示,胸腺异常组单纯合并激素治疗的比例低于胸腺正常组,推测可能与发现胸腺异常而准备手术治疗和病情控制不佳加用免疫抑制剂治疗等因素有关,进一步分析表明在胸腺异常组选择手术和联合激素+免疫抑制剂治疗的比例较高,进一步佐证了上述推测。
近年来随着生物技术和基因技术的不断发展,对于胸腺异常参与MG发病的机制有了更深入的理解。Zhang等[20]研究结果显示MG临床严重程度与滤泡性辅助CD4+T细胞相关因子的mRNA高表达有关。Geng等[21]研究发现肿瘤坏死因子-α诱导蛋白3相互作用蛋白-1 在合并胸腺瘤MG患者胸腺标本和外周血液中表达减少,手术切除胸腺后TNIP1表达恢复,而有关TNF-α诱导蛋白3基因多态性的研究并没有发现这种相关性[22]。基因研究表明,MG相关胸腺瘤T细胞免疫球蛋白簇和黏蛋白域蛋白质-3(Tim-3)启动子的574位点多态性、Tim-1启动子区的1637A/G多态性等与可能与MG合并胸腺瘤的发病机制有关[23-24]。Tiftikcioglu等[25]研究发现,在合并胸腺增生组HLA-A*01、A*31、B*08和DRB1*14分布更广泛,而DQB1*03频率下降。上述研究对于进一步明确胸腺异常在MG发病中作用提供了线索。
综上所述,MG患者合并胸腺异常比例较高,合并胸腺异常者病情较重,症状控制相对较难,均提示合并胸腺异常MG患者具有自身的临床特征,明确胸腺异常性质对于判断临床预后和治疗方案选择均具有指导意义。由于本研究纳入样本较少,部分病例缺少相关病理学证据支持,有关合并胸腺异常MG的确切临床特点及两者关系尚需进一步研究。
[1]Cavalcante P,Bernasconi P,Mantegazza R. Autoimmune mechanisms in myasthenia gravis[J]. Curr Opin Neurol,2012,25(5): 621-629.
[2]Gilhus NE,Verschuuren JJ. Myasthenia gravis: subgroup classification and therapeutic strategies[J]. Lancet Neurol,2015,14(10): 1023-1036.
[3]Meriggioli MN,Sanders DB. Autoimmune myasthenia gravis: emerging clinical and biological heterogeneity[J]. Lancet Neurol,2009,8(5): 475-490.
[4]Marulli G,Rea F. Myasthenia gravis and thymectomy: many doubts and few certainties[J]. Eur J Cardiothorac Surg,2015,48(1): 46-47.
[5]Cavalcante P,Le Panse R,Berrih-Aknin S,et al.The thymus in myasthenia gravis: Site of “innate autoimmunity”?[J]. Muscle Nerve,2011,44(4): 467-484.
[6]Boldingh MI,Maniaol A,Brunborg C,et al.Prevalence and clinical aspects of immigrants with myasthenia gravis in northern Europe[J]. Muscle Nerve,2017,55(6): 819-827.
[7]McCombe P,Raj M,Henderson R,et al.A case series of patients with autoimmune myasthenia gravis in association with invasive thymoma[J]. J Clin Neuromuscul Dis,2016,17(3): 129-134.
[8]中华医学会神经病学分会神经免疫学组,中国免疫学会神经免疫学分会. 中国重症肌无力诊断和治疗指南2015[J]. 中华神经科杂志,2015,48(11): 934-940.
[9]重症肌无力诊断和治疗中国专家共识[J]. 中国神经免疫学和神经病学杂志,2012(06): 401-408.
[10]Fujii Y. Thymus,thymoma and myasthenia gravis[J]. Surg Today,2013,43(5): 461-466.
[11]Lee JI,Jander S. Myasthenia gravis: recent advances in immunopathology and therapy[J]. Expert Rev Neurother,2017,17(3): 287-299.
[12]Truffault F,de Montpreville V,Eymard B,et al.Thymic germinal centers and corticosteroids in myasthenia gravis: an immunopathological study in 1035 cases and a critical review[J]. Clin Rev Allergy Immunol,2017,52(1): 108-124.
[13]Li Y,Chen P,Ding L,et al.Clinical outcome and predictive factors of irradiation-associated myasthenia gravis exacerbation in thymomatous patients[J]. Neurol Sci,2015,36(11): 2121-2127.
[14]Wu Y,Chen Y,Liu H,et al.Risk factors for developing postthymectomy myasthenic crisis in thymoma patients[J]. J Cancer Res Ther,2015,11(Suppl 1):115-117.
[15]黄玲,王磊,尹世敏,等.伴胸腺瘤的重症肌无力95例临床分析[J]. 疑难病杂志,2015,14(8): 853-855.
[16]Uzawa A,Kawaguchi N,Kanai T,et al.Two-year outcome of thymectomy in non-thymomatous late-onset myasthenia gravis[J]. J Neurol,2015,262(4): 1019-1023.
[17]Nazarbaghi S,Amiri-Nikpour MR,Mahmodlou R,et al.Clinical outcomes of myasthenia gravis with thymoma and thymic hyperplasia undergoing extended transsternal thymectomy: A single-center experience[J]. N Am J Med Sci,2015,7(11): 503-508.
[18]Wolfe GI,Kaminski HJ,Aban IB,et al.Randomized trial of thymectomy in myasthenia gravis[J]. N Engl J Med,2016,375(6): 511-522.
[19]Yamada Y,Yoshida S,Iwata T,et al.Risk factors for developing postthymectomy myasthenia gravis in thymoma patients[J]. Ann Thorac Surg,2015,99(3): 1013-1019.
[20]Zhang M,Zhou Y,Guo J,et al.Thymic TFH cells involved in the pathogenesis of myasthenia gravis with thymoma[J]. Exp Neurol,2014,254: 200-205.
[21]Geng Y,Song Y,Zhang Z,et al.The role of TNIP1 in the pathogenesis of myasthenia gravis among patients with thymoma[J]. Chin J Med Genet,2016,33(5): 615-618.
[22]Yang HW,Xie Y,Zhao Y,et al.TNFAIP3 gene rs7749323 polymorphism is associated with late onset myasthenia gravis[J]. Medicine(Baltimore),2017,96(20): e6798.
[23]Xu G,Zheng K,Lu X,et al.Association between polymorphisms in the promoter region of T cell immunoglobulin and mucin domain-3 and myasthenia gravis-associated thymoma[J]. Oncol Lett,2015,9(3): 1470-1474.
[24]Zheng K,Xu G,Lu X,et al.Expression and polymorphisms of T cell immunoglobulin domain and mucin domain protein-1 in thymoma with or without myasthenia gravis[J]. Oncol Lett,2014,8(1): 317-322.
[25]Tiftikcioglu BI,Uludag IF,Zorlu Y,et al.Human leucocyte antigen B50 is associated with conversion to generalized myasthenia gravis in patients with pure ocular onset[J]. Med Princ Pract,2017,26(1): 71-77.
