早期帕金森病伴认知功能障碍患者大脑皮层厚度研究
2018-05-30梅明金熊冬生聂坤高玉元张玉虎王丽娟
梅明金 熊冬生 聂坤 高玉元 张玉虎 王丽娟
帕金森病(Parkinson disease,PD)是最常见的慢性神经退行性疾病之一,伴发一系列运动和非运动症状。早期PD患者可表现为静止性震颤、动作迟缓和肌强直等运动症状,并伴随认知功能障碍(cognitive impairment,CI)、嗅觉障碍、睡眠障碍和行为障碍等非运动症状。近年来,以CI为代表的非运动症状越来越受到重视,通常其在PD临床诊断之前已出现,伴随运动症状的出现贯穿疾病全程,并最终进展为帕金森病痴呆(Parkinson disease with dementia,PDD)。PD患者出现痴呆症状的风险是普通老年人的6倍[1]。PDD会显著增加病残率和病死率,而且给患者家庭和社会带来沉重的心理和经济负担[2]。因此,探究早期PD患者CI症状改变的潜在标志物对预防PD患者发生痴呆或者延缓其进展有重要意义。有研究发现PD患者认知功能的减退与其大脑皮层厚度变薄有密切的联系[3]。基于此,本研究利用FreeSurfer软件观察早期PD伴CI患者皮层厚度变化及其与认知功能改变之间的相关性,为早期PD患者CI的诊断提供影像学标记物。
1 对象和方法
1.1对象回顾性收集2015-08—2017-08广东省人民医院神经内科就诊的PD患者62例,PD诊断由两位具有主治及以上职称的神经内科医生按照英国脑库PD标准进行独立诊断,并对患者进行以下量表评估:采用统一帕金森病评分量表(unified Parkinson disease rating scale,UPDRS)第Ⅲ部分评估PD患者的运动功能,应用Hoehn-Yahr(H-Y)分级对PD 病情严重程度进行评测,采用24项汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评估患者的抑郁情况,采用14项日常生活能力量表(activities of daily living scale,ADL)评估患者的日常行为能力,采用蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)评估患者的认知功能。入组PD患者均满足以下条件:年龄≥40岁,H-Y分级≤2.5,排除严重抑郁(HAMD≤20分)。根据MoCA评分将患者分为PD伴CI组(MoCA≤26分,PD-CI组)和PD未伴CI组(MoCA>26分,PD-NC组)[4]。另收集性别、年龄相匹配的26名志愿者作为健康对照(healthy controls,HCs),排除罹患神经精神疾病(如脑卒中、癫痫、抑郁、焦虑等引起认知减退)者,以及结构磁共振发现梗死灶者。
1.2方法
1.2.1MRI数据采集:所有受试者进行MRI(GE 3.0T)扫描采集数据。受试者取仰卧位,用海绵枕和头盔将头固定在矩阵头线圈上,同时佩戴耳塞,尽量减少头部活动。采用高分辨率扫描方法获取高分辨率的、高信噪比的三维T1加权图像,其具体参数:扫描层数146层、层厚1.00 mm、层间距1.00 mm、矩阵256×256、视野(FOV)512 mm× 512 mm、体素0.469 mm×0.469 mm ×1.0 mm、反转角13°、重复时间(TR)7.6 ms,回波时间(TE)3.3 ms。
1.2.2图像预处理:首先利用MRIcron 软件将收集的MRI数据由DICOM格式转化为NIFTI格式,随后利用Linux平台上的FreeSurfer软件(http://surfer.nmr.mgh.harvard.edu)完成提取大脑皮层厚度的处理过程。图像预处理包括:磁场的不均匀性校正、运动校正、去除头皮及颅骨非脑组织结构、分割灰质白质边界、自动拓扑校正与标准脑模板进行配准、高斯平滑、重建双侧大脑半球皮层、计算基于表面形态学指标——皮层厚度。
1.2.3皮层厚度的分析:(1)在FreeSurfer的Qdec模块中建立3个一般线性模型(general linear model),即图像对比矩阵,分别为HCs组对比PD-NC组(取P值为0.001)、HCs 组对比PD-CI组(P值设为0.0001)和PD-NC组对比PD-CI组(取P值为0.001)3个矩阵,通过对上述3个矩阵中两两组NIFTI图像进行皮层厚度的对比分析,找到各矩阵中皮层厚度差异的区域;(2)根据步骤(1)中所得到与认知相关的感兴趣脑区,分析3组感兴趣脑区的平均皮层厚度(mean cortical thickness,MCT)的差异性,并分析有差异的感兴趣脑区MCT与认知评分的相关性。
1.3统计学处理运用SPSS22.0统计软件进行数据分析,对数据进行正态性和方差齐性检验。符合正态分布的计量资料以均数±标准差表示,多组均数比较采用单因素方差分析,两组均数比较采用双侧t检验;非正态分布的计量资料以中位数(四分位数间距)表示,多组比较采用Kruskal-Wallis H检验(两两比较采用Nemenyi法),两独立样本间比较采用Mann-Whitney U检验;计数资料采用卡方检验;PD患者感兴趣脑区的MCT与认知评分之间的相关性采用Pearson线性相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1各组临床特征及量表评分比较各组在年龄、性别构成、受教育程度比较差异均无统计学意义(均P>0.05)。PD-NC组和PD-CI组间H-Y分级、病程、UPDRS-Ⅲ评分、ADL评分以及MoCA评分子项目的命名评分比较差异亦无统计学意义(均P>0.05),而在MoCA量表总评分及MoCA量表子项目的视空间与执行功能、抽象、定向、延迟回忆、语言、注意力评分均存在统计学差异(均P<0.05)。结果见表1。
2.2各组大脑皮层厚度存在差异的区域(1)与PD-NC组对比,PD-CI组左侧楔前叶、左侧颞上回等7个脑区出现皮层厚度变薄的区域,而大脑右侧中央前回的皮层厚度却出现增厚的区域(图1)。(2)与HCs组对比,PD-CI组大脑左侧的颞下回、楔前叶、岛叶、眶额部皮质外侧等26个脑区出现皮层厚度显著性变薄区域,而左侧中央前回脑区却出现皮层厚度显著性增厚区域。(3)与HCs组对比,PD-NC组大脑右侧的中央前回、中央后回、顶上小叶、额上回、颞下回5个脑区出现皮层厚度显著性变薄区域。3组被试者MRI图像两两对比所发现存在皮层厚度差异的区域见表2。
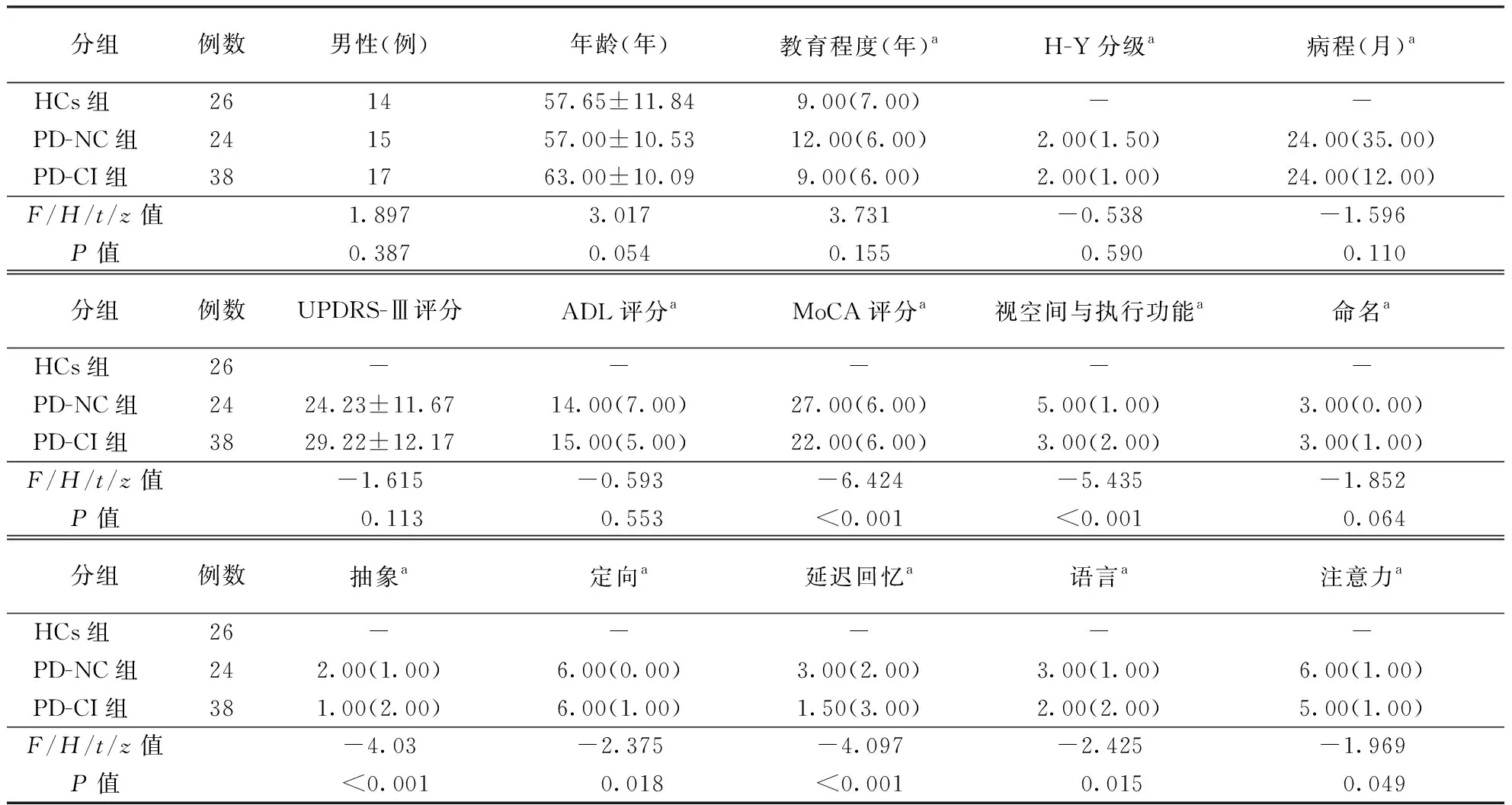
表1 各组临床特征及各量表评分结果比较
注:a数据以中位数(四分位数间距)表示;HCs:健康对照组,PD-NC:帕金森病未伴认知功能障碍,PD-CI:帕金森病伴认知功能障碍,表2~3、图1同;H-Y分级:Hoehn-Yahr分级;UPDRS-Ⅲ:统一帕金森病评分量表第Ⅲ部分;ADL:日常生活能力量表;MoCA:蒙特利尔认知评估量表,表4同;-:无数据
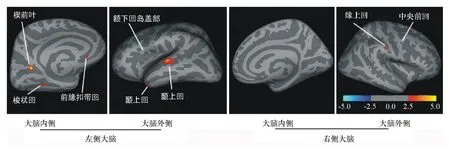
注:红色区域表示PD-CI组与PD-NC组比较皮层变薄的区域,颜色越接近黄色,差异越大;蓝色区域表示PD-CI组与PD-NC组比较皮层增厚的区域,蓝色越浅,差异越大 图 1 PD-NC组与PD-CI组对比存在皮层厚度差异区域的脑区
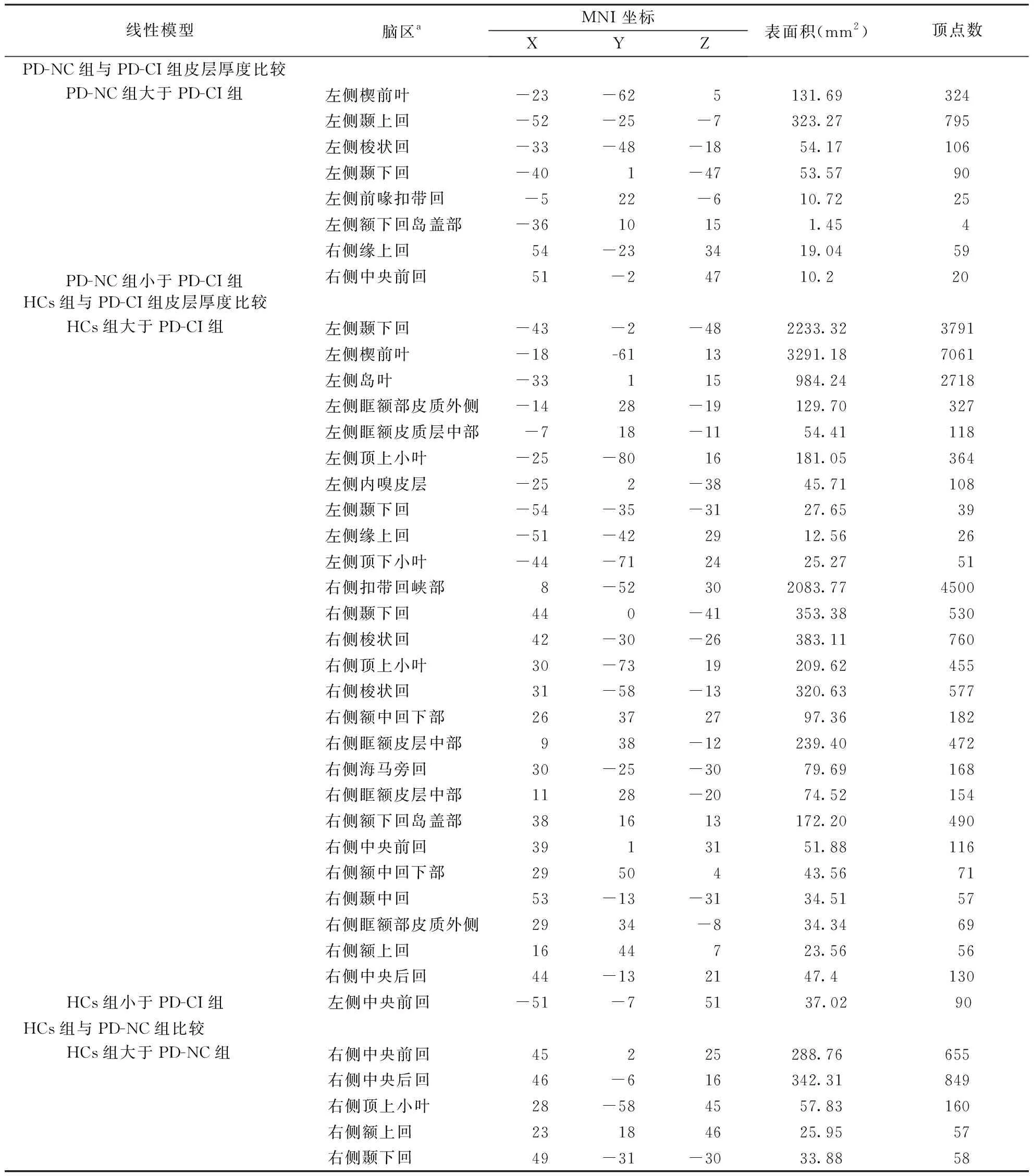
线性模型脑区aMNI 坐标XYZ表面积(mm2)顶点数PD-NC组与PD-CI组皮层厚度比较PD-NC组大于PD-CI组左侧楔前叶-23-625131.69324左侧颞上回-52-25-7323.27795左侧梭状回-33-48-1854.17106左侧颞下回-401-4753.5790左侧前喙扣带回-522-610.7225左侧额下回岛盖部-3610151.454右侧缘上回54-233419.0459PD-NC组小于PD-CI组右侧中央前回51-24710.220HCs组与PD-CI组皮层厚度比较HCs组大于PD-CI组左侧颞下回-43-2-482233.323791左侧楔前叶-18-61133291.187061左侧岛叶-33115984.242718左侧眶额部皮质外侧-1428-19129.70327左侧眶额皮质层中部-718-1154.41118左侧顶上小叶-25-8016181.05364左侧内嗅皮层-252-3845.71108左侧颞下回-54-35-3127.6539左侧缘上回-51-422912.5626左侧顶下小叶-44-712425.2751右侧扣带回峡部8-52302083.774500右侧颞下回440-41353.38530右侧梭状回42-30-26383.11760右侧顶上小叶30-7319209.62455右侧梭状回31-58-13320.63577右侧额中回下部26372797.36182右侧眶额皮层中部938-12239.40472右侧海马旁回30-25-3079.69168右侧眶额皮层中部1128-2074.52154右侧额下回岛盖部381613172.20490右侧中央前回3913151.88116右侧额中回下部2950443.5671右侧颞中回53-13-3134.5157右侧眶额部皮质外侧2934-834.3469右侧额上回1644723.5656右侧中央后回44-132147.4130HCs组小于PD-CI组左侧中央前回-51-75137.0290HCs组与PD-NC组比较 HCs组大于PD-NC组右侧中央前回45225288.76655右侧中央后回46-616342.31849右侧顶上小叶28-584557.83160右侧额上回23184625.9557右侧颞下回49-31-3033.8858
注:a表示皮层厚度存在差异区域所在脑区;MNI坐标:皮层厚度差异区域位于蒙特利尔神经研究所(Montreal Neurological Institute,MNI)坐标空间下的位置;顶点数目和表面积表示差异区域的范围大小
2.3感兴趣脑区MCT比较通过上述对比分析发现,与PD患者认知受损相关且皮层厚度变薄的区域主要出现在大脑左侧的楔前叶、颞上回、梭状回、颞下回、前缘扣带回、额下回岛盖部和大脑右侧缘上回7个脑区,对该7个感兴趣脑区的MCT进行比较结果显示,3组在左侧楔前叶、左侧颞上回、左侧梭状回、左侧前喙扣带回、左侧颞下回5个脑区MCT比较差异有统计学意义(均P<0.01),两两比较,PD-CI组在左侧楔前叶、左侧梭状回、左侧前喙扣带回、左侧颞上回和左侧颞下回MCT较HCs组变薄,且PD-CI组在左侧楔前叶、左侧前喙扣带回和左侧颞下回MCT较PD-NC组变薄。结果见表3。
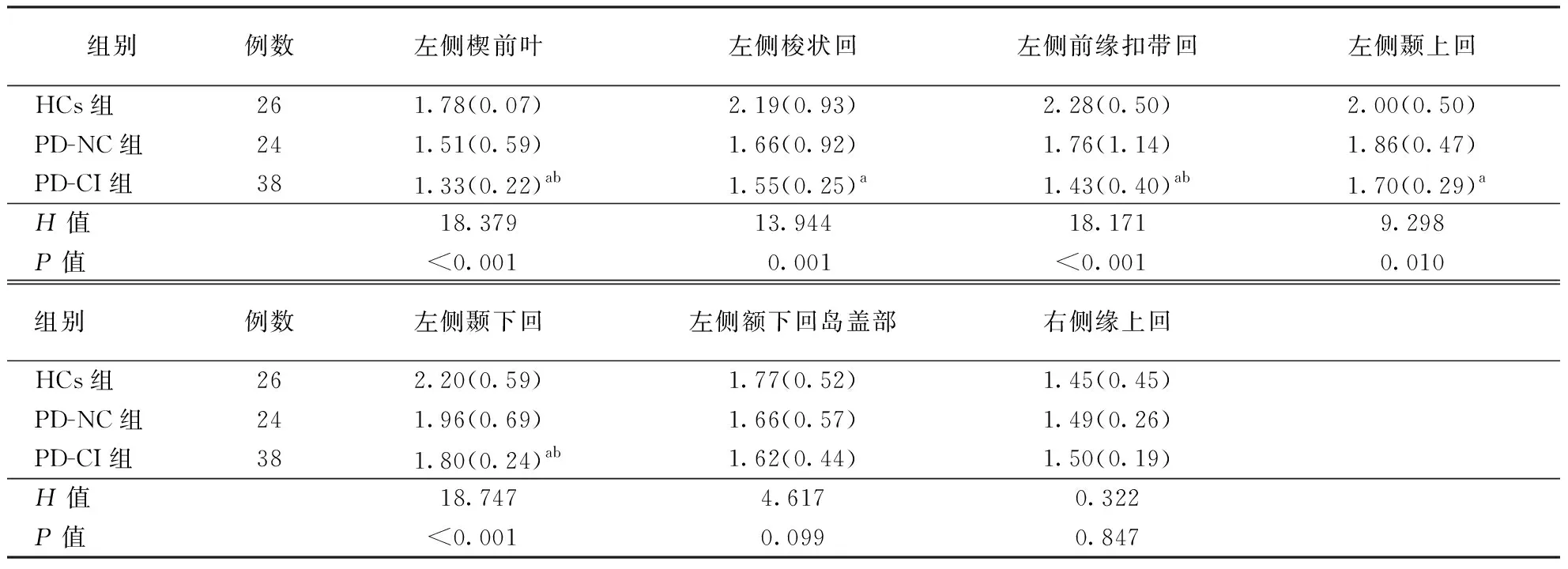
表3 各组被试者不同感兴趣脑区的MCT比较
注:表中数据以中位数(四分位数间距)表示;MCT:平均皮层厚度,表4同;与HCs组比较,aP<0.01;与PD-NC组比较,bP<0.05
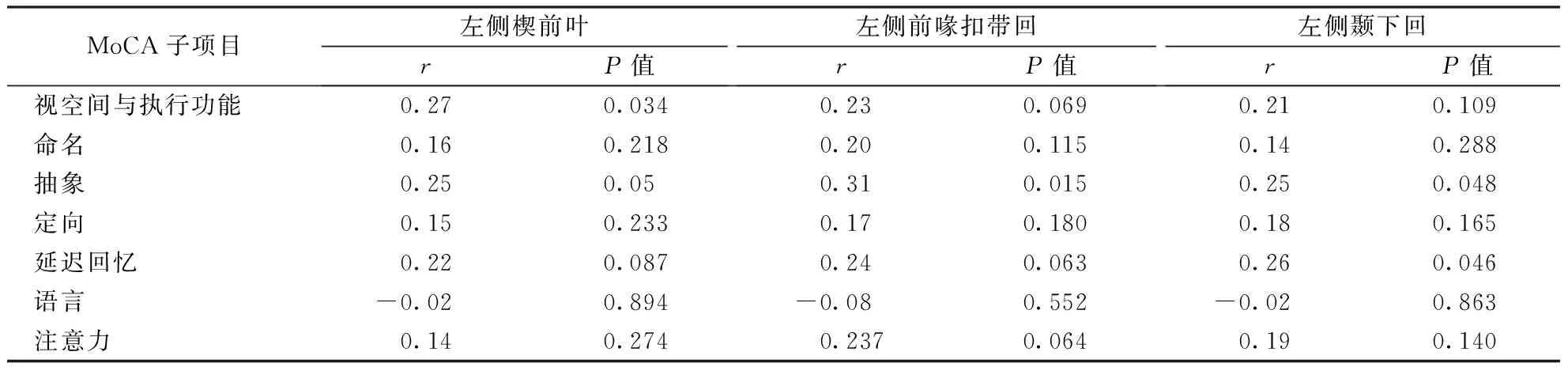
表4 PD患者MoCA量表各子项目评分与不同感兴趣脑区MCT的相关性分析
注:PD:帕金森病
2.4MCT与MoCA评分的相关性对62例PD患者MoCA量表各子项目评分与不同感兴趣脑区MCT进行相关性分析显示,左侧楔前叶MCT与视空间与执行功能存在显著正相关(r=0.27,P=0.034),左侧前喙扣带回MCT与抽象存在显著正相关(r=0.31,P=0.015),左侧颞下回MCT与抽象(r=0.25,P=0.048)和延迟回忆(r=0.26,P=0.046)存在显著正相关(表4)。
3 讨论
CI是PD患者普遍存在的非运动症状之一,严重影响患者的生活质量,因此研究PD-CI潜在的标记物对预防或延缓PD患者认知功能受损具有重要意义。尽管临床表现经常被用来评估PD患者认知功能减退的风险,但神经影像学标记物可提供一种无创的手段辅助早期诊断PD-CI[5]。近来研究发现大脑灰质体积[6]、皮层厚度[7]等可用来评估PD患者的CI。亦有研究发现皮层厚度可作为评估PD-CI转化为PDD风险的一个有效指标[8]。基于此,本研究进一步探讨早期PD-CI患者皮层厚度的变化,并分析了皮层厚度与早期PD-CI症状之间的关系。
本研究发现,PD-CI患者左侧的楔前叶、前喙扣带回和颞下回3个脑区MCT与HCs组和PD-NC组比较明显变薄,且左侧楔前叶皮层厚度和视空间与执行功能、左侧前喙扣带回MCT与抽象、左侧颞下回MCT与抽象和延迟回忆均存在显著正相关,而PD-NC组与HCs组上述3个脑区MCT比较差异无统计学意义,表明PD患者的认知与左侧的楔前叶、前喙扣带回和颞下回脑区皮层萎缩有密切关系。既往多项研究发现大脑皮层厚度变化与认知存在密切关系,如Pagonabarraga等研究结果显示左侧楔前叶皮层萎缩和PDD关系密切[9],而楔前叶与情景记忆、自我相关的信息处理以及意识等许多高级认知功能有关;左侧颞叶皮层萎缩和PD伴轻度认知障碍以及PDD均有密切关系[9-10],而颞叶主要与记忆能力有关;Manza等[11]通过静息态功能磁共振图像研究还发现,早期PD患者认知水平下降与左侧前喙扣带回的活动异常有关。本研究结果与上述研究结果相符合,提示早期PD患者认知功能的下降与左侧的楔前叶、前喙扣带回和颞下回3个脑区皮层的萎缩有密切关系。
综上所述,本研究结果显示PD患者大脑左侧的楔前叶、前喙扣带回、颞下回脑区MCT变薄,且与视空间与执行功能、命名、抽象等认知功能具有相关性,其可能成为早期PD患者CI诊断的影像学标记物。由于本研究PD-CI的诊断标准仅仅采用的是MoCA量表,虽然MoCA量表被证明是一种简单而又较精确评估整体认知水平的方法[12],但其对各认知域的评估较为粗略,同时本研究纳入的样本量相对较小,因此,有关PD患者大脑皮层厚度变化与CI的确切关系尚需进一步研究。
[1]Aarsland D,Andersen K,Larsen JP,et al.Risk of dementia in Parkinson’s disease: a community-based,prospective study[J]. Neurology,2001,56(6): 730-736.
[2]Aarsland D,Kurz MW.The epidemiology of dementia associated with Parkinson disease[J]. J Neurol Sci,2010,20(3): 633-639.
[3]Beyer MK,Janvin CC,Larsen JP,et al.A magnetic resonance imaging study of patients with Parkinson’s disease with mild cognitive impairment and dementia using voxel-based morphometry[J]. J Neurol Neurosurg Psychiatry,2007,78(3): 254-259.
[4]Litvan I,Goldman JG,Troster AI,et al.Diagnostic criteria for mild cognitive impairment in Parkinson’s disease: Movement Disorder Society Task Force Guidelines[J]. Mov Disord,2012,27(3): 349-356.
[5]Lin CH,Wu RM.Biomarkers of cognitive decline in Parkinson’s disease[J]. Parkinsonism Relatd Disord,2015,21(5): 431.
[6]Melzer TR,Watts R,MacAskill MR,et al.Grey matter atrophy in cognitively impaired Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry,2012,83(2): 188-194.
[7]Zarei M,Ibarretxe-Bilbao N,Compta Y,et al.Cortical thinning is associated with disease stages and dementia in Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry,2013,84(8): 875.
[8]Gascasalas C,Garcíalorenzo D,Garciagarcia D,et al. Parkinson’s disease with mild cognitive impairment: severe cortical thinning antedates dementia[J]. Brain Imaging Behav,2017,(10): 1-9.
[9]Pagonabarraga J,Corcuera-Solano I,Vives-Gilabert Y,et al.Pattern of regional cortical thinning associated with cognitive deterioration in Parkinson’s disease[J]. PLoS One,2013,8(1): e54980.
[10]Pereira JB,Svenningsson P,Weintraub D,et al.Initial cognitive decline is associated with cortical thinning in early Parkinson disease[J]. Neurology,2014,82(22): 2017-2025.
[11]Manza P,Zhang S,Li CS,et al.Resting-state functional connectivity of the striatum in early-stage Parkinson’s disease: Cognitive decline and motor symptomatology[J]. Hum Brain Mapp,2016,37(2): 648-662.
[12]Dalrymple-Alford JC,MacAskill MR,Nakas CT,et al.The MoCA: well-suited screen for cognitive impairment in Parkinson disease[J]. Neurology,2010,75(19): 1717-1725.
