以急性脑梗死为首发表现的躯体恶性肿瘤34例分析
2018-05-30陆中华周瑛俞建华倪玲桂雪琼汪犀文韩一平
陆中华 周瑛 俞建华 倪玲 桂雪琼 汪犀文 韩一平
恶性肿瘤和脑梗死是目前导致人类死亡和残疾的两大主要疾病,研究表明恶性肿瘤患者脑梗死发生率是一般人群的1.5倍[1],其中20%~40%的恶性肿瘤患者无传统的脑卒中危险因素,其脑梗死的发生可能与恶性肿瘤有关,被称为恶性肿瘤相关脑梗死[2]。早在1865年Trousseau首次提出胃癌患者易形成静脉血栓,之后将癌症患者在其发病过程中因凝血和纤溶机制异常而出现的包括动脉血栓栓塞在内的所有临床表现统称为Trousseau综合征。近年来陆续有少量以急性脑梗死为首发临床表现而发现潜在躯体恶性肿瘤的报道,该类患者仅占同期脑卒中患者的0.4%左右,且其中80%的患者在脑卒中复发后才诊断隐匿性躯体恶性肿瘤[3-4]。此类患者预后极差,平均生存时间58 d[3],因此值得临床重视。如何快速识别是否具有潜在躯体恶性肿瘤及避免漏诊误诊,及早行肿瘤针对性治疗改善全身高凝状态避免脑梗死的再发,避免凝血功能紊乱导致的颅外其他动脉栓塞、无菌性血栓性心内膜炎、弥漫性血管内凝血、静脉栓塞〔肺栓塞和(或)深静脉血栓形成〕中一种或几种同时发生,对改善肿瘤患者的生存时间和生存质量具有重要意义。
1 对象和方法
1.1研究对象收集2007—2016年第二军医大学附属长海医院和杨浦区市东医院神经内科住院或急诊留观的急性脑梗死患者,并从中筛选出住院期间证实患有躯体恶性肿瘤的患者34例。纳入标准:(1)诊断急性脑梗死,即突然出现肢体乏力、麻木、构音障碍等局灶性神经功能缺失表现,在症状出现后的3 d内经头颅CT排除脑出血、头颅MRI平扫及弥散加权成像(DWI)证实颅内可以解释症状的新发病灶,21 d后再次行头颅MRI平扫和DWI证实上述病灶符合脑梗死改变;(2)急性脑梗死的诊断标准参照美国心脏病学会最近修订的脑梗死诊断标准[5];(3)住院接受治疗期间,经临床、实验室、影像学和/或病理学检查确诊躯体恶性肿瘤;(4)符合隐匿性躯体恶性肿瘤定义:在脑卒中后查找病因过程中才得以诊断的躯体恶性肿瘤,在脑卒中之前未被诊断;(5)临床资料完整;(6)MRA检查未见责任动脉狭窄≥50%;(7)头颅MRI病灶最大直径大于15 mm。排除标准:(1)有房颤病史者;(2)既往诊断恶性肿瘤患者;(3)MRI诊断合并有脑转移灶的患者;(4)存在MRI检查禁忌证者;(5)非知情同意者。
1.2方法
1.2.1临床资料收集:包括患者年龄、性别、既往史(传统脑卒中危险因素如高血压、糖尿病、高脂血症、冠心病、烟酒嗜好、脑血管病史等);脑梗死起病形式、复发病程、局灶性神经功能缺损、有无昏迷;肿瘤类型、远处转移与否;实验室检查项目包括血常规、血液生化检测、凝血功能及D-二聚体水平、心脏B超、心电图等;是否溶栓取栓、抗凝抗血小板治疗情况;脑梗死稳定后是否针对肿瘤行手术、化疗、放疗治疗;预后情况包括卒中复发、其他血栓栓塞事件。为减少因为癌症进展对患者运动功能的影响,在脑梗死发病30 d,采用改良Rankin量表(mRS)评分评估患者的预后,mRS 0~2分为预后良好,3~5分预后不佳,6分为死亡。
1.2.2影像学:头颅CT平扫、头颅MRI T1WI、T2WI、T2-FLAIR和DWI序列、经颅彩色多普勒超色、磁共振血管成像、头颈部CT血管成像或全脑数字减影脑血管造影等临床资料。记录DWI上新发梗死灶分布形式。病灶分布形式分为单侧前循环、后循环、双侧前循环、单侧/双侧前循环+后循环。前两者属于单支动脉供血区域,后两者属于多支动脉供血区域。
1.3统计学处理应用SPSS19.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,两均数比较采用独立样本t检验,非正态分布的计量资料以中位数(四分位数间距)形式表示,采用Mann-WhitneyU检验;计数资料采用卡方检验或Fisher精确检验。以P<0.05为差异有统计学意义。
2 结果
2.1一般临床特征34例患者中男29例,女5例,平均年龄(66.94±10.09)岁。28例(82.35%)具有脑卒中传统危险因素,最常见的为高血压20例(58.82%)、吸烟11例(32.35%)、糖尿病7例(20.59%),其他为高脂血症5例(14.71%)、饮酒4例、冠心病和既往脑卒中史各3例,无上述危险因素者6例(17.65%)。均为急性起病,以局灶神经功能缺损为主要表现,偏瘫21例,失语10例,其他表现包括偏身感觉障碍、眩晕、站立和步态不稳、构音障碍、偏盲、四肢瘫、肢体抽搐、头痛、短暂意识丧失、吞咽困难、饮水呛咳等。就诊期间病情进展为昏迷者3例,急性心肌梗死1例,下肢肿胀并经超声诊断下肢深静脉血栓1例。
2.2实验室检查外周血D-二聚体水平(正常参考范围0.1~0.5 mg/L)为0.18~16 mg/L,中位数(四分位数间距)为1.205(5.26)mg/L,24例(70.59%)患者升高。血浆纤维蛋白原(FIB,正常参考范围2~4 g/L)水平为1.14~6.05 g/L,平均(3.17±1.48)g/L。国际标准化(凝血酶原时间)比值(INR,正常参考范围0.8~1.2)为0.9~1.6,平均1.11±0.15。血浆白蛋白为21~45 g/L,平均(35±5.7)g/L,12例存在低蛋白血症。胆固醇水平(正常参考范围2.8~5.17 mmol/L)为2.31~6.37 mmol/L,平均(4.12±0.90)mmol/L。三酰甘油水平(正常范围0.56~1.7 mmol/L)为0.45~4.4 mmol/L,平均(1.46±0.89)mmol/L。低密度脂蛋白水平(正常参考范围2.07~3.12 mmol/L)为0.91~4.02 mmol/L,平均(2.24±0.81)mmol/L。轻度贫血16例,中度贫血2例。
2.3脑影像学检查DWI序列显示累及单支动脉供血区域的急性脑梗死20例,其中11例为单侧前循环,9例为后循环;累及多支动脉供血区域的急性多发性脑梗死14例(41.18%),其中8例为单侧前/双侧前循环+后循环,6例为双侧前循环。2例患者出现新鲜脑梗死伴出血。所有患者行T2WI、T2-FRAIR序列检查发现18例(52.94%)患者存在陈旧无症状性脑梗死(silent cerebral infarction,SCI),其中<50岁者未检出SCI(0/2),≥50岁且<60岁SCI检出1例(1/5),≥60岁且<70岁共检出7例(7/12),≥70岁者检出10例(10/15)。根据TOAST分型标准[6],本组病例均符合原因不明型脑梗死。
2.4肿瘤特点以肺癌11例最为多见,占32.35%,肾癌7例(20.59%),其他为结直肠癌和胰腺癌各4例(11.76%),膀胱癌和胃癌各2例,食管癌、下咽癌、胆囊癌、肝癌各1例。11例肺癌中腺癌7例、鳞癌2例,病理不明者2例(家属拒绝病理检查)。肾癌主要为透明细胞癌4例,其余3例病理不详。诊断时已有远处转移者9例(26.47%)。
2.5治疗及预后抗血小板治疗者14例,抗凝+抗血小板治疗者6例,溶栓+取栓者1例,其他治疗者13例。发病30 d行mRS评分判断预后,其中19例患者神经功能预后良好(mRS 0~2分),9例患者中重度残疾(mRS 3~5分),6例(17.65%)患者住院期间死亡(mRS 6分),死亡原因分别为大面积脑梗死3例,急性心肌梗死1例,肠梗阻1例,胰腺癌晚期多脏器功能衰竭1例。神经功能恢复良好的患者中,10例接受手术治疗,2例接受化疗,1例接受放疗。5例(14.70%)患者出现脑梗死复发,均复查MRI证实较前出现新发梗死灶,其中2例为肺癌化疗治疗后的3个月内再发脑梗死,1例胰腺癌和1例肾癌患者均在肿瘤手术后1周内出现脑梗死再发,1例胰腺癌患者发现肿瘤3个月并手术前行常规检查发现新发SCI。
2.6影响预后因素分析预后良好组(mRS 0~2分)和预后不良组(mRS 3~6分)间血浆D-二聚体水平(P=0.000)、恶性肿瘤有无远处转移(P=0.025)比较差异有统计学意义,而传统脑卒中危险因素(高血压、糖尿病、冠心病、高脂血症、吸烟、饮酒、既往卒中史)、实验室指标(如INR、FIB、白蛋白、血红蛋白、胆固醇、三酰甘油、低密度脂蛋白)、有无接受抗凝抗血小板治疗以及脑梗死分型间比较差异无统计学意义(均P>0.05)。结果见表1。
3 讨论
恶性肿瘤患者脑梗死的发生除与传统的脑卒中危险因素有关外,恶性肿瘤特有的致病机制亦可影响脑卒中的发生,如通过瘤性栓塞、直接压迫头颈部动脉血管壁导致缺血性卒中[7],恶性肿瘤引起的血液高凝状态、放射治疗及化学疗法和激素剥夺治疗引起的相关性脑卒中等[8]。根据TOAST分型标准[6],恶性肿瘤患者缺血性脑卒中的病因构成可分为原因不明型(约50%)、心源性(约20%)、大动脉粥样硬化性(约15%)、脑小血管病(约10%)、其他少见原因(约5%)[9]。本组病例有传统脑卒中危险因素者多达28例(82.35%),根据TOAST分型均为原因不明型,故临床上遇到缺血性卒中患者,即使有传统脑卒中危险因素,仍需根据脑梗死病灶分布形式、血D-二聚体水平、MR血管成像等,及早识别出以脑梗死为首发表现的潜在隐匿性躯体恶性肿瘤患者显得至关重要。
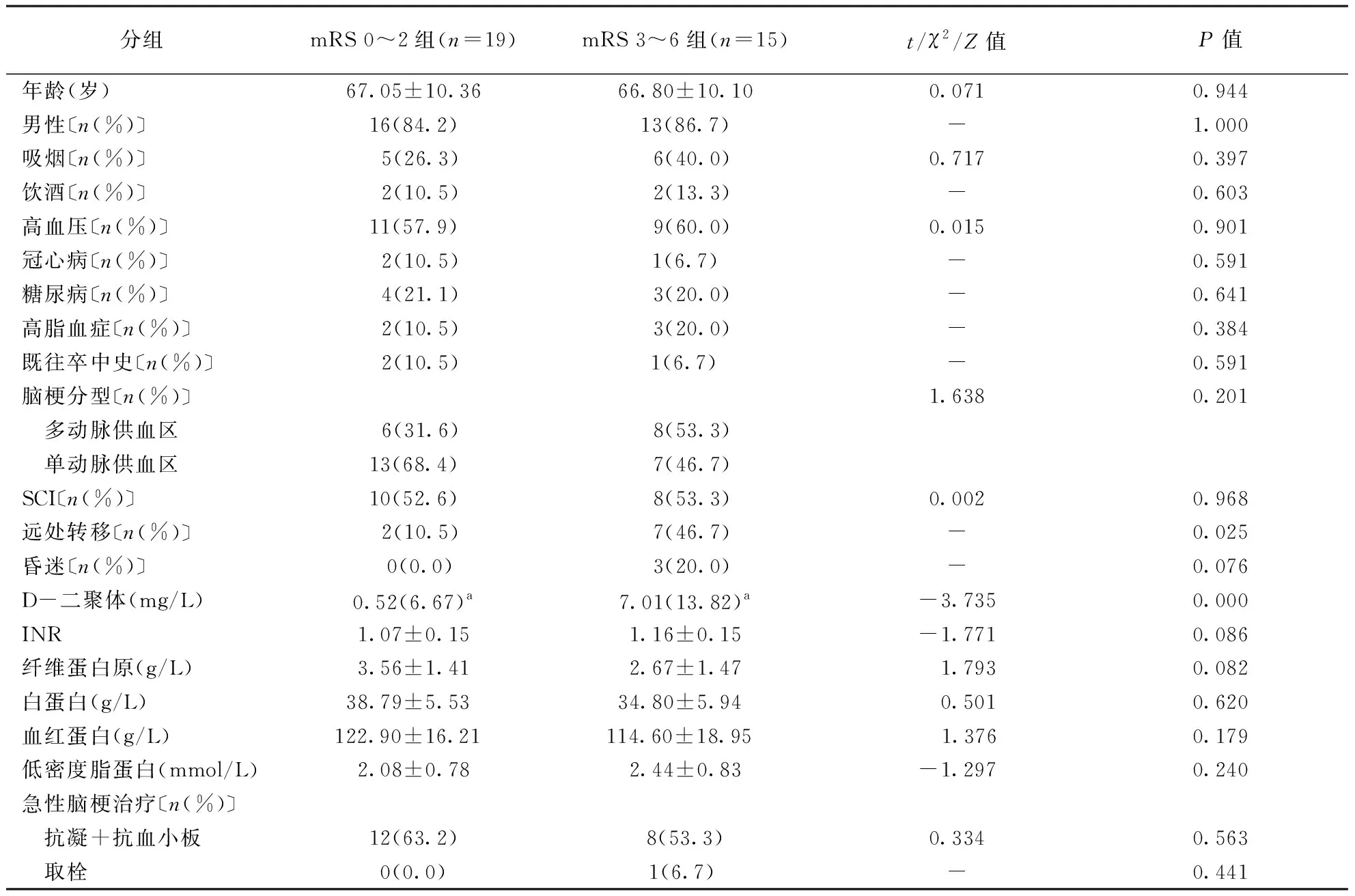
表1 34例患者30 d神经功能预后影响因素分析
注:mRS:改良Rankin量表;SCI:无症状性脑梗死;INR:国际标准比值;a数据以中位数(四分位数间距)形式表示
本组患者均呈急性起病,以局灶神经功能缺损为主要表现,符合急性脑梗死临床表现,其中3例患者进展为昏迷,1例为溶栓治疗后出现昏迷,出院时虽意识转清,但1个月后脑梗死复发,余2例均为脑梗死复发病程中病情进展为昏迷。
本组病例影像学上具有MRI累及多个动脉供血区的多个病灶和不同阶段(早期、亚急性期、慢性期)的脑梗灶两大特点,首先影像学上DWI表现有≥2个供血区域病变共14例(41.18%),其次19例(55.88%)患者在T2WI、T2-FRAIR序列发现有陈旧的SCI依据,考虑为亚急性期、慢性期病变。Schwarzbach等[10]通过对32例恶性肿瘤相关性脑梗死患者研究发现,患者平均D-二聚体水平为(15.39±10.84)μg/mL,在MRI上表现有≥2个供血区域病变占84.4%,表现为散射性(微小)梗死灶占78.1%,发现有陈旧性SCI病灶占50.0%。林福禧等[11]对年龄为26~85岁的879名健康体检者行MRI检查发现,SCI检出率40岁以下为3%,40~50岁为9%,51~60岁为27%,61岁以上为67%,年龄每增加10岁,SCI发病危险增加1.5~2.0倍。本研究结果显示,共18例(52.94%)患者存在陈旧SCI,其中<50岁者未检出SCI(0/2),≥50岁且<60岁SCI检出1例(1/5),≥60岁且<70岁共检出7例(7/12),≥70岁者检出10例(10/15)。本组恶性肿瘤患者SCI检查率与国内健康人群SCI检查率结果相似,提示恶性肿瘤并未增加SCI发生率。
本研究结果显示,24例患者出现外周血D-二聚体水平升高,其D-二聚体水平中位数为1.205 μg/mL,提示存在凝血活化和血栓形成。这与Lee等[12]研究结果相符。Seok等[13]研究发现癌症患者D-二聚体水平与多普勒超声检测到颈动脉区血栓信号大小呈正相关,进一步直观提示血液凝固性升高导致的血管内微小血栓形成可导致肿瘤相关性脑梗死的发生。本组病例多存在D-二聚体水平明显升高,MRI多表现为多动脉供血区域的脑梗死病灶为特点,心脏超声检查未见瓣膜附壁血栓,考虑发病机制为高凝状态引起的微小栓塞或局部小血管血栓形成可能大。
本研究亦发现,30 d内住院死亡率为17.65%(6/34),6例患者死亡原因分别为大面积脑梗死3例,急性心肌梗死1例,肠梗阻1例,胰腺癌晚期多脏器功能衰竭1例。Kneihsl等[14]研究比较了合并有恶性肿瘤与不合并恶性肿瘤的不明原因脑卒中患者的预后提示,恶性肿瘤合并脑梗死组与单纯不明原因型脑梗死组住院死亡率分别为21.9%和6.2 %(P=0.001),多因素分析显示,入院时美国国立卫生研究院卒中量表(NIHSS)评分(OR=1.10,95%CI:1.10~1.20)和C-反应蛋白水平(OR=1.01,95%CI:1.00~1.02)与院内死亡显著相关。Zhang等[15]研究亦提示,肿瘤合并脑梗死组患者在住院期间死亡较单纯脑梗死组更多,死亡原因脑卒中占30%,其他为肺炎、心肌梗死和癌症。本研究发现,高血浆D-二聚体水平与恶性肿瘤有远处转移是患者30 d神经功能预后差的相关危险因素,且根据TOAST分型,在排除了其他病因的基础上,提示恶性肿瘤引起的高凝状态是恶性肿瘤患者脑梗死预后差的相关危险因素。因此,除考虑脑卒中传统危险因素控制(如戒烟酒以及控制血压、血糖、冠心病、高脂血症)外,积极抗肿瘤治疗减轻肿瘤负荷,改善癌症引起的高凝状态,是预防肿瘤相关脑梗死发生和复发的基础,但目前国内外尚无大样本研究,其确切结论仍需进一步研究支持。
随着老龄化社会的发展,脑卒中和恶性肿瘤的发病率均明显升高,较多恶性肿瘤患者同时合并有传统脑卒中危险因素,因此有传统卒中危险因素的急性多发脑梗患者不能除外合并恶性肿瘤的可能。虽以急性脑梗死为首发临床表现而发现潜在躯体恶性肿瘤的患者仅占同期脑卒中患者的0.4%左右[3-4],但当临床上遇到具有血浆D-二聚体升高、低蛋白血症及贫血的急性多动脉供血区域脑梗死且缺乏传统卒中危险因素的患者时,需考虑存在潜在躯体恶性肿瘤的可能,应积极行相关检查寻找潜在恶性肿瘤。由于本研究为回顾性研究,病例数较少,且受病情危重等条件所限,尽管对患者行经胸心脏超声检查,但均未能完善经食道超声和主动脉弓的检查,不能完全除外传统心源性卒中病因或主动脉弓来源栓塞。因此,有关以急性脑梗死为临床表现的隐匿性躯体恶性肿瘤的确切特点及两者的关系需进一步研究。
[1]Lau KK,Wong YK,Teo KC,et al.Stroke patients with a past history of cancer are at increased risk of recurrent stroke and cardiovascular mortality[J].PloS One,2014,9(2):e88283.
[2]Kim JM,Jung KH,Park KH,et al.Clinical manifestation of cancer related stroke: retrospective case-control study[J].J Neurooncol,2013,111(3):295-230.
[3]Taccone FS,Jeangette SM,Blecic SA.First-ever stroke as initial presentation of systemic cancer[J].J Stroke Cerebrovasc Dis,2008,17(4):169-174.
[4]Kim SJ,Park JH,Lee MJ,et al.Clues to occult cancer in patients with ischemic stroke[J].PloS One,2012,7(9):e44959.
[5]Jauch EC,Saver JL,Adams HP,et al.Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stoke Association[J].Stroke,2013,44(3):870-947.
[6]Ay H.Advances in the diagnosis of etiologic subtypes of ischemic stroke[J].Curr Neurol Neurosci Rep,2010,10(1):14-20.
[7]Martin-Negrier ML,Belleannee G,Vital C,et al.Primitive malignant fibrous histiocytoma of the neck with carotid occlusion and multiple cerebral ischemic lesions[J].Stroke,1996,27(3):536-537.
[8]Teoh JY,Chiu PK,Chan SY,et al.Risk of ischemic stroke after androgen deprivation therapy for prostate cancer in the Chinese population living in Hong Kong[J].Jpn J Clin Oncol,2015,45(5):483-487.
[9]Navi BB,Singer S,Merkler AE,et al.Recurrent thromboembolic events after ischemic stroke in patients with cancer[J].Neurology,2014,83(1):26-33.
[10]Schwarzbach C J,Fatar M,Eisele P,et al.DWI lesion patterns in cancer-related stroke-specifying the phenotype[J]. Cerebrovasc Dis Extra,2015,5(3):139-145.
[11]林福禧,余海峰,施惠飞.无症状脑梗死与年龄、血压、血脂、血糖相关分析[J].中国慢性病预防与控制,2003,11(3):101.
[12]Lee EJ,Nah HW,Kwon JY,et al.Ischemic stroke in patients with cancer: is it different from usual strokes?[J].Int J Stroke,2014,9(4):406-412.
[13]Seok JM,Kim SG,Kim JW,et al.Coagulopathy and embolic signal in cancer patients with ischemic stoke[J].Am Neurol,2010,68(2):213-219.
[14]Kneihsl M,Enzinger C,Wünsch G,et al.Poor short-term outcome in patients with ischaemic stroke and active cancer[J].J Neurol,2016,263(1): 150-156.
[15]Zhang YY,Chan DK,Cordato D,et al.Stroke risk factor,pattern and outcome in patients with cancer[J].Acta Neurol Scand,2006,114(6):378-383.
[16]Navi BB,Deangelis LM,Segal AZ.Multifocal strokes as the presentation of occult lung cancer[J].J Neurooncol,2007,85(3):307-309.
