异氟醚对大鼠海马组织小窝蛋白家族表达的影响
2018-05-30蔡琳隋大鸣付海钰査鹏古小平巩固
蔡琳 隋大鸣 付海钰 査鹏 古小平 巩固
异氟醚是一种常用的吸入性麻醉剂,能够阻碍大脑海马区功能并导致记忆和认知功能障碍[1]。有大量研究发现,诱导神经细胞凋亡、氧化应激和线粒体功能障碍是异氟醚产生细胞毒性作用的主要因素[2]。小窝是已分化细胞的细胞膜上凹陷,小窝蛋白是小窝的主要成分,包含3个家族成员,即小窝蛋白1(caveolin-1,Cav-1)、Cav-2和Cav-3。Cav-1是细胞“脂筏”的重要标记蛋白,广泛参与细胞迁移、肿瘤形成、神经发育以及干细胞增殖活动[3]。Cav-2与Cav-1通常表达于非肌肉细胞中,而Cav-3则在肌肉细胞中表达丰富。三者在哺乳动物大脑中均有表达,参与细胞胞吞、胆固醇转运过程,同时也参与脑源性神经营养因子(brain derived neurotrophic factor,BDNF)/酪氨酸激酶受体B(tyrosine receptor kinase B,TrkB)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)等多种细胞信号转导过程,对细胞正常生命活动具有重要意义[4-6]。小窝蛋白在神经细胞发育及正常功能中发挥不可或缺的重要作用[7-8]。本研究探索了异氟醚对小窝蛋白表达的影响及小窝蛋白的作用,旨在阐明异氟醚产生神经毒性的作用机制。
1 材料和方法
1.1实验材料HEK293细胞购自美国典型培养物保藏中心(ATCC),阿糖胞苷购自上海生工,异氟醚购自上海雅培,DMEM培养基、胰酶、胎牛血清、内切酶BamHⅠ、SalⅠ、pDC315腺病毒质粒、腺病毒包装质粒、Trizol试剂、cDNA反转录试剂盒、Fast SYBRTMGreen Master Mix购自美国Thermo Fisher公司,Cav-1抗体、Cav-2抗体、Cav-3抗体、BDNF抗体、ERK1/2抗体、p-ERK1/2抗体、TrkB抗体、内参GAPDH抗体购自美国R&D system公司,聚偏氟乙烯膜、Braford蛋白浓度测定试剂盒、噻唑蓝(MTT)试剂盒、ECL试剂盒、二甲基亚砜购自江苏碧云天生物公司。
1.2动物SPF级SD大鼠共40只,购自北京维通利华公司〔许可证号SCXK(京)2016-0006〕,雌雄各半,7周龄。随机分为对照组、异氟醚1组(ISO1)、异氟醚2组(ISO2)、异氟醚3组(ISO3),每组10只。
1.3方法
1.3.1异氟醚处理大鼠模型:大鼠适应性饲养1周,自由饮食,饲养温度(21±2)℃,湿度30%~70%,12 h/12 h光照周期。调整麻醉机气体总流量为2 L/min,对照组吸入40%氧气2 h,ISO1、ISO2、ISO3组大鼠首先吸入3%(体积分数)异氟醚,待夹尾反射消失后,分别调整异氟醚浓度为1.2%、1.8%、2.4%(均为体积分数),维持2 h,麻醉同时吸入40%氧气。麻醉结束后待大鼠自然苏醒。
1.3.2Morris水迷宫实验:大鼠苏醒24 h后进行5 d水迷宫实验。Morris水迷宫装置直径1.2 m、高0.5 m,并平均划分为四个象限,将平台置于第二象限中央,并低于水面2 cm,水温维持(22±4)℃。实验前将大鼠置于水迷宫装置熟悉环境,同时剔除不会游泳大鼠。前4 d进行定向航行实验:将大鼠从4个象限上不同的入水点放入水中,记录大鼠从水中寻找并爬上平台的时间即为逃避潜伏期(escape latency)。每只大鼠每天训练4次,每次间隔0.5 h。第5天进行空间探索实验:将平台撤除,将大鼠从第四象限入水点放入水中,记录大鼠在第二象限(原平台放置处)停留时间(总时间设定为1 min),即为空间探索时间。
1.3.3大鼠原代海马神经元分离、培养:具体方法见参考文献[9]。取8只初生的SD大鼠(孕鼠购自北京维通利华公司)分离两侧海马,将组织剪碎置于离心管,加入1.25 g/L胰酶于37℃、5%(体积分数)CO2培养箱消化20 min,然后加入含10%(体积分数)胎牛血清的DMEM培养基终止消化,离心(1000 r/min,5 min)洗涤2次。随后用200目筛网过滤,台盼蓝染色计数,将细胞水平调整为5×104个/mL并接种于包被有多聚赖氨酸的培养板上,培养于37℃、5%(体积分数)CO2培养箱中。培养3~5 d后加入终浓度为3 μg/mL的阿糖胞苷以抑制非神经细胞的增殖。此后,海马神经元培养于含10%(体积分数)马血清的DMEM培养基中,每周换液3次。培养2周后,采集海马神经元备用。将海马神经元随机分为对照组、异氟醚(ISO)组、对照腺病毒转染(Ad-GFP)+ISO组、Cav-1过表达腺病毒转染(Ad-Cav-1)+ISO组,每组样本数10。ISO组细胞于2.4%异氟醚环境中暴露2 h,Ad-GFP+ISO组和Ad-Cav-1+ISO组细胞分别转染腺病毒Ad-GFP和Ad-Cav-1后于2.4%异氟醚环境中暴露2 h,对照组细胞则添加等体积溶媒处理并置正常环境中培养。
1.3.4腺病毒过表达载体构建与转染:扩增Cav-1基因全长,内切酶BamHⅠ和SalⅠ双酶切后插入pDC315腺病毒质粒载体(重组pDC315-Cav-1质粒)。在脂质体的辅助作用下,pDC315-Cav-1重组质粒与腺病毒包装质粒共转染工具细胞HEK293。转染48 h后反复冻融收集腺病毒Ad-Cav-1,扩增并测序,鉴定重组腺病毒。海马神经元细胞异氟醚处理前48 h,将海马神经元细胞按照1×105/孔接种于六孔细胞培养板上转染腺病毒Ad-GFP或者Ad-Cav-1,转染复数均为150 MOI。转染24 h后,荧光显微镜观察细胞转染效率,同时利用Western blot检测Cav-1的相对表达量。
1.3.5荧光实时定量PCR(qRT-PCR)分析:利用Trizol试剂提取大鼠海马组织(异氟醚处理后第5天取大鼠海马组织)或海马神经元细胞总RNA(异氟醚处理后24 h收集细胞),cDNA反转录试剂盒合成cDNA第一链用作扩增模板。扩增体系:总体积20 μL,上、下游引物各0.5 μL,Fast SYBRTMGreen Master Mix 10 μL,模板 2 μL,ddH2O 7 μL。扩增条件:95℃ 2 min;94℃ 20 s,60℃ 20 s,40 个循环,溶解曲线温度 65~95℃。使用β-actin作为定量内参,根据PCR反应得出的循环阈值(cycle threshold value,Ct),由2-ΔΔCt公式计算目的基因相对表达量。本实验使用基因扩增引物有:Cav-1:上游引物5′-AGTGCATCAGCCGTGTCTAT-3′,下游引物5′-TCACGGCTGTGATAGCAACTT-3′;Cav-2:上游引物5′ -TTGGCCTTCATTGCGGGTAT-3′,下游引物5′-AGAGGAGAAGATGCGCCCTA-3′;Cav-3,上游引物5 ′-AGATCTGGAGGCACGGATCA-3′,下游引物5′-ACGCCATCGAAGCTGTAAGT-3′;β-actin,上游引物5′-GGCTCTATCCTGGCCTCACT-3′,下游引物5′ -GGTGTAAAACGCAGCTCAGTAA-3′。
1.3.6Western blot分析:异氟醚处理后第5天取大鼠海马组织,体外细胞经异氟醚处理后24 h收集海马神经元。将分离的大鼠海马组织和海马神经元细胞匀浆添加RIPA裂解液〔50 mmol/L Tris(pH 7.4)、150 mmol/L氯化钠、1%(质量浓度)Triton X-100、1%(质量浓度)去氧胆酸钠、0.1%(质量浓度)SDS、0.1 g/L PMSF〕提取总蛋白,利用Braford法测定蛋白浓度。取40 μg蛋白上样,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白。电泳结束后将蛋白通过湿法转移至聚偏氟乙烯膜(PVDF)上,将PVDF膜用5%(质量浓度)脱脂奶粉在室温下封闭2 h。TPBS漂洗3次,添加第一抗体在4℃中封闭过夜。第一抗体有Cav-1抗体(1∶800)、Cav-2抗体(1∶800)、Cav-3抗体(1∶800)、BDNF抗体(1∶1000)、ERK1/2抗体(1∶1000)、p-ERK1/2抗体(1∶1000)、TrkB抗体(1∶1000)、内参GAPDH抗体(1∶1000)。T-PBS漂洗3次,添加辣根过氧化物酶标记的兔抗小鼠第二抗体(1∶5000)于37℃孵育2 h,ECL试剂盒显影,利用Image J软件检测相对表达量。
1.3.7细胞存活检测:噻唑蓝法(MTT)检测神经细胞存活。将细胞按1×105个/孔接种于24孔细胞培养板,加入10%(体积分数)胎牛血清的DMEM培养液培养48 h,随后腺病毒Ad-Cav-1转染并经2.4%异氟醚处理后,分别于第1、2、3、4、5天进行MTT检测。每孔加入20 μL MTT(5 mg/mL)后培养 4 h。去掉上清,每孔150 μL加入二甲基亚砜(DMSO)。混匀后用酶标仪于490 nm波长下测定吸光度值。
1.4统计学处理采用SPSS13.0软件进行统计,符合正态性分布的计量资料以均数±标准差表示,多组均数比较采用单因素方差分析(one-way ANOVA),两两比较采用SNK-q检验。以P<0.05为差异具有统计学意义。
2 结果
2.1Morris水迷宫实验麻醉苏醒后第2、3天,ISO1、ISO2和ISO3组大鼠逃避潜伏期显著长于对照组(P<0.05);第4天,ISO2和ISO3组大鼠逃避潜伏期明显长于对照组和ISO1组(P<0.05);第1、5天,4组大鼠逃避潜伏期无统计学差异(P>0.05)。各组大鼠空间探索时间无统计学差异(P>0.05)。结果见表1。
2.2大鼠海马区CavmRNA表达4组大鼠海马区Cav-1、Cav-2、Cav-3 mRNA表达水平比较均有统计学差异(FCav-1=104.252,FCav-2=46.638,FCav-3=9.264,均P<0.01),且两两比较差异均有统计学意义(P<0.05)。见图1。

表1 各组大鼠麻醉苏醒后不同时间逃避潜伏期和空间探索时间比较(±s,s)
注:ISO1、ISO2、ISO3组:分别用异氟醚1.2%、1.8%、2.4%干预,图1~5同;与对照组比较,aP<0.05;与ISO1组比较,bP<0.05;与ISO2组比较,cP<0.05

注:Cav:小窝蛋白,图2、3、6、7同;与对照组比较,aP<0.05;与ISO1组比较,bP<0.05;与ISO2组比较,cP<0.05 图 1 荧光实时定量PCR检测各组大鼠海马区Cav mRNA相对表达量
2.3各组大鼠海马区Cav蛋白表达4组大鼠海马区Cav-1、Cav-2、Cav-3 蛋白表达水平比较均有统计学差异(FCav-1=111.279,FCav-2=45.608,FCav-3=69.854,均P<0.01),且两两比较差异均有统计学意义(P<0.05)。见图2、3。

注:GAPDH:甘油醛-3-磷酸脱氢酶,图4、6同 图 2 Western blot检测各组大鼠海马区Cav蛋白印迹条带图

注:与对照组比较,aP<0.05;与ISO1组比较,bP<0.05;与ISO2组比较,cP<0.05 图 3 Western blot检测各组大鼠海马区Cav蛋白相对表达量
2.4各组大鼠海马区BDNF、p-ERK1/2和TrkB表达各组大鼠海马BDNF、TrkB和p-ERK1/2蛋白表达水平比较均有统计学差异(FBDNF=20.593,FTrkB=38.544,Fp-ERK1/2=26.763,均P<0.01);与对照组比较,ISO1、ISO2和ISO3组大鼠BDNF、TrkB和p-ERK1/2蛋白表达降低(P<0.05)。而各组大鼠ERK1/2蛋白水平比较无统计学差异(F=1.052,P=0.305)。见图4、5。

注:BDNF:脑源性神经营养因子,TrkB:酪氨酸激酶受体B,ERK1/2:细胞外信号调节激酶1/2,p-ERK1/2:磷酸化细胞外信号调节激酶1/2;图5同 图 4 Western blot检测大鼠海马区BDNF、TrkB、ERK1/2和p-ERK1/2印迹条带图

注:与对照组比较,aP<0.05;与ISO1组比较,bP<0.05;与ISO2组比较,cP<0.05 图 5 Western blot检测大鼠海马区BDNF、TrkB、ERK1/2和p-ERK1/2蛋白相对表达水平
2.5过表达Cav-1拮抗异氟醚诱导的细胞活性抑制与对照组比较,异氟醚处理能够明显降低海马神经元的存活,并抑制细胞Cav-1的表达(F=229.593,P<0.01)。与ISO组及Ad-GFP组比较,Ad-Cav-1组细胞Cav-1的表达增加,细胞存活率升高(F2 d=6.798,F3 d=40.231,F4 d=88.646,F5 d=82.765,均P<0.01)。见图6~8。

注:ISO:异氟醚组,Ad-GFP+ISO:对照腺病毒转染+异氟醚组,Ad-Cav-1+ISO:Cav-1过表达腺病毒转染+异氟醚组;图7、8同 图 6 Western blot大鼠海马神经元Cav-1蛋白印迹条带图
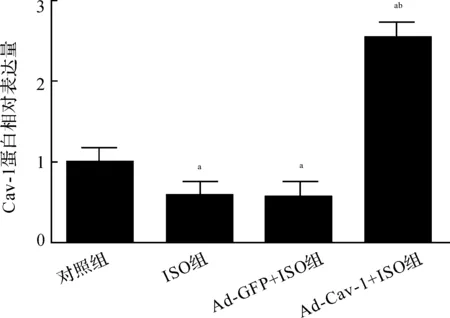
注:与对照组比较,aP<0.05;与Ad-GFP+ISO组比较,bP<0.05 图 7 Western blot检测大鼠海马神经元Cav-1相对表达量

注:与对照组比较,aP<0.05;与Ad-GFP+ISO比较,bP<0.05 图 8 大鼠海马神经元活性检测(MMT法)
3 讨论
异氟醚是临床上广泛使用的吸入性全身麻醉剂,但研究发现异氟醚对大脑海马神经元以及学习和记忆功能具有损害作用。因此阐明其作用机制对于制定相关临床规范、减轻其副作用具有重要意义。Morris水迷宫是观察动物模型学习和记忆功能损伤的常用经典实验装置[10]。本研究发现,尽管麻醉苏醒后第1天各组大鼠平均逃避潜伏期无统计学差异,但从第2天起,各异氟醚处理组大鼠的逃避潜伏期明显长于对照组,随着苏醒后时间的增加,至第5天各组大鼠平均逃避潜伏期比较差异无统计学意义,且各组大鼠的空间探索时间也无统计学差异,表明在1.2%至2.4%浓度下异氟醚对大鼠学习记忆能力的影响具有时效性;同时,在苏醒后第4天,低剂量异醚处理大鼠的平均逃避潜伏期与对照组相当,而明显短于另外两处理组,提示较低剂量的异氟醚对大鼠的影响也相对较小,大鼠学习能力恢复较快。
Zhou等[11]研究发现糖尿病大鼠空间记忆能力与海马区Cav-1的表达水平相关。海马神经元突触可塑性影响动物的空间学习能力[12],而Cav-1参与了海马神经元突触可塑性调节[13]。本实验在大鼠苏醒后24 h检测大鼠海马组织Cav-1、Cav-2和Cav-3 mRNA和蛋白的表达,尽管在此时间点检测大鼠学习记忆能力尚无统计学差异,然而细胞基因表达的变化通常对外界刺激反应较快。本实验即发现,在大鼠苏醒后24 h时间点,Cav-1、Cav-2和Cav-3 mRNA和蛋白水平均下调,表明异氟醚可作用于海马区组织,诱导小窝蛋白家族表达变化。既往研究发现异氟醚可作用于海马区神经元并影响突触可塑性[14],因此异氟醚的神经毒性作用可能与小窝蛋白有关。另有研究发现异氟醚能够促进新生大鼠海马组织p38和JNK的磷酸化而抑制ERK1/2磷酸化并诱导海马神经元凋亡[15-16]。本研究结果显示,与小窝蛋白家族表达变化相对应,异氟醚处理后大鼠海马区BDNF和TrkB的表达明显降低,信号蛋白ERK1/2蛋白表达总量未受到异氟醚影响,然而其活化蛋白p-ERK1/2表达水平明显降低,表明异氟醚具有抑制神经细胞或胶质细胞中ERK1/2信号的传导。小窝蛋白是细胞信号传导的重要介质,异氟醚是否通过小窝蛋白家族影响ERK1/2信号在海马神经元中的传导,尚需要进一步研究证实。
本研究体外实验结果显示,2.4%浓度异氟醚处理显著降低大鼠神经元的存活,同时下调Cav-1蛋白表达水平,进一步验证了异氟醚对神经元的细胞毒性作用。由于大鼠体内Cav-1的下调幅度大于Cav-2和Cav-3蛋白(2.4%浓度),因此本课题组利用Cav-1过表达腺病毒载体感染神经元细胞,验证Cav-1在大鼠海马神经元中的作用。结果发现Cav-1高表达的海马神经元细胞存活率高于对照转染细胞,证明Cav-1可拮抗异氟醚对神经元的毒性作用。
综上所述,本研究结果显示,异氟醚可影响大鼠学习记忆能力并降低海马区小窝蛋白的表达,过表达Cav-1可拮抗异氟醚的体外毒性作用。
[1]Jevtovic-Todorovic V. Good gas,bad gas:isoflurane,carbon monoxide,and which is which?[J]. Anesth Analg,2014,118(6):1160-1162.
[2]Quiroz-Padilla MF,Guillazo-Blanch G,Sanchez MY,et al. Effects of excitotoxic lesion with inhaled anesthetics on nervous system cells of rodents[J]. Curr Pharm Des,2017.Epub ahead of print.
[3]吕建鑫,张亚男,陶庆松,等. 小窝蛋白-1与乳腺癌相关性的研究进展[J]. 中华临床医师杂志(电子版),2012,6(9):2460-2463.
[4]Badaut J,Ajao DO,Sorensen DW,et al. Caveolin expression changes in the neurovascular unit after juvenile traumatic brain injury:signs of blood-brain barrier healing?[J]. Neuroscience,2015,285:215-226.
[5]Head BP,Hu Y,Finley JC,et al. Neuron-targeted caveolin-1 protein enhances signaling and promotes arborization of primary neurons[J]. J Biol Chem,2011,286(38):33310-33321.
[6]Gortazar AR,Martin-Millan M,Bravo B,et al. Crosstalk between caveolin-1/extracellular signal-regulated kinase(ERK)and beta-catenin survival pathways in osteocyte mechanotransduction[J]. J Biol Chem,2013,288(12):8168-8175.
[7]Wang S,Kan Q,Sun Y,et al. Caveolin-1 regulates neural differentiation of rat bone mesenchymal stem cells into neurons by modulating Notch signaling[J]. Int J Dev Neurosci,2013,31(1):30-35.
[8]Li X,Mcclellan ME,Tanito M,et al. Loss of caveolin-1 impairs retinal function due to disturbance of subretinal microenvironment[J]. J Biol Chem,2012,287(20):16424-16434.
[9]扈俊华,梁羽冰,覃怡,等. 右美托咪定预处理对丙泊酚孵育的大鼠海马神经元细胞活力的影响[J]. 临床麻醉学杂志,2013,29(5):488-490.
[10]刘鹏飞,胡艳婷,李天佐,等. 阿托伐他汀预处理对异氟醚麻醉小鼠认知功能的影响[J]. 中华麻醉学杂志,2017,37(9):1082-1086.
[11]Zhou H,Liu J,Ren L,et al. Relationship between [corrected] spatial memory in diabetic rats and protein kinase Cgamma,caveolin-1 in the hippocampus and neuroprotective effect of catalpol[J]. Chin Med J(Engl),2014,127(5):916-923.
[12]Zhu D,Li C,Swanson AM,et al. BAI1 regulates spatial learning and synaptic plasticity in the hippocampus[J]. J Clin Invest,2015,125(4):1497-1508.
[13]Liu Y,Liang Z,Liu J,et al. Downregulation of caveolin-1 contributes to the synaptic plasticity deficit in the hippocampus of aged rats[J]. Neural Regen Res,2013,8(29):2725-2733.
[14]Uchimoto K,Miyazaki T,Kamiya Y,et al. Isoflurane impairs learning and hippocampal long-term potentiation via the saturation of synaptic plasticity[J]. Anesthesiology,2014,121(2):302-310.
[15]Liao Z,Cao D,Han X,et al. Both JNK and P38 MAPK pathways participate in the protection by dexmedetomidine against isoflurane-induced neuroapoptosis in the hippocampus of neonatal rats[J]. Brain Res Bull,2014,107:69-78.
[16]王飞,李玉娟,曾敏婷,等. 右美托咪定通过抑制p38和JNK活化减少异氟醚诱导的新生大鼠海马神经元凋亡[J]. 中国病理生理杂志,2013,29(9):1651-1656.
