α疱疹病毒ICP4的转录调控机制
2018-05-28,,
,,
疱疹病毒(Alphaherpesvirus)是一类具有相同形态学且具有囊膜的双链DNA病毒,已知有120多种,成熟的病毒粒子由核心(core)、衣壳(capsid)、皮层(tegument)和囊膜(envelope)4个部分组成[1],按其理化性质可划分为α、β、γ 3个亚科。疱疹病毒感染的宿主范围广,可以感染人类和其他脊椎动物[2-4]。而α疱疹病毒感染后随着基因表达时序的不同,分为立即早期(IE)基因、早期(E)基因和晚期(L)基因,其中IE基因调控着E基因和L基因的表达。目前在1型人单纯疱疹病毒(Herpes simplex virus 1,HSV-1)中已发现了5个IE基因,包括ICP0、ICP4、ICP22、ICP27和ICP47, 而ICP4编码的蛋白质为病毒基因表达和复制所必需,为最重要的IE基因,它不仅对病毒的E基因和L基因有转录激活的作用,同时,在某些特殊条件也下发挥着转录抑制的作用。
1 ICP4的结构特点
α疱疹病毒基因组由特定长区(UL)和特定短区(US)两个共价结合的片段组成,每一区域两侧都与反向重复序列相连,其中,UL和US之间的重复序列为内部重复序列(IR),而整个基因组两端的重复序列为末端重复序列(TR)[5]。ICP4基因在病毒基因组的2个重复序列区域——IR和TR分别有一个拷贝,是α疱疹病毒中仅有的2个双拷贝基因之一。
在HSV-1中,ICP4表达产物是一个大小为175 kDa的蛋白,具有基因表达调控蛋白所具有的螺旋-转角-螺旋(helix-turn-helix)结构[6]并以二聚体的形式存在[7]。ICP4和许多其他的转录因子一样,拥有几个功能区域:DNA结合区域、核定位区域以及两个反式激活区域[8],这些功能区域赋予了ICP4多种功能。Deluca[9-10]等通过构建ICP4不同区域缺失的突变体来探究ICP4的功能域,其中只表达N端251个氨基酸的突变体既没有激活功能也没有抑制作用,可见N端对调控转录的重要性;通过比较缺失ICP4不同区域的突变体在宿主细胞内的表达位置确定了ICP4核定位功能域为641-774位氨基酸。Shepard[11]等通过构建细胞系和基因缺失的方法证明,缺失31-274位氨基酸的ICP4可结合到DNA上但不能调控任何类型基因的转录;如果结合DNA的区域缺失,ICP4的调控能力也会受到极大的影响。
ICP4蛋白的N末端和C末端共同调控着基因的表达且N端对ICP4的功能影响更大,缺失N端50~100位氨基酸所产生的影响比缺失整个C端的500个氨基酸影响大[12],而N端30~210位氨基酸影响ICP4与TFIID的相互作用[13],该区域缺失后会影响RNA聚合酶II对转录因子的招募;N端还促进前起始复合物(Pre-Initiation Complex,PIC)的形成。C端在启动L基因启动子及L基因与转录因子形成转录复合物时发挥作用,故C端的缺失对L基因的表达有极大影响,但对E基因的表达影响较小[14];此外,ICP4蛋白在病毒DNA上多聚化需要C端参与,增加ICP4对DNA的亲和力[15]。
2 ICP4的定位
病毒感染的早期,ICP4分散在细胞核的核质中;病毒感染的晚期,ICP4则分布在细胞核中的球状结构[16]。而Kalamvoki M等研究发现,缺失gE、gI或UL41的HSV突变株感染细胞后,胞质中也有ICP4的存在[17];此外,ICP27也会影响到ICP4在细胞中的定位[18]。这说明,ICP4在细胞中的分布与其他蛋白有关。
ICP4是病毒粒子的组分之一,Suzanne M等通过比较HSV-1亲本株与ICP4缺失株病毒粒子的蛋白成分差异,发现亲本株病毒粒子中含有ICP4蛋白而缺失株病毒粒子中没有ICP4蛋白,证明了ICP4确实是病毒内部成分[19]。Everett的研究表明ICP4在病毒感染早期时还会结合在基因组上形成病毒核蛋白,以进入病毒的复制中心[20]。
3 ICP4转录激活作用
在宿主细胞RNA聚合酶II(RNA Polymerase II,RNA POL II)介导的疱疹病毒基因转录过程中,转录调控因子IID(Transcription factor II D,TFIID)含有能识别TATA框的TATA结合蛋白(TATA-binding protein,TBP)而对病毒基因的启动子进行识别[21]。Sampath等对HSV-1研究表明,只有在ICP4与tk和gC启动子结合后,TBP和RNA POLII才能结合到tk和gC基因的启动子上[14],表明ICP4对于病毒E基因和L基因的启动子与其他转录因子形成转录复合物至关重要。RNA POLII介导的转录中需要TFIID和中介体(Mediator)的参与,在病毒感染期间,ICP4不仅与TFIID相互作用,还会与中介体相互作用[22],中介体在影响RNA POLII转录机制上起着重要的作用,它通过促进RNA POL II加入PIC以建立上游激活剂和普通转录机制之间的桥梁,其中,PIC主要由一般转录因子(General transcription factors,GTFs)和RNA POL II构成,且PIC的形成是RNA POL II转录机制形成的先决条件[23]。Lauren M等在对ICP4与TFIID结合的研究中发现,ICP4会和TFIID中的一系列TBP连接因子(TBP-associated factors,TAFs)结合,这些结合的TAFs复合物在整个病毒感染过程中都会被检测到,而ICP4与中介体的结合只会在随后被检测到[24](图1A)。
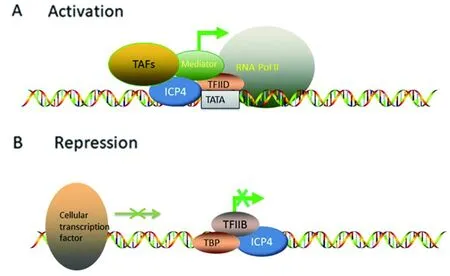
A. ICP4在发挥激活功能时,会和RNA聚合酶II、中介体(Mediator)、TFIID和TAFs共同作用;B.ICP4在发挥抑制转录的功能时,与DNA上的特异性序列结合并与TBP和TFIIB形成TPC。而随着病毒感染过程的推进,由其他细胞转录因子所介导的转录将会因为E蛋白和L蛋白的增多而受到影响。图1 ICP4转录调控机制[28-29]Fig.1 Transcriptional regulation mechanism of ICP4[28-29]
ICP4蛋白激活E基因和L基因的机制是不同的,且涉及的转录因子也不一样。在HSV-1中,ICP4与TFIID、TFIIA等转录因子以及RNA POL II共同进行E基因转录的调控,其中,ICP4加强了TFIIA使TBP稳定结合TATA框的能力;而HSV-1的L基因具有启动子元件(initiator elements,INRs),该元件的存在使L基因的转录调控并不需要TFIIA的参与,且ICP4能够代替TFIIA使TFIID稳定结合在L基因上[14,25-26]。
在调控转录过程中,ICP4在DNA上多聚化使其与DNA的亲和力增加,从而可与DNA更好地结合[15],但它与被激活转录的基因启动子DNA不需要高度特异性的结合。Smiley等将缺失了gD基因启动子上游与转录起始位点下游的ICP4特异性结合位点的突变株感染细胞后发现,gD基因的转录几乎没有受到影响[27]。
4 ICP4的转录抑制功能
α疱疹病毒ICP4对自身、LAT(Latency Assciatited Transcript,LAT)及L/STs(L/S junction-spanning transcripts,L/STs)转录可产生抑制作用,在ICP4转录激活调控的过程中不需要与DNA上的特异性序列结合,但发挥转录产生抑制作用时,其与DNA上的特异性序列结合却是必不可少的条件,ICP4与DNA上的特异性序列结合时,亲和力极高,这段特异性序列为ATCGTCNNNNYCGRC(R代表嘌呤,Y代表嘧啶,N代表任意碱基)。此外,ICP4抑制自身基因启动子的转录和其与DNA的结合位点接近TATA框和转录起始位点有关,ICP4的抑制功能主要受制于ICP4-DNA结合位点与TATA框的距离[30]。虽然在E基因和L基因的启动子上也有和ICP4蛋白亲和力比较高的位点,但这些位点并不在转录起始位点,所以不会被抑制。
ICP4与TBP和TFIIB形成三元复合物(tripartite complex,TPC)并与调控基因的DNA结合而发挥转录抑制作用,不能形成TPC的ICP4突变体是不能进行转录抑制调控的[31-32]。ICP4除了抑制其本身、LAT与L/ST的转录外,其他IE基因也会随着ICP4蛋白表达的增加而被抑制转录,然而其他IE基因并没有ICP4抑制的结合位点,但具有其他细胞转录因子结合位点,比如SP1,它的激活能力会随着病毒感染的进程而减弱,从而影响其他IE基因的转录[33](图1B)。
5 ICP4与病毒潜伏感染
α疱疹病毒在入侵宿主细胞后,可在神经节细胞内形成潜伏性感染,逃避宿主巨噬细胞、自然杀伤细胞及干扰素杀伤作用的自然防御系统,在病毒潜伏的过程中没有完整的基因组复制,仅有小部分基因进行了转录。当宿主抵抗力下降之后,病毒在神经节和相邻的神经组织内复制。
LAT是HSV-1在潜伏期间唯一大量存在和转录的RNA,在潜伏感染的建立、维持及激活中扮演着重要的角色;同时,在HSV-1潜伏感染期间也能检测到ICP4的RNA[34]。LAT的启动子上具有ICP4高度特异性的结合位点,该位点对ICP4发挥转录调控作用至关重要,当ICP4与LAT的特异性结合位点结合后,可抑制LAT的转录;ICP4不仅可抑制LAT,还可抑制LAT所编码的靶向ICP0、ICP34.5的miRNAs[35],其中ICP0在HSV-1由潜伏感染进入裂解性感染的过程中起到重要作用[36],进一步证明ICP4对维持潜伏是必要的。此外,在HSV-1由潜伏状态进入激活状态时,ICP4会和HSV-1的其它miRNAs相互作用,如miR-H6会抑制ICP4蛋白的表达而影响HSV-1的潜伏[37-38]。最近,Maroui Ma的研究发现ICP4和ICP0对包含HSV-1 DNA的早幼粒细胞白血病(Promyelocytic leukemia,PML)核小体(Viral DNA-containing PML nuclear bodies,vDCP-NBs)的形成有重要作用,而vDCP-NBs与病毒基因组的潜伏感染时的主要表现形式相关[39]。
6 ICP4的其他功能
除了调控病毒基因转录和介导病毒潜伏感染外,ICP4还具有许多其他功能。例如,miR-101是Hela细胞编码的一种miRNA,可影响HSV-1的复制[40],而ICP4会介导miR-101表达从而抑制HSV-1的复制[41]。此外,Dembowski JA的研究还发现,ICP4可能还会影响重要的染色质重塑细胞因子的招募[42]。
ICP4和细胞凋亡也有一定的关联,HSV-1诱导细胞凋亡的的功能可被病毒自身的某些蛋白抑制[43]。Leopardi研究表明,ICP4具有抗凋亡功能,是抑制HSV-1诱导凋亡的因素之一[44];PirittaPeri也发现,ICP4和US3缺失的HSV-1感染U937细胞会出现大量凋亡和坏死性凋亡现象[45]。
ICP4还能对宿主细胞中的一些因子进行转录调控,血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)是导致感染HSV-1复发性角膜疾病的因素之一,ICP4可以调控VEGF-A的转录而促进新血管的广泛生成,从而导致复发性角膜疾病,其机制是VEGF-A启动子中含有和病毒E基因启动子中一样的顺式CG框,ICP4得以进行转录调控[46]。
HSV的ICP4对人免疫缺陷病毒(human immunodeficiency virus,HIV)感染后在CD4+淋巴细胞中的复制也会产生影响,Albrecht M A 将标记的HIV分别与HSV 亲本株、ICP0缺失株、ICP4缺失株和ICP27缺失株病毒共同感染CEM细胞,发现HIV和ICP4缺失病毒株共感染时,HIV不能复制,而和其他的毒株共感染时却可以复制,说明ICP4会增强HIV在人CD4+淋巴细胞中的复制[47]。
7 ICP4与其他蛋白互作
ICP4可以与许多其他病毒蛋白相互作用对彼此的表达及作用产生影响。Liu M等报道了ICP0和ICP4在病毒感染细胞中的直接相互作用,ICP4可以抑制ICP0的转录,而ICP0也要拮抗ICP4的抑制[48]。在缺失ICP0的情况下,敲低干扰素诱导蛋白(Nuclear Interferon (IFN)-Inducible Protein 16,IFI16),ICP4的表达会增加[49]。ICP4和 ICP0还会协同诱导E基因和L基因的转录[50]。此外,UL21蛋白的累积会延迟ICP4蛋白的合成[51];被膜蛋白UL7的突变也会减少ICP4的转录,进而减弱HSV-1的毒力[52]。ICP27对ICP4的抑制功能具有调节作用,在缺少ICP27的情况下,ICP4对L/ST启动子的抑制作用有所下降[53];而在感染了ICP27突变株的细胞中,核内包含着ICP4蛋白的病毒复制结构无法形成,取而代之的是小指环状的结构[54]。
8 展 望
ICP4是α疱疹病毒中一个必需蛋白,在激活病毒E和L基因的转录、表达和调控病毒的潜伏感染等方面具有重要作用,目前对HSV-1 ICP4的研究较为深入且集中于功能域对转录调控产生的作用、与其他蛋白及宿主细胞因子之间的相互作用以及与DNA结合的模式等方面,而对α疱疹病毒亚科其他成员的ICP4的研究资料相对缺乏,今后应将研究重点放在ICP4对潜伏感染的调控及与细胞凋亡的关系等方面。
参考文献:
[1] Guo Y, Cheng A, Wang M, et al. Purification of anatid herpesvirus 1 particles by tangential-flow ultrafiltration and sucrose gradient ultracentrifugation[J]. J Virol Methods, 2009, 161(1): 1-6. DOI:10.1016/j.jviromet.2008.12.017
[2] Dunn JR, Auten K, Heidari M, et al. Correlation between Marek’s disease virus pathotype and replication[J]. Avian Dis, 2014, 58(2): 287-292. DOI:10.1637/10678-092513-Reg.1
[3] Tombácz D, Csabai Z, Oláh P, et al. Characterization of novel transcripts in pseudorabies virus[J]. Viruses, 2015, 7(5): 2727-2744. DOI:10.3390/v7052727
[4] Khalil MI, Che X, Sung P, et al. Mutational analysis of varicella-zoster virus (VZV) immediate early protein (IE62) subdomains and their importance in viral replication[J]. Virology, 2016, 492: 82-91. DOI:10.1016/j.virol.2016.02.012
[5] Wu Y, Cheng A, Wang M, et al. Complete genomic sequence of Chinese virulent duck enteritis virus[J]. J Virol, 2012, 86(10): 5965. DOI:10.1128/JVI.00529-12
[6] Wyrwicz L S, Rychlewski L. Fold recognition insights into function of herpes ICP4 protein[J]. Acta Biochim Pol, 2007, 54(3): 551-559.
[7] Metzler DW, Wilcox KW. Isolation of herpes simplex virus regulatory protein ICP4 as a homodimeric complex[J].J Virol, 1985, 55(2): 329-337.
[8] Paterson T, Everett RD. The regions of the herpes simplex virus type 1 immediate early protein Vmw175 required for site specific DNA binding closely correspond to those involved in transcriptional regulation[J]. Nucleic Acids Res, 1988, 16(23): 11005.
[9] Deluca NA, Schaffer PA. Physical and functional domains of the herpes simplex virus transcriptional regulatory protein ICP4[J].J Virol, 1988, 62(3): 732-743.
[10] Deluca NA, Schaffer PA. Activities of herpes simplex virus type 1 (HSV-1) ICP4 genes specifying nonsense peptides[J].Nucleic Acids Res, 1987, 15(11): 4491-4511.
[11] Shepard AA, Tolentino P, Deluca NA. trans-dominant inhibition of herpes simplex virus transcriptional regulatory protein ICP4 by heterodimer formation[J].J Virol, 1990, 64(8): 3916.
[12] Wagner LM, Lester JT, Sivrich FL, et al. The N terminus and C terminus of herpes simplex virus 1 ICP4 cooperate to activate viral gene expression[J]. J Virol, 2012, 86(12): 6862-6874. DOI:10.1128/JVI.00651-12
[13] Wagner LM, Bayer A, Deluca NA. Requirement of the N-terminal activation domain of herpes simplex virus ICP4 for viral gene expression[J].J Virol, 2013, 87(2): 1010-1018. DOI:10.1128/JVI.02844-12
[14] Sampath P, Deluca NA. Binding of ICP4, TATA-binding protein, and RNA polymerase II to herpes simplex virus type 1 immediate-early, early, and late promoters in virus-infected cells[J].J Virol, 2008, 82(5): 2339-2349. DOI:10.1128/JVI.02459-07
[15] Kuddus RH, Deluca NA. DNA-dependent oligomerization of herpes simplex virus type 1 regulatory protein ICP4[J].J Virol, 2007, 81(17): 9230-9237. DOI:10.1128/JVI.01054-07
[16] Knipe DM, Senechek D, Rice SA, et al. Stages in the nuclear association of the herpes simplex virus transcriptional activator protein ICP4[J].J Virol, 1987, 61(2): 276-284.
[17] Kalamvoki M, Qu J, Roizman B. Translocation and colocalization of ICP4 and ICP0 in cells infected with herpes simplex virus 1 mutants lacking glycoprotein E, glycoprotein I, or the virion host shutoff product of the UL41 gene[J].J Virol, 2008, 82(4): 1701-1713. DOI:10.1128/JVI.02157-07
[18] Sedlackova L, Rice SA. Herpes simplex virus type 1 immediate-early protein ICP27 is required for efficient incorporation of ICP0 and ICP4 into virions[J].J Virol, 2008, 82(1): 268-277. DOI:10.1128/JVI.01588-07
[19] Pritchard SM, Cunha CW, Nicola AV. Analysis of herpes simplex virion tegument ICP4 derived from infected cells and ICP4-expressing cells[J]. PloS One, 2013, 8(8): e70889. DOI:10.1371/journal.pone.0070889
[20] Everett RD, Sourvinos G, Orr A. Recruitment of herpes simplex virus type 1 transcriptional regulatory protein ICP4 into foci juxtaposed to ND10 in live, infected cells[J].J Virol, 2003, 77(6): 3680-3689. DOI:10.1128/JVI.77.6.3680-3689.2003
[21] Tora L, Timmers HTM. The TATA box regulates TATA-binding protein (TBP) dynamicsinvivo[J]. Trends Biochem Sci, 2010, 35(6): 309-314. DOI:10.1016/j.tibs.2010.01.007
[22] Deluca JTL, Neal A. Herpes simplex virus 1 ICP4 forms complexes with TFIID and mediator in virus-infected cells[J].J Virol, 2011, 85(12): 5733-5744. DOI:10.1128/JVI.00385-11
[23] Thomas MC, Chiang CM. General Cofactors: TFIID, mediator and USA[M]. New York Springer, 2006: 67-94. DOI:10.1007/978-0-387-40049-5_4
[24] Deluca LMW, Neal A. Temporal association of herpes simplex virus ICP4 with cellular complexes functioning at multiple steps in PolII transcription[J]. PloS One, 2013, 8(10): 65-65. DOI:10.1371/journal.pone.0078242
[25] Smith CA, Bates P, Riveragonzalez R, et al. ICP4, the major transcriptional regulatory protein of herpes simplex virus type 1, forms a tripartite complex with TATA-binding protein and TFIIB[J].J Virol, 1993, 67(8): 4676.
[26] Zabierowski SE, Deluca NA. Stabilized binding of TBP to the TATA box of herpes simplex virus type 1 early (tk) and late (gC) promoters by TFIIA and ICP4[J].J Virol, 2008, 82(7): 3546. DOI:10.1128/JVI.02560-07
[27] Smiley JR, Johnson DC, Pizer LI, et al. The ICP4 binding sites in the herpes simplex virus type 1 glycoprotein D (gD) promoter are not essential for efficient gD transcription during virus infection[J]. J Virol, 1992, 66(2): 623-631.
[28] Deluca NA. Functions and mechanism of action of the herpes simplex virus regulatory protein, ICP4[J]. Caister Acad Press,2011,64(7): 17-38.
[29] Gruffat H, Marchione R, Manet E. Herpesvirus late gene expression: a viral-specific pre-initiation complex is key[J]. Front Microbiol, 2016, 7(e1001114): 869. DOI:10.3389/fmicb.2016.00869
[30] Leopardi R, Michael N, Roizman B. Repression of the herpes simplex virus 1 alpha 4 gene by its gene product (ICP4) within the context of the viral genome is conditioned by the distance and stereoaxial alignment of the ICP4 DNA binding site relative to the TATA box[J]. J Virol, 1995, 69(5): 3042-3048.
[31] Kuddus R, Gu B, Deluca NA. Relationship between TATA-binding protein and herpes simplex virus type 1 ICP4 DNA-binding sites in complex formation and repression of transcription[J]. J Virol, 1995, 69(9): 5568-5575.
[32] Smith CA, Bates P, Riveragonzalez R, et al. ICP4, the major transcriptional regulatory protein of herpes simplex virus type 1, forms a tripartite complex with TATA-binding protein and TFIIB[J]. J Virol, 1993, 67(8): 4676-4687.
[33] Kim DB, Deluca NA. Phosphorylation of transcription factor Sp1 during herpes simplex virus type 1 infection[J]. J Virol, 2002, 76(13): 6473-6479. DOI:10.1128/JVI.76.13.6473-6479.2002
[34] Kramer MF, Coen DM. Quantification of transcripts from the ICP4 and thymidine kinase genes in mouse ganglia latently infected with herpes simplex virus[J]. J Virol, 1995, 69(3): 1389-1399.
[35] Tang S, Patel Akrause PR. Novel less-abundant viral microRNAs encoded by herpes simplex virus 2 latency-associated transcript and their roles in regulating ICP34.5 and ICP0 mRNAs[J]. J Virol, 2009, 83(3): 1433-1442. DOI:10.1128/JVI.01723-08
[36] Smith MC, Boutell C, Davido DJ. HSV-1 ICP0: paving the way for viral replication[J]. Future Virol, 2011, 6(4): 421-429. DOI:10.2217/fvl.11.24
[37] Duan F, Liao J, Huang Q, et al. HSV-1 miR-H6 inhibits HSV-1 replication and IL-6 expression in human corneal epithelial cells in vitro[J]. Clin Dev Immunol, 2012, 2012(6): 121-129. DOI:10.1155/2012/192791
[38] Umbach JL, Kramer MF, Jurak I, et al. MicroRNAs expressed by herpes simplex virus 1 during latent infection regulate viral mRNAs[J]. Nature, 2008, 454(7205): 780-783.DOI:10.1038/nature07103
[39] Ali MM, Aleth C, Camille C, et al. Latency entry of herpes simplex virus 1 is determined by the interaction of its genome with the nuclear environment[J]. PLoS Pathog, 2016, 12(9): e1005834. DOI:10.1371/journal.ppat.1005834
[40] Zheng SQ, Li YX, Zhang Y, et al. MiR-101 regulates HSV-1 replication by targeting ATP5B[J]. Antiviral Res, 2011, 89(3): 219-226. DOI:10.1016/j.antiviral.2011.01.008
[41] Wang X, Diao C, Yang X, et al. ICP4-induced miR-101 attenuates HSV-1 replication[J]. Sci Rep, 2016, 6: 23205. DOI:10.1038/srep23205
[42] Dembowski JA, Deluca NA. Selective recruitment of nuclear factors to productively replicating herpes simplex virus genomes[J]. PLoS Pathog, 2015, 11(5): e1004939. DOI:10.1371/journal.ppat.1004939
[43] You Y, Cheng AC, Wang MS, et al. The suppression of apoptosis by α-herpesvirus[J]. Cell Death Dis, 2017, 8(4): e2749. DOI:10.1038/cddis.2017.139
[44] Leopardi R, Roizman B. The herpes simplex virus major regulatory protein ICP4 blocks apoptosis induced by the virus or by hyperthermia[J]. Proc Natl Acad Sci U S A, 1996, 93(18): 9583.
[45] Peri P, Nuutila K, Vuorinen T, et al. Cathepsins are involved in virus-induced cell death in ICP4 and Us3 deletion mutant herpes simplex virus type 1-infected monocytic cells[J]. J Gen Virol, 2011, 92(1): 173-180. DOI:10.1099/vir.0.025080-0
[46] Wuest T, Zheng M, Efstathiou S, et al. The herpes simplex virus-1 transactivator infected cell protein-4 drives VEGF-A dependent neovascularization[J]. PLoS Pathog, 2011, 7(10): 515-534. DOI:10.1371/journal.ppat.1002278
[47] Albrecht MA, Deluca NA, Byrn RA, et al. The herpes simplex virus immediate-early protein, ICP4, is required to potentiate replication of human immunodeficiency virus in CD4+ lymphocytes[J]. J Virol, 1989, 63(63): 1861-1868.
[48] Liu M, Rakowski B, Gershburg E, et al. ICP0 antagonizes ICP4-dependent silencing of the herpes simplex virus ICP0 gene[J]. Plos One, 2010, 5(1): 8837.DOI:10.1371/journal.pone.0008837
[49] Orzalli MH, Conwell SE, Berrios C, et al. Nuclear interferon-inducible protein 16 promotes silencing of herpesviral and transfected DNA[J]. Proc Natl Acad Sci U S A, 2013, 110(47): 4492-4501. DOI:10.1073/pnas.1316194110
[50] Muller MT. Binding of the herpes simplex virus immediate-early gene product ICP4 to its own transcription start site[J]. J Virol, 1987, 61(3): 858-865.
[51] Mbong EF, Woodley L, Frost E, et al. Deletion of UL21 causes a delay in the early stages of the herpes simplex virus 1 replication cycle[J]. J Virol, 2012, 86(12): 7003-7007. DOI:10.1128/JVI.00411-12
[52] Xu X, Fan S, Zhou J, et al. The mutated tegument protein UL7 attenuates the virulence of herpes simplex virus 1 by reducing the modulation of α-4 gene transcription[J]. Virol J, 2016, 13(1): 152.DOI:10.1186/s12985-016-0600-9
[53] Samaniego LA, Webb AL, Deluca NA. Functional interactions between herpes simplex virus immediate-early proteins during infection: gene expression as a consequence of ICP27 and different domains of ICP4[J]. J Virol, 1995, 69(9): 5705-5715.
[54] Rojas S, Corbinlickfett KA, Escuderopaunetto L, et al. ICP27 phosphorylation site mutants are defective in herpes simplex virus 1 replication and gene expression[J]. J Virol, 2010, 84(5): 2200-2211. DOI:10.1128/JVI.00917-09
