维氏气单胞菌最新研究进展
2018-05-28,,,,,,
,,,,,,
近年来,国内外有关维氏气单胞菌(Aeromonasveronii,A.veronii)病例的报道逐年增多,其流行呈明显上升趋势,A.veronii已成为一种重要的人、兽及水生生物共患病原菌。目前,A.veronii在食品安全上也表现出重要的意义,研究表明污染的畜禽肉类、水产品和蔬菜等均是A.veronii的重要传染源,因此一些国家已把A.veronii及其同属菌作为水体质量和食品安全的检疫对象[1-2];A.veronii不但可以感染包括鱼类在内的水生动物,也可感染包括人在内的哺乳动物,引起人类胃肠炎、腹膜炎、脑膜炎、败血症和外伤感染等,给水产养殖业造成巨大经济损失的同时也严重威胁着人类的健康[3-4]。本课题组先前对A.veronii的相关研究进展进行过综述,但考虑到近年来有关A.veronii的研究逐渐增多,因此本文对A.veronii的病原学、临床特征、国内外流行现状以及致病机理的最新研究进展进行概述,旨在为该菌的防治提供参考。
1 维氏气单胞菌概述
1.1维氏气单胞菌 气单胞菌属(Aeromonas)是一类革兰阴性兼性厌氧杆菌,其对环境具有较强的适应性,广泛存在于环境中特别是淡水和河口等环境[5]。目前,Aeromonas属共有27个种,主要包括两大类,一类是非运动性嗜冷气单胞菌,最适生长温度为22 ℃~25 ℃,如杀鲑气单胞菌(A.salmonicida);另一大类是运动性嗜温气单胞菌,最适生长温度是28 ℃~37 ℃,如嗜水气单胞菌(A.hydrophila)和维氏气单胞菌(A.veronii)等[6]。以A.salmonicida为代表的嗜冷性气单胞菌对水产养殖业危害巨大,特别是对鲑鱼,可引起鲑鱼以及一些重要经济鱼种(如大菱鲆和鳕鱼等)的感染性菌血症和溃疡性疾病;相较于嗜冷性气单胞菌,嗜温性气单胞菌的危害更为严重,特别是A.hydrophila,A.veronii以及豚鼠气单胞菌(A.caviae),有研究表明目前临床上分离到的气单胞菌85%以上是这3种菌[7]。
A.veronii又包括2个生物型,即温和生物型(A.veroniibiovarsobria)和维罗纳生物型(A.veroniibiovarveronii),其中A.veroniibiovarsobria致病性较强且危害较大[8]。近年来,越来越多的病例表明A.veronii已成为一种重要的人、兽及水生生物共患病原菌,其不但可感染鱼类、两栖动物和爬行动物,也可感染包括人在内哺乳动物,特别是老年人、儿童及免疫力低下的人群,不仅给水产养殖业造成了巨大经济损失,同时也严重威胁着人类的健康[3-4]。
1.2临床特征A.veronii不但可以感染水生生物而且可以感染包括人在内的哺乳动物,严重的可以引起死亡。A.veronii在环境中广泛存在,特别是水体环境,而且在夏、秋两季其繁殖最快,免疫力降低或体表有创伤的水生生物更容易感染A.veronii,严重时可以引起较高的死亡率。A.veronii可感染多种水生生物,症状也各有差异,但主要以皮肤溃疡或溃烂,脏器出血和严重腹水等症状为主。相关研究表明,A.veronii可引起鲤鱼、罗非鱼、鲈鱼、鲫鱼、鲶鱼和西伯利亚鲟鱼的出血性败血症,主要表现为体表及脏器不同程度的出血和充血等[9-10];鲤鱼和鲈鱼的红肿病,病鱼的腹部出现红斑,肛门红肿等[11-12];鲶鱼、鳕鱼、鲤鱼和虾虎鱼的溃疡性感染,病鱼体表鳞片脱落,出现溃疡,严重者出现溃烂[13-14];此外,A.veronii也可感染一些特殊的水生生物,国内相关研究表明A.veronii也可引起大鲵的皮肤腐烂;中华绒螯蟹的发病及死亡;泥鳅体表的出血和溃烂;斑点叉尾鮰的皮肤溃烂,脏器肿胀和出血,腹腔积水,严重的可造成大面积死亡;黄颡鱼的“溃疡综合征”,主要表现为体表溃疡和溃烂;青虾的“软壳综合征”,主要表现为掉肢、软壳以及肌肉水肿等[15-20]。本实验室通过人工腹腔和肌肉接种A.veronii感染锦鲤和锦鲫,发现症状较轻者表现为游动缓慢、食欲不振以及皮肤溃疡等,严重的表现为肌肉溃烂、脏器肿胀、脏器出血、肠道充血以及严重腹水,直至死亡。
A.veronii对人类引起的感染主要包括胃肠道感染,伤口和软组织感染以及败血症等[7]。临床分离到的大部分A.veronii都来源于胃肠炎病例,在其它感染中,创伤和皮肤软组织感染以及败血症最为常见,其中以创伤和皮肤软组织感染为主,其次是败血症。遭受外伤的人通常更容易感染A.veronii,接触含有A.veronii的水和土壤会增加感染的概率;A.veronii还可增加免疫力低下者罹患败血症的风险,最常见的症状是腹泻、胸痛和发烧等;此外,也会引发免疫功能低下者溶血性尿毒综合症,尿路感染以及脑膜炎等[3-4]。总之,胃肠炎是A.veronii感染最为常见的症状,特别是对于老年人、儿童及免疫功能低下的人群,此外,A.veronii也是引起旅行者腹泻的主要原因之一[21]。
2 维氏气单胞菌国内外流行现状
1983年法国微生物学家首次从溺亡者的呼吸道分泌物中分离到A.veronii,后来又在患者的伤口和血液中分离到该菌[22];在国内,则由崔树玉等[23]在1989年首次从黑鱼(乌鳢)体内分离到A.veronii。近年来,国内外有关A.veronii病例的报道逐渐增多,其流行呈明显的上升趋势且危害也越来越严重。
目前,在国外特别是发达国家有关A.veronii病例的报道多集中在公共健康领域,相比于A.hydrophila,A.veronii对发达国家的水产养殖业造成的危害相对较小,但在某些养殖场的水生生物体内也分离到了A.veronii,而且检测发现这些A.veronii携带众多毒力因子,耐药性也在逐渐增强,对公共健康和水产养殖业的健康发展具有潜在的威胁。2011年西澳大利亚大学Aravena等对144个临床样本(54个伤口感染样本,33个血液样本,34个粪便样本和23个混合样本)进行了检测,其中49株A.veronii,占比很大[24];2012年Kimura等对东京某医院收集的36例Aeromonas相关病例进行了检测,发现病原主要包括A.caviae,A.hydrophila和A.veronii,其中A.veronii占比13.9%[25];2014年Esteve等收集了来自西班牙瓦伦西亚市区河流,鱼体以及临床样本的185株Aeromonas,并对其进行了分析,其中A.veronii占19.5%,分离菌株对小鼠有中等毒力且耐药性有所增强[26];2016年Sinclair等对澳大利亚昆士兰临床微生物实验室在2012年至2014年间收集的临床样本进行分析,获得100株Aeromonas,其中21株为A.veronii,均携带抗碳青霉烯类抗生素的碳青霉烯酶基因[27];这表明A.veronii对公共健康的威胁越来越大。此外,A.veronii对欠发达国和发展中国家而言不但威胁公共健康,而且对水产养殖业的危害也较大,这可能与各国的养殖模式和管理水平有关。2007年5月至2008年4月斯里兰卡某淡水观赏鱼养殖场暴发疾病,症状主要表现为皮肤溃疡、出血、翅片腐烂、眼球突出以及腹部肿胀等,Jagoda等从患病鱼体内分离到53株Aeromonas,其中A.veronii为优势菌株占79.2%[28];Uzun等对2009年至2011年间收集的土耳其黑海附近的两个鲈鱼养殖场的鲈鱼,进行细菌性病原发生频率的分析,发现A.veronii是最为普遍的病原占65.2%[29]; 2012年Puthucheary等从马来西亚大学医院收集的病人血液、脓液、尿液、痰液以及透析液样本进行病原分离鉴定,其中98份样本被鉴定为Aeromonas,主要病原为A.hydrophila,A.veronii和A.sobria,其中A.veronii占到13%[30]; 2016年Dallal等[31]对伊朗某儿童医院在2013年至2014年间收集的391份急性和慢性腹泻粪便样本进行分析,发现其中有12例是由Aeromonas引起的,其中又有4例的病原是A.veronii,而且均携带气溶素基因aerA;这表明A.veronii的危害越来越严重,应当引起人们的重视。
在国内,最近几年有关A.veronii感染所引起的水产养殖场疾病暴发的病例越来越多,而且给水产养殖业造成了巨大经济损失。我们以中国知网数据库(CNKI)为基础,对2001年至2015年间国内分离并报道的A.veronii病例进行了统计分析(港澳台除外),发现近年来A.veronii病例逐年增多(图1,其中2015年数据尚不完整),而且在全国的分布范围也较为广泛,特别是四川、广东和江苏等地相关病例报道较多,值得引起人们的警惕。其中有代表性的病例如2011年广东省某鲶鱼养殖场暴发了鲶鱼的“溃疡综合征”,并出现大规模死亡,患病鱼表现为厌食,皮肤开放性溃疡,病死鱼解剖后发现肝脏有明显的出血性病理变化,经病原的分离和鉴定后最终确定病原是A.veronii[32];2012年浙江省甲鱼养殖场暴发流行性疾病,对甲鱼养殖行业造成严重经济损失,患病甲鱼的症状主要表现为贝壳变软,腹部贝壳发皱且伴有生长速度明显下降,被称为“软壳病”,最终经鉴定A.veronii为主要病原[33];2013年5月江西进贤某甲鱼养殖场陆续出现死亡,患病甲鱼症状表现为贝壳出现红白色斑点,四肢和颈部出现溃疡,皮肤溃烂脱落,解剖病死甲鱼发现肝脏肿胀,胃肠道出血并充满粘稠液体,病原分离获得4株优势菌株,经鉴定均为A.veronii[34];2014年8月四川雅安,某水库养殖的加州鲈鱼出现大面积死亡,死亡率高达60%,病鱼主要表现为皮肤溃烂、尾鳍出血、肝脏和肾脏肿大并出血,对其病原进行分离,获得一优势菌株经鉴定为A.veronii[35];2015年4月广东佛山某太阳鱼和黄颡鱼养殖场陆续出现大面积死亡,患病鱼表现为体表溃疡出血,鳞片脱落,解剖后脏器肿大,最终经鉴定确诊为Nacardia和A.veronii共同感染所致[36]。
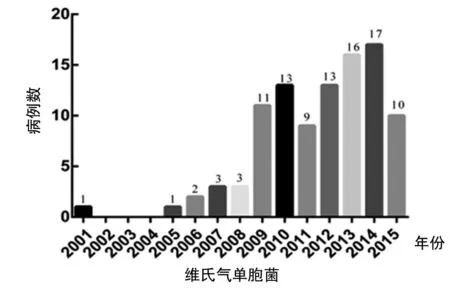
图1 2001-2015年全国A.veronii病例流行情况调查Fig.1 Epidemiological survey of A. veronii cases from 2001 to 2015 in China
目前,国内有关Aeromonas在公共健康领域的病例报道也逐年增多,特别是腹泻和肺炎等病例,其中A.veronii的相关病例报道也越来越多。2007年天津市海河医院接受一名重症肺炎患者,症状主要表现为发热伴有咳嗽、咳痰以及气短等,对其下呼吸道分泌物进行提取鉴定,最终确定病原为A.veronii[37];2010年浙江大学附属第一医院对夏季门诊腹泻患者的1 678份粪便样本进行检测,分离到99株Aeromonas,其中40株A.veronii[38];2013年温州医学院附属医院对2010年6月至2012年5月期间收集的腹泻样本进行检测,共分离出172株Aeromonas,其中A.veronii占3.5%[38];2014年Tang等[39]对台湾南部某医院收集的2009年至2013年间患者治疗记录分析发现,其中Aeromonas阳性患者91人,患者年龄半数在65岁以上,其中由A.veroni引发的共31例占34.1%;2016年贵州疾病预防控制中心对贵州省2012年至2014年间部分腹泻病例样本中的Aeromonas进行分离鉴定,共分离出18株气单胞菌,其中A.veronii占11.11%[40];2016年Wang等人对在2012年间收集的上海浦东新区急性腹泻患者粪便样本进行分析,2 533名腹泻患者中有101名因感染Aeromonas所致,进一步分析发现其中A.veronii占52.5%,而且携带多种毒力因子[41]。上述A.veronii相关病例仅仅是被检测到并报道或发表的,实际发生的感染病例应更多,分析原因一方面混合感染可能使A.veronii被忽略;另一方面,感染早期的抗生素治疗对A.veronii还是较为有效的,这些原因可能导致了目前A.veronii还没有引起人们的足够重视。但考虑到A.veronii在发达国家所引起的公共健康问题以及现在越来越多的研究显示A.veronii的毒力在不断增强,而且其耐药性也在不断增强,其对我国的水产养殖业的危害和公共健康的威胁越来越大,应当引起我们的高度重视。
3 致病机理研究进展
近年来,国内外有关A.veronii病例的报道逐渐增多,相关研究表明A.veronii的毒力在逐渐增强,但目前对A.veronii致病机制了解较少,近年来国内外有关A.veronii毒力因子的研究开始逐渐增多,但也主要是针对单一毒力因子的研究,如外膜蛋白、菌毛、鞭毛、气溶素、溶血素、肠毒素、蛋白酶以及一些黏附因子等;但考虑到A.veronii致病机制的复杂性,仅凭对几种毒力因子的研究难以全面了解其致病机理。目前Aeromonas中有关A.hydrophila,A.caviae和A.salmonicida致病机理的研究相对较多,考虑到其同属Aeromonas,致病机理方面可能存在相似性,因此对以A.hydrophila,A.caviae和A.salmonicida为代表的Aeromonas致病机理相关研究进行归纳总结,以期为A.veronii的致病机理研究提供借鉴。
3.1主要毒力因子 相关研究表明Aeromonas的致病性是多种因素在共同起作用,目前已经被证实的毒力因子有多种,包括外膜蛋白、运动和粘附相关因子、毒素、蛋白酶、群体感应系统、分泌系统以及铁离子获取系统等[42],见图2。Aeromonas毒力因子主要包括以下几类。
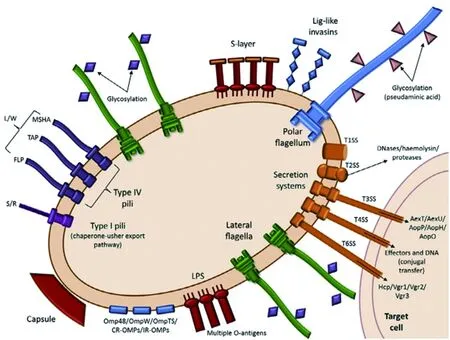
图2 气单胞菌主要毒力因子[42]Fig.2 Major virulence factors in Aeromonas
3.1.1鞭毛 细菌的运动形式主要包括游动、泳动、滑动和旋转等。其中游动性和泳动性与鞭毛密切相关。Aeromonas具有侧生鞭毛或极生鞭毛,不同的Aeromonas菌株所具有的鞭毛类型也不相同。侧生鞭毛形成相关基因主要有flgC、flgE、flgI、flgJ和fliF等三十多个基因,侧生鞭毛系统主要负责细菌的泳动(Swarming motility),侧生鞭毛的糖基化对于菌体的群集运动也是至关重要的[43];极生鞭毛形成相关基因主要有flaA、flaB、flaG、flaH和cheV等六十多个基因,极生鞭毛对于Aeromonas的运动、黏附和入侵等功能必不可少,而且研究表明极生鞭毛的糖基化在引起炎症反应的过程中发挥着重要的作用[44]。
3.1.2菌毛 目前相关研究已表明Aeromonas具有I型、IV型和Mini型菌毛。其中I型菌毛的形成相关基因主要有fimA、fimC、fimD、fimE和fimF等,主要在Aeromonas定殖的初始阶段发挥作用[45]。IV型菌毛又包括3种类型即Flp IV型、MSHA IV型和Tap IV型菌毛,其中Flp IV型菌毛形成关基因主要有flpC、flpD、flpE和flpF等十多个基因,其有助于Aeromonas生物膜的形成和自身凝集;MSHA IV型菌毛形成相关基因主要有mshA、mshB、mshC和mshD等十多个基因,MSHA成束菌毛是Aeromonas组织粘附和定植过程中的主要结构,而且在生物被膜形成过程中发挥重要作用[46];Tap IV型菌毛形成相关基因主要有tapA、tapB、tapC、tapD和tapF等二十多个基因,Tap菌毛的生物合成可能对Aeromonas的毒力产生很强的影响,其具体作用机制仍有待进一步阐明。Hadi等研究表明A.veronii存在IV型菌毛,证实MSHA IV型菌毛在A.veronii定植和生物被膜形成过程中发挥重要作用,当MSHA IV型菌毛的主要形成相关基因mshA和mshB缺失或失活后,其定植能力和生物被膜形成能力明显降低[46]。
3.1.3脂多糖、S层和外膜蛋白 脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性菌特有的表面结构,在炎症和败血症过程中LPS是固有免疫系统的关键激发因子,其表面的O抗原能够保护病原菌免受血清补体的杀伤作用和吞噬,从而介导病原菌的致病性。相关研究表明A.hydrophila和A.salmonicida具有LPS结构,且主要为S型LPS[47]。
S层结构是包裹在菌体最外侧的一层类结晶表层蛋白,大部分病原菌都具有S层结构。目前研究表明所具有S层结构的Aeromonas都有1个共性,均含携带O抗原多糖的LPS,因此对Aeromonas而言,推测LPS可能在S层结构与菌体连接过程或S层糖基化过程中起重要的作用,Kay等已证实S层与A.salmonicida的毒力密切相关[48]。
在Aeromonas的外膜蛋白(Outer membrane protein,Omp)中许多膜蛋白具有黏附作用,如Omp48、OmpG、OmpW、OmpTS以及一些孔蛋白,这些膜蛋白可作为黏附因子或黏附增强剂在Aeromonas的定殖过程中发挥重要的作用[42]。A.veronii的膜蛋白Omp48,一种类LamB样蛋白(麦芽糖转运蛋白)已被证实具有黏附作用,可能与宿主细胞外蛋白的碳水化合物结构域相结合;Quinn等研究认为Aeromonas孔蛋白是一类类凝集素样的黏附蛋白,其有助于菌体粘附到红细胞和肠道上皮细胞表面[49]。
3.1.4蛋白酶和外毒素Aeromonas能够产生一系列的胞外酶,包括蛋白酶、脂肪酶、淀粉酶、几丁质酶、核酸酶和明胶酶等,但并非所有的Aeromonas都能产生这些胞外酶,菌株不同产生的胞外酶也不相同。其中蛋白酶可分为热不稳定性丝氨酸蛋白酶和热稳定性金属蛋白酶,可通过直接损伤宿主细胞或活化毒素来增强Aeromonas的侵染能力;A.hydrophila也已被证实有多种脂肪酶如Ah65、H3、Apl1和Lip等,而且它们与A.hydrophila的致病性密切相关[50],Song等的研究表明金属蛋白酶能够激活A.veronii气溶素的活性,从而使其产生对细胞的毒性作用,证实金属蛋白酶和气溶素都是A.veronii重要的毒力因子[51]。
研究表明Aeromonas也可产生多种外毒素,尽管有些菌株携带外毒素相关基因,但不同的Aeromonas产生的外毒素不同,而且生长条件不同其产生的外毒素也不尽相同。Aeromonas产生的重要毒素主要是肠毒素和溶血素,其中肠毒素又分为细胞毒性肠毒素(Cytotoxic enterotoxin, Act)、不耐热细胞肠毒素(Heat-labile cytotonic enterotoxin, Alt)和耐热细胞肠毒素(Heat-stable cytotonic enterotoxin, Ast),其中Act能够引起溶血、细胞毒性和肠毒性,Act在A.hydrophila的作用已经被证实,可诱导巨噬细胞和上皮细胞产生炎性介质并且可引发细胞凋亡[52],Alt和Ast虽没有溶血和溶细胞活性,但能够增加肠上皮细胞cAMP和前列腺素的水平;溶血素分为α溶血素和β溶血素,其中α溶血素可引起可逆性细胞毒性和不完全溶血,β溶血素可导致细胞的渗透性裂解和完全溶血。
3.1.5分泌系统 目前Aeromonas的分泌系统已经被鉴定有5种,包括I型、II型、III型、IV型及VI型分泌系统,主要负责毒力因子的转运,而且不同的Aeromonas菌株携带的分泌系统也不尽相同。目前有关Aeromonas的I型分泌系统研究较少,生物信息学预测分析表明其可能与毒素的转运有关[42];IV型分泌系统除了跟毒力因子的转运有关外,还可能参与细菌之间遗传物质的接合转移[53];目前对Aeromonas的II型、III型和VI型分泌系统的研究则相对较多,研究认为III型和VI型分泌系统与许多革兰氏阴性菌的毒力密切相关。
Aeromonas的II型分泌系统相关基因主要有exeA、exeB、exeC、exeD、exeE和exeF等十几个基因组成,II型分泌系统对Aeromonas多种毒力因子的分泌至关重要,如溶血素、蛋白酶和DNA酶等;Maltz等研究表明II型分泌系统在A.veronii裂解红细胞和肠道定植过程中发挥着重要作用[54];III型分泌系统是Aeromonas最为重要的一类分泌系统,相关基因较多主要有acr1、acr2、acrG、acrH、acrR和acrV等,目前Aeromonas中A.hydrophila和A.salmonicida的III型分泌系统研究的较为详细[55],III型分泌系统具有一个“注射器”样的针状结构,能够直接将效应因子注入到靶细胞的细胞质中,已知的效应因子有5个分别是AexT、AexU、AopP、AopH和AopO,其中AexT和AexU是双功能毒素,不但具有可使宿主细胞信号通路中断的GTPase激活结构域,而且具有可以破坏宿主细胞骨架并诱导细胞凋亡的ADP-核糖基化结构域,其中AopP、AopH和AopO能够中断宿主细胞信号传导途径并诱导靶细胞中毒[56];Aeromonas的VI型分泌系统相关基因主要有hcp、hcp1、vgrG1和vgrG2等,目前A.hydrophila的VI型分泌系统研究地相对较为详细,其具有一个“噬菌体样的注射体结构”能够直接将毒力因子转运至宿主细胞的细胞质中[57],目前VI型分泌系统已有4种效应因子已被鉴定即Hcp1、Vgr1、Vgr2和Vgr3,其中Hcp是一个功能强大的效应因子,一旦进入靶细胞的细胞质,可激活Caspase3从而引发细胞的凋亡,而且Hcp能够麻痹巨噬细胞以防止被其吞噬,Vgr则是一种ADP-核糖基化毒素能够扰乱宿主细胞骨架并诱导细胞凋亡[58]。
3.1.6铁离子获取系统 铁离子对大多数病原菌来说是不可缺少的营养元素,而且铁离子对病原菌的致病性也至关重要。铁离子的摄取通常需要特殊的转运系统,目前已知的Aeromonas的铁离子摄取机制有两种,一种是铁载体依赖性的摄取机制,一种是不依赖于铁载体的摄取机制。病原菌侵染宿主后能否在其体内存活,铁离子的获取被认为是至关重要的一步,而且铁离子有助于增强病原菌的毒力[59]。目前A.hydrophila和A.salmonicida已被证实具有铁载体依赖性的铁离子摄取系统[60-61]。
3.2致病机理 通过对Aeromonas相关毒力因子的不断发现和认知,人们开始逐渐对Aeromonas的致病机理有了一定的了解,特别是有关伤口感染,胃肠炎以及败血症等致病机理。Janda和Abbott等人[7]在对Aeromonas致病机理进行研究时,认为Aeromonas的感染机制与铜绿假单胞菌有相似之处,特别是涉及的感染步骤和相关毒力因子,因此他们提出了Aeromonas引发伤口感染的模型,如图3所示,这一模型揭示了Aeromonas如何引起表层感染,深层组织感染甚至可能的全身系统性感染。感染过程主要包括3个重要步骤:首先是在伤口位置的附着和初始定植;然后菌体合成并释放蛋白酶,降解宿主细胞蛋白并以此为能量来源,细菌增殖;最后通过细菌的趋化特性,迁移至深层组织。在这一感染过程中有多种Aeromonas毒力因子参与,在伤口部位的附着和定植过程中黏附因子如菌毛、鞭毛以及菌体表面的黏附蛋白起主要作用;在降解宿主细胞蛋白(如胶原蛋白,纤维蛋白以及血清中相关蛋白等)过程中Aeromonas合成的一系列蛋白酶如金属蛋白酶、丝氨酸蛋白酶以及氨肽酶等发挥着重要的作用[62];此外,Aeromonas通过趋化特性参与深层组织感染过程中还涉及趋化因子(如鞭毛等),密度感应系统以及分泌系统等。
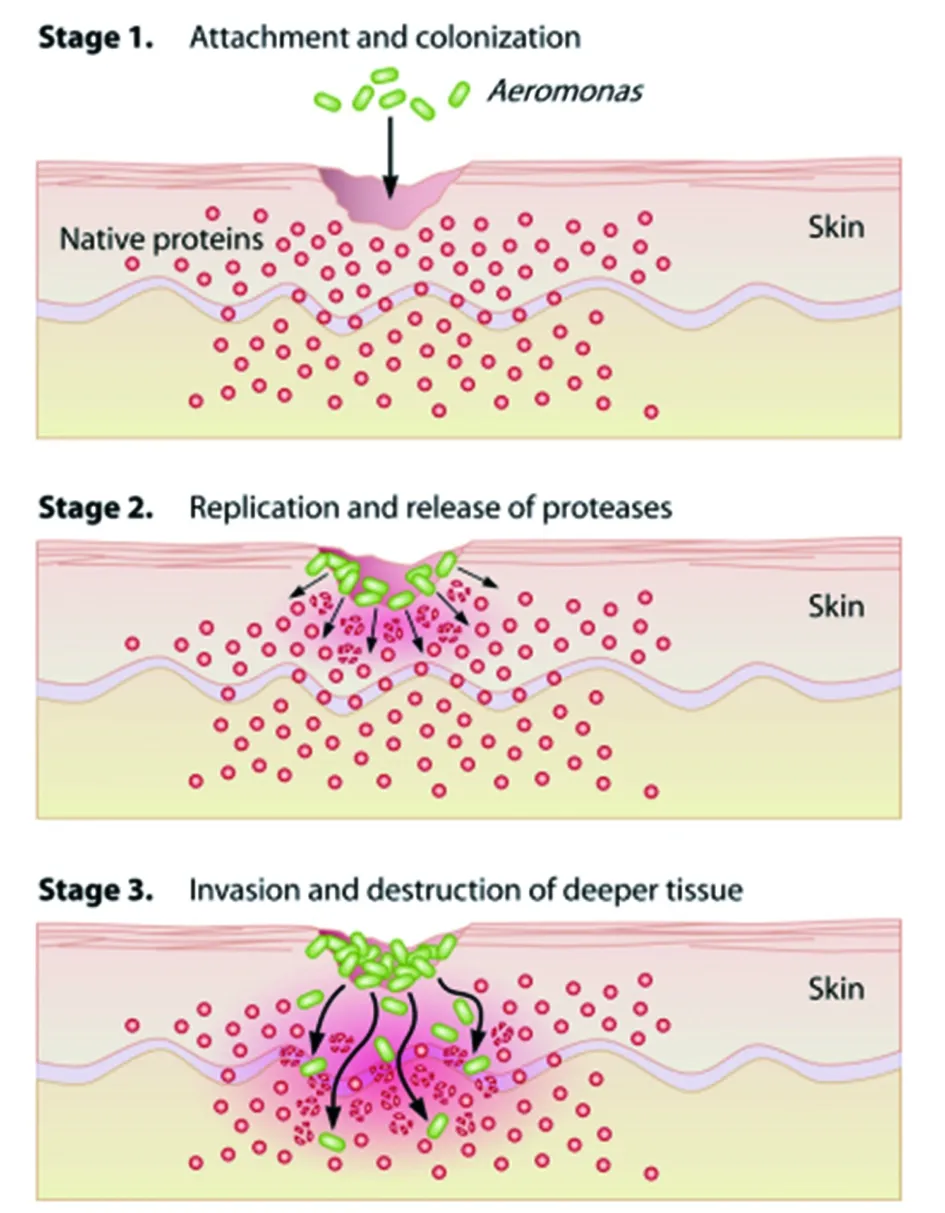
图3 气单胞菌引发伤口感染的模型[7]Fig.3 Hypothetical model of Aeromonas wound infection
Aeromonas引起的胃肠炎一般认为是食用了被污染的食物或水,Aeromonas到达肠道引起炎症反应,必须首先耐受胃酸的作用后到达小肠或大肠,同时要与自体微生物进行竞争并在肠道中定植,这一复杂过程往往需要病原菌众多毒力因子的参与。研究表明Aeromonas引起胃肠炎可能包括以下几个过程:首先借助菌体自身的酸耐受性通过胃液的酸性环境,定向运动并吸附到胃肠道的上皮细胞,形成生物被膜并定植于肠道,最后释放毒力因子并引发感染[7]。其中在Aeromonas的定向运动、吸附以及定植过程中,鞭毛和菌毛发挥着重要的作用;而生物被膜的形成受密度感应系统的调控[63];Aeromonas在肠道完成定植后,通过菌体分泌的肠毒素和溶血素引发肠炎,或者通过进一步侵染胃肠上皮细胞而引起炎症,Aeromonas引发胃肠道炎症反应是其一系列毒力因子共同作用的结果[7]。
目前研究认为大多数原发性Aeromonas败血症是病原菌从胃肠道转移至血液循环系统所引起的。此外,Aeromonas也可能通过感染的伤口、腹膜炎以及胆囊炎等转移至血液循环系统,从而引起继发性败血症。相关研究表明并非所有的Aeromonas都能引起败血症,相反大部分败血症是由很少的一部分Aeromonas所引起,因此分析这些少数病原菌可能是具有某些标记或属性的特定亚群[64]。进一步的研究发现血清型为O∶11、O∶16、O∶18和O∶34的Aeromonas与大多数的败血症病例相关,这表明LPS抗原的结构和类型在引发败血症过程中可能具有重要作用[64];Merino等研究发现Aeromonas所具有的LPS和S层能够抵抗经典补体反应对菌体的裂解作用[50];此外,Krzyminska等研究还发现部分Aeromonas菌株具有逃避巨噬细胞杀伤的机制,而且其分泌的一些代谢产物能够诱导细胞因子并激活炎症反应,这些对于Aeromonas逃避宿主防御机制引发败血症都是至关重要的[65]。
4 展 望
随着A.veronii毒力和耐药性的不断增强,其对我国水产养殖业的危害和公共健康的威胁越来越大,应当引起人们的高度重视。但目前有关A.veronii的研究仍相对较少,因此加强对A.veronii的研究和认识具有重要的公共卫生意义,相信随着人们对A.veronii的重视程度越来越高,有关A.veronii致病机理等相关方面的研究一定会取得重大突破。
参考文献:
[1] Roberts M, Enoch D, Harris K, et al.Aeromonasveroniibiovarsobriabacteraemia with septic arthritis confirmed by 16S rDNA PCR in an immunocompetent adult[J].J Med Microbiol,2006,55(2):241-243. DOI:10.1099/jmm.0.46295-0
[2] Mencacci A, Cenci E, Mazzolla R, et al.Aeromonasveroniibiovarveroniisepticaemia and acute suppurative cholangitis in a patient with hepatitis B[J].J Med Microbiol, 2003,52(8):727-730. DOI:10.1099/jmm.0.05214-0
[3] Wu CJ, Wu JJ, Yan JJ, et al. Clinical significance and distribution of putative virulence markers of 116 consecutive clinicalAeromonasisolates in southern Taiwan[J].J Infect,2007,54(2):151-158. DOI:10.1016/j.jinf.2006.04.002
[4] Wang JT, Fang CT, Hsueh PR, et al. Spontaneous bacterial empyema caused byAeromonasveroniibiotypesobria[J]. Diagn Micr Infec Dis,2000,37(4):271-273. DOI:10.1016/S0732-8893(00)00148-6
[5] Parte AC. LPSN-list of prokaryotic names with standing in nomenclature[J].Nucleic Acids Res, 2014,42(Database issue): 613-616. DOI:10.1093/nar/gkt1111
[6] John DH. Bergey’s manual of determinative bacteriology, 9th ed [M]. Philaclelphia: Lippincott, Williams & Wilkins, 1994,16 (5):520-521.
[7] Janda JM, Abbott SL. The genusAeromonas: taxonomy, pathogenicity, and infection[J]. Clin Microbiol Rev, 2010,23(1):35-73. DOI: 10.1128/CMR.00039-09
[8] Abbott SL, Cheung WK, Janda JM. The genusAeromonas: biochemical characteristics, atypical reactions, and phenotypic identification schemes[J]. J Clin Microbiol,2003,41(6):2348-2357.DOI: 10.1128/JCM.41.6.2348-23 57.2003
[9] Yu JH, Han JJ, Kim HJ, et al. First report ofAeromonasveroniiinfection in farmed Israeli carpCyprinuscarpioin Korea[J]. J Fish Pathol, 2010,23(2):165-176.
[10] Goldschmidt-Clermont E, Wahli T, Frey J, et al. Identification of bacteria from the normal flora of perch, Perca fluviatilis L., and evaluation of their inhibitory potential towardsAeromonasspecies[J].J Fish Dis, 2008,31(5):353-359. DOI: 10.1111/j.1365-2761.2008.00912.x
[11] Austin B, Austin DA.AeromonadaceaeRepresentatives (MotileAeromonads) [M].Berlin: Springer International Publishing,2016,10: 161-214.
[12] Guzman-Murillo M, Ascencio F. Anti-adhesive activity of sulphated exopolysaccharides of microalgae on attachment of red sore disease-associated bacteria andHelicobacterpylorito tissue culture cells[J]. Lett Appl Microbiol, 2000,30(6):473-478. DOI: 10.1046/j.1472-765x.2000.00751.x
[13] Kamilya D, Baruah A. Epizootic ulcerative syndrome (EUS) in fish: history and current status of understanding[J]. Rev Fish Biol Fisher,2014,24(1):369-380. DOI:10.1007/s11160-013-9335-5
[14] Loch TP, Faisal M. Infection of lake whitefish (Coregonusclupeaformis) with motileAeromonasspp. in the Laurentian Great Lakes[J]. J Great Lakes Res,2010,36(1):6-12. DOI:10.1016/j.jglr.2009.07.001
[15] 王旭, 颜其贵, 雷燕, 等. 中国大鲵腐皮病病原菌的分离与鉴定[J].中国人兽共患病学报,2010,26(10): 944-948.DOI:10.3969/j.issn.1002-2694.2010.10.015
[16] 房海, 陈翠珍, 张晓君, 等.中华绒螯蟹病原维氏气单胞菌的检验[J].中国人兽共患病学报,2008,24(1): 45-49.
[17] 陆艳. 泥鳅溃疡病的病原学与病理学研究[D].四川:四川农业大学, 2006.
[18] 范方玲. 四川地区斑点叉尾鮰几种重要细菌性疾病病原检测及病原特性研究[D].四川:四川农业大学,2010.
[19] 徐洋, 蔺凌云, 姚嘉赟, 等. 黄颡鱼“溃疡综合征”病原的分离鉴定及药敏试验[J].淡水渔业,2015,45(5): 100-104.
[20] 潘晓艺, 沈锦玉, 李建应, 等.青虾"软壳综合症"病原及其特性[J].微生物学通报,2009,36(10):1571-1576.
[21] Vila J, Ruiz J, Gallardo F, et al.Aeromonasspp. and traveler’s diarrhea: clinical features and antimicrobial resistance [J]. Emerg Infect Dis, 2003,9(5):552-556. DOI:10.3201/eid0905.020451
[22] Hickman-Brenner F, MacDonald K, Steigerwalt A, et al.Aeromonasveronii, a new ornithine decarboxylase-positive species that may cause diarrhea[J].J Clin Microbiol,1987,25(5):900-906.
[23] 崔树玉, 李景学, 孙启华, 等. 自淡水鱼中分离出一株维隆氏气单胞菌[J].中国卫生检验杂志,1994,4 (3):133.
[24] Aravena-Román M, Inglis TJ, Henderson B, et al. Antimicrobial susceptibilities ofAeromonasstrains isolated from clinical and environmental sources to 26 antimicrobial agents[J].Antimicrob Agents Ch,2012,56(2):1110-1112. DOI:10.1128/AAC.05387-11
[25] Kimura M, Araoka H, Yoneyama A.Aeromonascaviaeis the most frequent pathogen amongst cases ofAeromonasbacteremia in Japan[J]. Scand J Infect Dis, 2013,45(4):304-309. DOI:10.3109/00365548.2012.737474
[26] Esteve C, Alcaide E, Giménez MJ. Multidrug-resistant (MDR)Aeromonasrecovered from the metropolitan area of Valencia (Spain): diseases spectrum and prevalence in the environment[J]. Eur J Clin Microbiol Infect Dis, 2015,34(1):137-145. DOI:10.1007/s10096-014-2210-z
[27] Sinclair HA, Heney C, Sidjabat HE, et al. Genotypic and phenotypic identification ofAeromonasspecies and CphA-mediated carbapenem resistance in Queensland, Australia[J]. Diagn Microbiol Infect Dis, 2016,85(1):98-101. DOI:10.1016/j.diagmicrobio.2016.02.005
[28] Jagoda SDS, Wijewardana T, Arulkanthan A, et al. Characterization and antimicrobial susceptibility of motileaeromonadsisolated from freshwater ornamental fish showing signs of septicaemia[J]. Dis Aquat Organ, 2014,109(2):127-137. DOI:10.3354/dao02733
[29] Uzun E, Ogut H. The isolation frequency of bacterial pathogens from sea bass (Dicentrarchuslabrax) in the Southeastern Black Sea[J]. Aquaculture, 2015,437:30-37. DOI:10.1016/j.aquaculture.2014.11.017
[30] Puthucheary S, Puah SM, Chua KH. Molecular characterization of clinical isolates ofAeromonasspecies from Malaysia[J]. PloS One,2012,7(2):e30205. DOI:10.1371/journal.pone.0030205
[31] Soltan DM, Mazaheri NFR, Kavan TM, et al. Prevalence, virulence and antimicrobial resistance patterns ofAeromonasspp. isolated from children with diarrhea[J]. Germs,2016,6(3):91-96. DOI:10.11599/germs.2016.1094
[32] Cai SH, Wu ZH, Jian JC, et al. Characterization of pathogenicAeromonasveroniibv.veroniiassociated with ulcerative syndrome from Chinese longsnout catfish (Leiocassis longirostris Günther)[J]. Braz J Microbiol, 2012,43(1):382-388. DOI:10.1590/S1517-838220120001000046
[33] Chen J, Zhu N, Kong L, et al. First case of soft shell disease in Chinese soft-shelled turtle (Trionyx sinens) associated withAeromonassobria-A.veroniicomplex[J].Aquaculture,2013,406:62-67. DOI:10.1016/j.aquaculture.2013.05.006
[34] Zhu ZX, Jiang XH, Deng SZ, et al. Isolation, identification andinvitroantimicrobial susceptibility of pathogenicAeromonasveroniifrom soft-shelled turtles[J]. Agr Sci Tech,2016,17(4):804-809.
[35] 龙波, 王均, 贺扬, 等. 加州鲈源维氏气单胞菌的分离、鉴定及致病性[J].中国兽医学报,2016, 36(1): 48-55.
[36] 雷燕. 诺卡式菌和维氏气单胞菌并发引起太阳鱼死亡一例[J].当代水产, 2016(3):84-85.
[37] 李莉, 杜钟珍, 孙昕, 等. 维罗纳气单胞菌致重症肺炎一例并文献复习[J].中华结核和呼吸杂志,2008, 31(10):736-739.
[38] 葛樯樯. 肠道内和肠道外感染气单胞菌的分布、基因分类和耐药性分析[D]. 温州:温州医科大学, 2013.
[39] Tang HJ, Lai CC, Lin HL, et al. Clinical manifestations of bacteremia caused byAeromonasspecies in southern Taiwan[J]. Plos One,2014,9(3):e91642. DOI:10.1371/journal.pone.0091642
[40] 韦小瑜, 游旅, 田克诚, 等. 贵州省腹泻病例气单胞菌分离株种型鉴定及药物敏感性检测分析[J].医学动物防制,2016(6):591-593.
[41] Wang W, Wang D, Zhu L, et al. Infection status and virulent genes ofAeromonasin diarrhea patients in Pudong New Area, Shanghai[J]. Chin J Epidemiol,2016,37(3):402-405. DOI:10.3760/cma.j.issn.0254-6450.2016.03.023
[42] Lowry R, Balboa S, Parker JL, et al.Aeromonasflagella and colonisation mechanisms[J].Adv Microb Physiol, 2014,65:203-256. DOI:10.1016/bs.ampbs.2014.08.007
[43] Sen K, Lye D. Importance of flagella and enterotoxins forAeromonasvirulence in a mouse model[J]. Can J Microbiol, 2007,53(2):261-269. DOI:10.1139/W06-095
[44] Rabaan AA, Gryllos I, Tomas JM, et al. Motility and the polar flagellum are required forAeromonascaviaeadherence to HEp-2 cells[J]. Infect Immun, 2001,69(7):4257-4267. DOI:10.1128/IAI.69.7.4257-4267.2001
[45] Dacanay A, Boyd JM, Fast MD, et al.AeromonassalmonicidaType I pilus system contributes to host colonization but not invasion[J]. Dis Aquat Organ,2010,88(3):199-206. DOI:10.3354/dao02157
[46] Hadi N, Yang Q, Barnett TC, et al. Bundle-forming pilus locus ofAeromonasveroniibv. Sobria[J]. Infect Immun, 2012,80(4):1351-1360. DOI:10.1128/IAI.06304-11
[47] Wang Z, Vinogradov E, Larocque S, et al. Structural and serological characterization of the O-chain polysaccharide ofAeromonassalmonicidastrains A449, 80204 and 80204-1[J].Carbohydr Res, 2005,340(4):693-700. DOI:10.1016/j.carres.2005.01.009
[48] Kay WW, Buckley JT, Ishiguro EE, et al. Purification and disposition of a surface protein associated with virulence ofAeromonassalmonicida[J] J Bacteriol,1981,147(3):1077-1084.
[49] Quinn DM, Atkinson HM, Bretag AH, et al. Carbohydrate-reactive, pore-forming outer membrane proteins ofAeromonashydrophila[J].Infect Immun, 1994,62(9):4054-4058.
[50] Merino S, Wilhelms M, Tomas JM. Role ofAeromonashydrophilaflagella glycosylation in adhesion to Hep-2 cells, biofilm formation and immune stimulation[J]. Int J Mol Sci, 2014,15(12):21935-21946. DOI:10.3390/ijms151221935
[51] Song T, Toma C, Nakasone N, et al. Aerolysin is activated by metalloprotease inAeromonasveroniibiovarsobria[J]. J Med Microbiol, 2004,53(6):477-482. DOI:10.1099/jmm.0.05405-0
[52] Galindo CL, Gutierrez C Jr, Chopra AK. Potential involvement of galectin-3 and SNAP23 inAeromonashydrophilacytotoxic enterotoxin-induced host cell apoptosis[J].Microb Pathog,2006,40(2):56-68. DOI:10.1016/j.micpath.2005.11.001
[53] Rangrez AY, Dayananda KM, Atanur S, et al. Detection of conjugation related type four secretion machinery inAeromonasculicicola[J]. PLoS One,2006,27(1):e115. DOI:10.1371/journal.pone.0000115
[54] Maltz M, Graf J. The type II secretion system is essential for erythrocyte lysis and gut colonization by the leech digestive tract symbiontAeromonasveronii[J]. Appl Environ Microbiol,2011,77(2):597-603. DOI:10.1128/AEM.01621-10
[55] Yu HB, Rao PS, Lee HC, et al. A type III secretion system is required forAeromonashydrophilaAH-1 pathogenesis[J].Infect Immun, 2004,72(3):1248-1256. DOI:10.1128/IAI.72.3.1248-1256.2004
[56] Vilches S, Jimenez N, Tomas JM, et al.AeromonashydrophilaAH-3 type III secretion system expression and regulatory network[J]. Appl Environ Microbiol,2009,75(19):6382-6392. DOI:10.1128/AEM.00222-09
[57] Suarez G, Sierra JC, Kirtley ML, et al. Role of Hcp, a type 6 secretion system effector, ofAeromonashydrophilain modulating activation of host immune cells[J].Microbiology,2010,156(12):3678-3688. DOI:10.1099/mic.0.041277-0
[58] Sha J, Rosenzweig JA, Kozlova EV, et al. Evaluation of the roles played by Hcp and VgrG type 6 secretion system effectors inAeromonashydrophilaSSU pathogenesis [J].Microbiology,2013,159(6):1120-1135. DOI:10.1099/mic.0.063495-0
[59] Braun V. Bacterial iron transport related to virulence[J]. Contrib Microbiol, 2005,12(12):210. DOI:10.1159/000081697
[60] Najimi M, Lemos ML, Osorio CR. Identification of iron regulated genes in the fish pathogenAeromonassalmonicidasubsp.salmonicida: genetic diversity and evidence of conserved iron uptake systems[J].Vet Microbiol, 2009,133(4):377-382. DOI:10.1016/j.vetmic.2008.07.008
[61] Stintzi A, Raymond KN. Amonabactin-mediated iron acquisition from transferrin and lactoferrin byAeromonashydrophila: direct measurement of individual microscopic rate constants[J].J Biol Inorg Chem, 2000,5(1):57-66. DOI:10.1007/PL00010655
[62] Han HJ, Taki T, Kondo H, et al. Pathogenic potential of a collagenase gene fromAeromonasveronii[J]. Can J Microbiol, 2008,54(1):1-10. DOI:10.1139/w07-109
[63] Lynch MJ, Swift S, Kirke DF, et al. The regulation of biofilm development by quorum sensing inAeromonashydrophila[J]. Environ Microbiol, 2002,4(1):18-28. DOI:10.1046/j.1462-2920.2002.00264.x
[64] Janda JM, Guthertz LS, Kokka RP, et al.Aeromonasspecies in septicemia: laboratory characteristics and clinical observations[J].Clin Infect Dis,1994,19(1):77-83. DOI:10.1093/clinids/19.1.77
[65] Krzyminska S, Kaznowski A, Puk M. Interaction ofAeromonasspp. human isolates with murine macrophages[J]. New Microbiol, 2008,31(4):481-488. DOI:10.1053/j.ajkd.2007.02.118
