黄热病毒NS1蛋白的制备及免疫原性鉴定
2018-05-28,,,,,,,
,, ,, ,,,
黄热病毒(YFV)是一种以伊蚊为传播媒介黄病毒科黄病毒属RNA病毒,主要在非洲和南美洲的热带、亚热带地区呈地方性流行[1-2]。2016年3月我国确诊了首例输入性黄热病病例后,随后又发现多例输入性黄热病患者[3-5]。而我国华南地区具有YFV流行区域类似环境,人群及哺乳动物对黄热病毒普遍易感,因此YFV已成为一种潜在威胁华南地区公共安全的虫媒病毒[6-8]。
目前,对于YFV感染仍缺乏有效的治疗措施,接种YFV-17D减毒疫苗可有效预防,控制YFV疫情需要早期确诊YFV感染[9],而当前YFV感染实验室诊断以病毒核酸检测为主[10],该方法对设备和操作人员要求高,试剂昂贵,因而当前需要一种简便、快速抗原检测方法。YFV只有一种血清型,基因全长约12 Kb,可编码3种结构蛋白(E-PrM-C)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)。YFV NS1为分泌性糖蛋白,分子量约45 KD,在感染患者血清中分泌早、滴度高,同病毒RNA的早期复制相关,能够诱导机体免疫应答,是一种早期诊断的靶标[11-12]。本研究旨在制备YFV NS1重组蛋白,研究其免疫学特性,为以NS1蛋白为靶标的抗原检测方法和黄热病毒NS1蛋白功能研究奠定基础。
1 材料与方法
1.1病毒株和实验动物 登革病毒(DENV1-4)、黄热病毒(YFV)、YFV-17D疫苗株、乙脑病毒(JEV)和西尼罗河病毒(WNV)由广州军区疾病预防控制中心保存。以上毒株均在1640培养基培养的昆虫细胞C6/36中增殖,33°C培养3~5 d。观察到细胞病变后,收集感染细胞,超声处理后收集感染细胞超声上清,保存在-80°C 备用。SPF级雄性4~6周Balb/c小鼠和昆明小鼠购于南方医科大学实验动物中心。
1.2主要试剂及工具酶 RT-PCR试剂盒、PCR产物回收试剂盒、DNA连接试剂盒、SphⅠ、SalⅠ限制性内切酶均购于日本TaKaRa公司;NI-NTA亲和层析填料和10 kD蛋白浓缩柱购于德国Qiagen公司;His标签抗体、HRP标记的羊抗鼠IgG购于中国博士德公司;二氨基联苯胺(Diaminobenzidine,DAB)显色液和四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine,TMB)显色液购于中国生工有限公司;弗氏佐剂购于美国Sigma公司、 酶联板购于中国怡新美生物有限公司。
1.3重组质粒pQE30-YFV NS1的构建、转化和筛选 根据GenBank公布的YFV-17D疫苗株序列设计上下游引物(YFV NS1-F、YFV NS1-R),酶切位点分别是SphⅠ、SalⅠ。由上海生工公司优化合成(YFV NS1-F:5′ATAT GCATGC GAT CAA GGA TGC GCC ATC AAC TT 3′YFV NS1-R:5′ATGC GTCGAC TGA AGC CAC TGT GAG TTT CAG CA 3′)。利用病毒RNA提取试剂盒提取YFV-17D疫苗株全基因序列;以YFV NS1-F、YFV NS1-R为引物进行RT-PCR,反应条件为第一步50 ℃ 3 min,第二步94℃ 2 min,第三步94 ℃ 30 s、58 ℃ 35 s、72℃ 2 min共25个循环,扩增出YFV-NS1的基因片段。用限制性内切酶SphⅠ和SalⅠ将YFV NSl基因片段和pQE30载体质粒分别进行双酶切纯化回收;DNA连接试剂盒16℃水浴连接30 min构建重组质粒,将重组质粒转入感受态细胞M15,涂含有Amp和Kan双抗的LB平板后37 ℃培养过夜;挑取数个单克隆菌落进行PCR鉴定和SphⅠ、SalⅠ双酶切鉴定;1%琼脂糖凝胶电泳对PCR产物和酶切产物进行分析,筛选出阳性克隆并保种[7]。
1.4YFV NSl重组蛋白的诱导表达、纯化及复性
挑取阳性克隆的M15菌落接种于含有Amp和Kan双抗的LB培养基,分别在梯度IPTG浓度和不同诱导时间的条件下进行诱导表达,确定最佳诱导条件;提取不溶性重组蛋白包涵体,经8M尿素溶解后,过Ni-NTA层析柱经中高压液相色谱仪进行纯化回收,利用梯度浓度的尿素缓冲液将变性重组蛋白进行复性,1×PBS透析后过蛋白浓缩柱进行浓缩回收,SDS-PAGE电泳鉴定蛋白的复性率及浓度,置-80℃冰箱保存备用。
1.5动物免疫 3只4周龄的Balb/c小鼠免疫方法如下:将弗氏完全佐剂与YFV NS1重组蛋白乳化后免疫小鼠腋窝、腹股沟、50 μg/只;以后每隔14 d以弗氏不完全佐剂与YFV NS1重组蛋白乳化后免疫小鼠背部皮下及足垫;免疫6次后,眼球取血,离心获取小鼠血清。
1.6病毒特异性多克隆腹水制备 登革病毒(DENV1-4)、黄热病毒(YFV)、YFV-17D疫苗株、乙脑病毒(JEV)和西尼罗河病毒(WNV)等病毒特异性多克隆腹水制备方法如下:运用对应的病毒感染细胞超声上清,采用前述方法免疫昆明小鼠4次,在第4次免疫时同时腹腔注射小鼠肉瘤S180细胞收集腹水。寨卡病毒(ZIKA)NS1蛋白免疫小鼠血清为香港大学惠赠。
1.7免疫印记 10% SDS-PAGE分离加热处理过的YFV NS1蛋白和YFV-17D感染细胞超声上清,半干转印仪转印到PVDF膜上,5%脱脂奶粉37 ℃孵育1 h;用DENV1-4、YFV、JEV、WNV免疫小鼠制备S180小鼠肉瘤细胞腹水、ZIKA NS1免疫鼠血清和YFV NS1免疫鼠血清37 ℃孵育YFV NS1蛋白膜1 h,YFV NS1免疫鼠血清和YFV NS1重组蛋白及YFV-17D感染细胞超声上清膜37 ℃孵育1 h;0.1% PBS-T洗膜后HRP-羊抗鼠IgG 37 ℃孵育30 min;洗膜5 min×4次后DAB显色1 min,去离子水终止显色。
1.8间接酶联免疫吸附实验 分别用复性后的YFV NSl蛋白和YFV-17D感染细胞超声上清10 μg/mL包被微孔板,37 ℃包被2 h;加入1% BSA 37 ℃封闭1 h;将稀释后不同浓度DENV1-4、YFV、JEV、WNV等病毒特异性多克隆腹水、ZIKA NS1免疫鼠血清加入包被YFV NSl蛋白的微孔板中37 ℃孵育1 h,YFV NS1免疫小鼠血清加入包被YFV-17D感染细胞超声上清的微孔板中37 ℃孵育1 h,洗板5次;HRP-羊抗鼠IgG 37 ℃孵育30 min,洗板8次;TMB显色10 min,20%H2SO4终止反应,酶标仪测定A450/A630的OD值。小鼠肉瘤S180细胞腹水用于阴性对照,anti-His单抗用于阳性对照。
1.9间接免疫荧光法 YFV 17D感染C6/36细胞4 d后收集感染细胞,按文献报道方法制备细胞涂片[14]。YFV NS1免疫小鼠血清1∶1000稀释液15 μL滴在玻片孔中,37 ℃孵育45 min,PBS洗3次,加入FITC标记羊抗小鼠IgG抗体, 37 ℃孵育30 min,洗涤5次后加1∶200稀释Hoechest33258(中国上海碧云天生物技术有限公司)避光染色10 min,洗涤后再加0.25%伊文氏蓝避光染色10 min,洗涤后用50%甘油封片,荧光显微镜下观察。
2 结 果
2.1黄病毒属病毒NS1序列分析 YFV-17D疫苗株基因序列同Pubmed报道YFV-17D疫苗株(GenBank: U17066.1)完全一致。将该核酸序列在Pubmed中进行BLAST,发现多株来源于不同国家和地区临床分离株序列NS1核酸序列(如塞内加尔,GenBank:JX8998876.1;喀麦隆,GenBank:AV572535.1;巴西,GenBank:JF912180.1;法国,GenBank: U21055.1)同该疫苗株NS1序列完全一致。将该NS1蛋白序列在Pubmed中进行BLAST,发现截止2017年12月7日,Pubmed蛋白库已报道的70株黄热病毒中NS1蛋白序列中同源性为89%~100%(其中14株氨基酸残基完全一致,20株99%氨基酸残基一致,1株98%氨基酸残基一致,2株97%氨基酸残基一致,20株96%氨基酸残基一致,11株93%氨基酸残基一致,1株92%氨基酸残基一致,1株89%氨基酸残基一致),表明NS1蛋白序列在黄热病毒中高度保守。
DENV1-4、JEV、WNV和Zika标准株在Pubmed蛋白库中ACCESSION依次为P27909、P29991、Q99D35、Q5UCB8、P32886、 ABR19639和Q32ZE1。将这些病毒株以及YFV17D基于NS1蛋白序列进化分析,利用MEGA 5.1软件基于邻接法构建系统进化树。黄病毒属病毒间具有不同的遗传距离,Zika同YFV具有较高的同源性(图1A)。黄病毒属病毒NS1蛋白氨基酸残基序列与YFV NS1比对结果表明以上毒株同YFV NS1同源性范围为42%~48%(图1B),从低到高依次为DENV-1、DENV-3、DENV-4、DENV-2、WNV、 JEV和Zika,同进化树结果一致。
2.2pQE30-YFV NS1重组质粒的构建及鉴定 经RT-PCR扩增获得的YFV NSl基因片段长度约1.2 Kb。测序和双酶切重组质粒pQE30-YFV NS1鉴定结果表明目的基因正确插入载体质粒。
2.3His-YFV NS1融合蛋白的诱导表达、纯化及复性 利用10%SDS-PAGE电泳分析不同诱导条件下的蛋白表达量,发现37 ℃、0.1 mmol/L IPTG诱导4 h条件下,目的蛋白表达量最高;目的蛋白分子量约为46 kD与预测蛋白分子量相符合。目的蛋白以不溶性包涵体形式存在,8 mmol/L尿素变性溶解后,经NI-NTA层析柱纯化回收可获得高纯度的His-NS1融合蛋白,经复性透析后获得可溶性NS1蛋白浓度约为0.3 mg/mL(图2)。
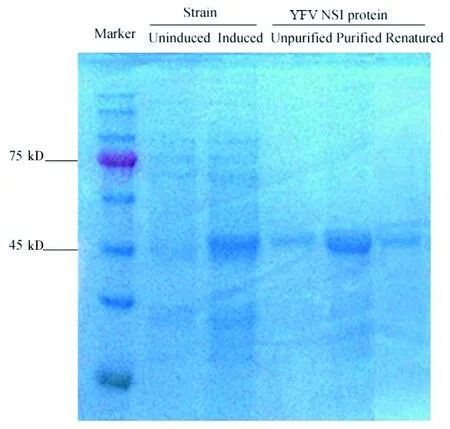
图2 His-YFVNS1融合蛋白的表达、纯化及复性Fig.2 Expression, purification and renaturation of His-YFVNS1 fusion protein
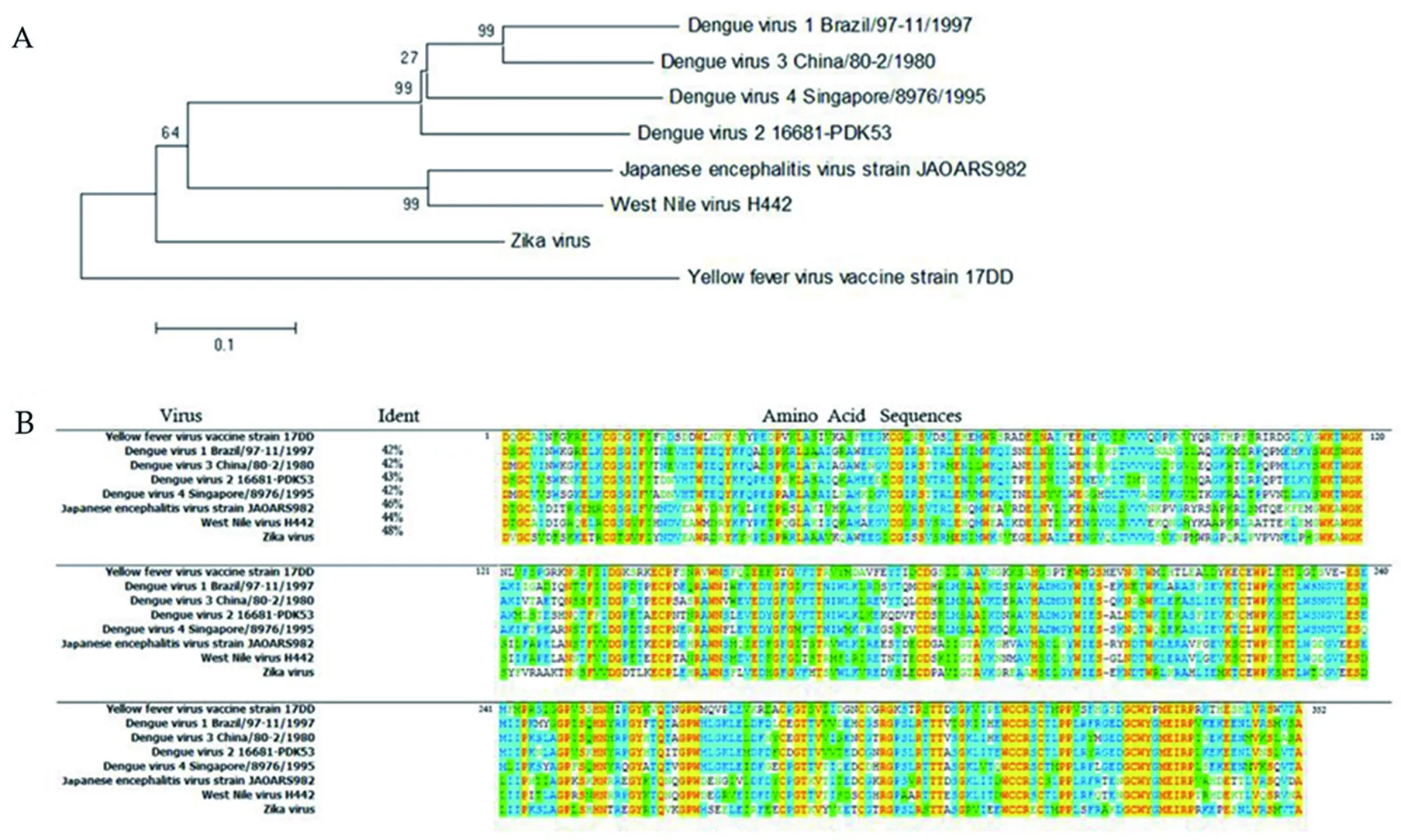
图1 黄病毒属病毒NS1蛋白系统进化树及氨基酸残基序列比对(A系统进化树B氨基酸残基序列比对)Fig.1 Phylogenetic tree based on the complete amino acid sequences of flavivirus NS1 and alignments of amino acid sequences of flavivirus NS1 (A phylogenetic tree B alignments of amino acid sequences)
2.4YFV NS1重组蛋白免疫原性的鉴定 采用免疫印记(WB)、酶联免疫吸附实验(ELISA)和免疫荧光方法(IFA)等方法鉴定YFV NS1重组蛋白的抗原性。
YFV NS1重组蛋白免疫小鼠制备特异性针对YFVNS1重组蛋白小鼠血清。采用WB和IFA 方法鉴定抗YFVNS1重组蛋白小鼠血清与YFV-17D感染C6/36细胞超声上清、YFV NS1重组蛋白以及感染YFV C6/36细胞的反应性,验证重组蛋白免疫原性(图3)。重组YFVNS1免疫小鼠血清能够同重组YFVNS1反应,表明YFV NS1蛋白具有很好的免疫原性,同含天然NS1蛋白的YFV-17D感染C6/36细胞超声上清反应,免疫荧光也为阳性,表明其诱导抗体能够识别天然蛋白和重组蛋白,提示重组NS1蛋白中存在类似的天然NS1蛋白表位。
制备DENV1-4、YFV、JEV、和WNV等病毒特异性多克隆腹水。YFVNS1重组蛋白与上述虫媒病毒特异性多克隆腹水、YFVNS1重组蛋白免疫小鼠血清、ZIKA NS1重组蛋白免疫小鼠血清及His单抗反应性见图4。结果表明该重组蛋白能够同抗天然YFV病毒多抗反应,进一步提示该重组蛋白同天然NS1蛋白具有相似的表位。其他常见虫媒病毒特异性多抗腹水也能同该重组蛋白反应,表明虫媒病毒NS1蛋白间存在交叉表位。
A免疫印记 B免疫荧光图3 YFV NS1重组蛋白免疫小鼠血清鉴定重组蛋白免疫学特性Fig.3 Immunogenity identification of the recombinant YFV NS1 by sera from recombinant YFV NS1-immunized mice
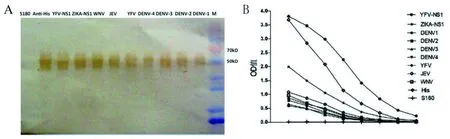
A:免疫印记,B:酶联免疫吸附实验图4 YFV NS1重组蛋白的交叉反应性Fig.4 Identification of the recombinant YFV NS1 by Western blot and ELISA
3 讨 论
YFV NS1蛋白主要以膜型存在于感染细胞膜上,同时也以六聚体形式分泌到体液中[12],具有较强的免疫原性,是诱导体液免疫的主要蛋白之一。在YFV人源敏感细胞中,YFV感染后24 h即可在培养上清中检测到分泌型NS1[13],而48 h才能在上清中检测到病毒RNA(本实验室未发表数据);正常人接种YFV17D疫苗后3~10 d血液中不能检测到NS1蛋白,而RNA阳性YFV感染病人中能够检测到[13],提示NS1蛋白是一种较好的黄热病毒感染早期诊断的标志物。核酸序列比对结果发现YFV17D NS1同来源于不同国家和地区的病毒临床分离株的NS1核酸序列完全一致,同当前Pubmed报道的YFV临床分离株中NS1蛋白中氨基酸残基序列同源性为89%~100%,提示NS1蛋白在YFV临床分离株中高度保守,来源于疫苗株的NS1蛋白同临床分离株具有相同免疫学特性,表明以该蛋白为靶标具有通用性,能够用于检测来源于不同地区病毒株YFV感染,进一步证实NS1蛋白可作为黄热病毒感染早期诊断的标志物。
原核表达的YFV NS1重组蛋白同来源于含天然YFV NS1的YFV感染细胞超声上清免疫小鼠的腹水发生明显的反应,提示原核表达重组蛋白虽然没有天然蛋白糖基化位点,但重组蛋白仍保持天然蛋白的某些构象,包含类似天然蛋白表位。单纯YFV重组蛋白免疫小鼠血清能与含有天然蛋白的病毒感染敏感细胞及其细胞超声上清反应,进一步证实重组蛋白中包含类似天然蛋白表位,能够诱导产生针对天然蛋白的抗体。因此,采用重组蛋白免疫制备的单抗可用于建立以NS1为靶标的双抗夹心法检测方法。
YFV NS1重组蛋白同黄病毒属其它病毒特异性多抗也具有交叉反应,提示黄病毒属NS1中存在这些交叉反应性的表位。基于NS1蛋白序列进化分析结果也表明黄病毒属病毒间进化关系,为这些交叉表位存在提供理论基础。YFV NS1蛋白氨基酸残基序列同其它黄病毒属病毒如DENV、JEV、WNV、Zika等病毒标准株NS1氨基酸残基相似性从42%~48%,进一步证实NS1蛋白中存在交叉反应性表位。氨基酸残基序列比对结果也提示NS1蛋白中存在YFV特异性氨基酸残基序列,因此,该蛋白也存在YFV特异性表位,同相关文献报道针对YFV NS1蛋白的YFV特异性的单抗相一致[13]。在前期研究中采用登革病毒NS1[14]和包膜蛋白3区[15]重组蛋白制备一批登革病毒特异性单抗,在下一步研究中采用重组YFV NS1蛋白和病毒感染细胞超声上清共同作为免疫原交叉免疫小鼠,筛选针对NS1的YFV特异性单抗。
本研究以疫苗株YFV17D NS1序列为模板,构建重组质粒pQE30-YFV NS1,并优化YFV NS1重组蛋白的表达、纯化及复性条件,制备YFV NS1重组蛋白并鉴定其免疫学特性,结果表明该重组蛋白具有良好的免疫原性,为以NS1为靶标的双抗夹心法检测方法建立和蛋白功能研究奠定基础。
参考文献:
[1] Otshudiema JO, Ndakala NG, Mawanda EK, et al. Yellow fever outbreak-kongo central province, democratic republic of the congo[J]. Morb Mortal Wkly Rep,2017, 66(12): 335-338.DOI: 10.15585/mmwr.mm6612a5
[2] Auguste AJ, Lemey P, Bergren NA, et al. Enzootic transmission of yellow fever virus, Venezuela[J]. Emerg Infect Dis, 2015, 21(1): 99-102. DOI: 10.3201/eid2101.140814
[3] Ling Y, Chen J, Huang Q, et al. Yellow fever in a worker returning to China from Angola[J]. Emerg Infect Dis, 2016. 22(7): 1317-1318. DOI: 10.3201/eid2207.160469
[4] 吕燕宁, 李洁, 陈丽娟,等. 中国首例黄热病输入病例的实验室检测[J]. 首都公共卫生. 2016. 10(2): 61-63. DOI: 10.16760/j.cnki.sdggws.2016.02.004
[5] 宋灿磊, 郑雅旭, 刘天,等. 上海市首例黄热病病例的确认及其现场流行病学调查分析[J].中华疾病控制杂志, 2017, 21(16): 644-646. DOI: 10.16462 / j.cnki.zhjbkz.2017.06.026
[6] Wilder-Smith A, Gubler DJ, Weaver SC, et al. Epidemic arboviral diseases: priorities for research and public health[J]. Lancet Infect Dis, 2017, 17(3): e101-e106. DOI: 10.1016/S1473-3099(16)30518-7
[7] Wang L, Zhou P, Fu X, et al. Yellow fever virus: Increasing imported cases in China[J]. J Infect, 2016, 73(4): 377-380. DOI: 10.1186/s12936-016-1504-2
[8] Shearer FM, Moyes CL, Pigott DM, et al. Global yellow fever vaccination coverage from 1970 to 2016: an adjusted retrospective analysis[J]. Lancet Infect Dis, 2017, DOI: 10.1016/S1473-3099(17)30419-X
[9] 谭维国, 贾德胜, 谭伟龙,等. 黄热病疫情及防控对策[J]. 中华卫生杀虫药械, 2016, 22(3): 220-224.
[10] 凌云, 卢洪洲. 黄热病的流行病学及诊断学进展[J]. 新发传染病电子杂志, 2017, 2(2): 65-67.
[11] Akey DL, Brown WC, Dutta S, et al. Flavivirus NS1 structures reveal surfaces for associations with membranes and the immune system[J]. Science, 2014, 343(6173): 881-885. DOI: 10.1126/science.1247749
[12] Rastogi M, Sharma N, Singh SK. Flavivirus NS1: a multifaceted enigmatic viral protein[J]. Virol J, 2016, 13: 131. DOI: 10.1186/s12985-016-0590-7
[13] Ricciardi-Jorge T, Bordignon J, Koishi A,et al. Development of a quantitative NS1-capture enzyme-linked immunosorbent assay for early detection of yellow fever virus infection[J]. Sci Rep, 2017, 7(1): 16229. DOI: 10.1038/s41598-017-16231-6
[14] Chen Y, Pan Y, Guo Y, et al. Comprehensive mapping of immunodominant and conserved serotype- and group-specific B-cell epitopes of nonstructural protein 1 from dengue virus type 1[J]. Virology, 2010, 398(2): 290-298. DOI: 10.1016/j.virol.2009.12.010
[15] 林亚英, 丁细霞, 朱伟,等. Ⅰ型登革病毒包膜蛋白Ⅲ区中和抗体的制备与鉴定[J]. 免疫学杂志, 2015, 31(8): 706-711. DOI: 10.13431/j.cnki.immunol.j.20150150
